名校
1 . 回答下列问题:
Ⅰ.在一定温度下,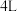 密闭容器内某一反应中气体
密闭容器内某一反应中气体 、气体
、气体 的物质的量随时间变化的曲线如图:
的物质的量随时间变化的曲线如图:___________ 。
(2)比较 时刻,正逆反应速率大小:
时刻,正逆反应速率大小:
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(3) 时刻反应物的转化率为
时刻反应物的转化率为___________ 。
(4)如果升高温度,则
___________ (填“增大”“减小”或“不变”)。
Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示。
(5)①本实验待测数据可以是___________ ,实验Ⅰ和实验Ⅱ可以探究___________ 对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是___________ 。
(6)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中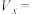
___________ 。
Ⅰ.在一定温度下,
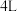 密闭容器内某一反应中气体
密闭容器内某一反应中气体 、气体
、气体 的物质的量随时间变化的曲线如图:
的物质的量随时间变化的曲线如图: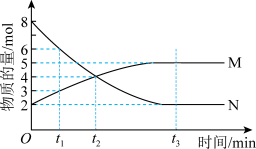
(2)比较
 时刻,正逆反应速率大小:
时刻,正逆反应速率大小:
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(3)
 时刻反应物的转化率为
时刻反应物的转化率为(4)如果升高温度,则

Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示。
| 实验序号 | 纯锌粉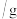 |  硫酸溶液 硫酸溶液 | 温度 | 硫酸铜固体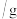 | 加入蒸馏水 |
| Ⅰ |  | 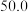 | 25 | 0 | 0 |
| Ⅱ |  |  | 25 | 0 |  |
| Ⅲ |  | 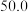 | 25 |  | 0 |
| Ⅳ |  | 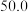 | 25 |  | 0 |
(5)①本实验待测数据可以是
②实验Ⅲ和实验Ⅳ的目的是
(6)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积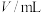 | ||||
 溶液 溶液 | 水 |  溶液 溶液 |  溶液 溶液 | 淀粉溶液 | |
| ① |  |  |  |  |  |
| ② |  | 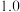 |  |  |  |
| ③ |  |  |  |  |  |
您最近一年使用:0次
名校
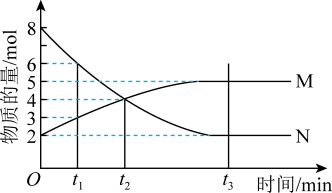
2 . Ⅰ.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图: 时刻,正逆反应速率大小
时刻,正逆反应速率大小
___________  。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(2)若 min,计算反应开始至
min,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率___________ 。
(3) 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为___________ 。
(4)写出反应的化学方程式___________ 。
(5)如果升高温度,则
___________ (填“增大”“减小”或“不变”)。
Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
(6)①本实验待测数据可以是___________ ,实验Ⅰ和实验Ⅱ可以探究___________ ,对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是___________ 。
(7)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中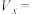
___________ 。
 时刻,正逆反应速率大小
时刻,正逆反应速率大小
 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)(2)若
 min,计算反应开始至
min,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率(3)
 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为(4)写出反应的化学方程式
(5)如果升高温度,则

Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
| 序号 | 纯锌粉/g | 2.0 硫酸溶液/mL 硫酸溶液/mL | 温度/℃ | 硫酸铜固体/g | 加入蒸馏水/mL |
| Ⅰ | 2.0 | 50.0 | 25 | 0 | 0 |
| Ⅱ | 2.0 | 40.0 | 25 | 0 | 10.0 |
| Ⅲ | 2.0 | 50.0 | 25 | 0.2 | 0 |
| Ⅳ | 2.0 | 50.0 | 25 | 4.0 | 0 |
(6)①本实验待测数据可以是
②实验Ⅲ和实验Ⅳ的目的是
(7)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
 溶液 溶液 | 水 | KI溶液 |  溶液 溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 |  | 4.0 | 4.0 | 2.0 |
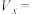
您最近一年使用:0次
名校
解题方法
3 . 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。___________ 。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=___________ 。
(3)2min反应达到平衡时体系内的压强比起始时的压强___________ (填增大、减小或无变化);平衡时混合气体密度和起始时相比___________ (填增大、减小或无变化)。
(4)下列说法正确的是___________。

(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=
(3)2min反应达到平衡时体系内的压强比起始时的压强
(4)下列说法正确的是___________。
| A.使用催化剂不可以使化学平衡发生移动。 |
| B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢 |
| C.增大Y的浓度,正反应速率加快,逆反应速率减慢 |
| D.化学反应的限度是不可能改变的 |
您最近一年使用:0次
名校
解题方法
4 . 碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是_______ 。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_______ 。
(2)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g) N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=___ 。
②该反应的△H_____ 0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡_____ (填“正向”、“逆向”或“不”)移动。
(3)H2A为二元弱酸。室温下配制一系列c(H2A)+c(HA−)+c(A2−)=0.100 mol∙L−1的H2A与NaOH的混合溶液。测得H2A、HA−、A2−的物质的量分数c(x)%(c(x)%= ×100%)随pH变化如图所示。
×100%)随pH变化如图所示。_______ 。
②室温下,若将0.100 mol∙L−1的H2A与a mol∙L−1的NaOH溶液等体积混合,使溶液的pH=7。则H2A的Ka2=______ mol∙L−1 (用a表示)
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ)。平衡时PSO3-T的关系如下图所示。660K时,该反应的平衡常数Kp(Ⅰ)=
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ)。平衡时PSO3-T的关系如下图所示。660K时,该反应的平衡常数Kp(Ⅰ)=______ (kPa)2,Kp (Ⅰ)随反应温度升高而______ (填“增大”“减小”或“不变”)。
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是
(2)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g)
 N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
| N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②该反应的△H
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡
(3)H2A为二元弱酸。室温下配制一系列c(H2A)+c(HA−)+c(A2−)=0.100 mol∙L−1的H2A与NaOH的混合溶液。测得H2A、HA−、A2−的物质的量分数c(x)%(c(x)%=
 ×100%)随pH变化如图所示。
×100%)随pH变化如图所示。
②室温下,若将0.100 mol∙L−1的H2A与a mol∙L−1的NaOH溶液等体积混合,使溶液的pH=7。则H2A的Ka2=
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s)
 Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ)。平衡时PSO3-T的关系如下图所示。660K时,该反应的平衡常数Kp(Ⅰ)=
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ)。平衡时PSO3-T的关系如下图所示。660K时,该反应的平衡常数Kp(Ⅰ)=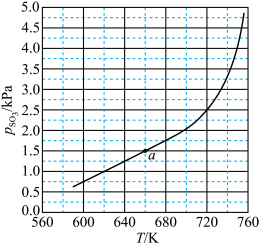
您最近一年使用:0次
2024高三下·全国·专题练习
5 . 雾霾主要成分为灰尘、SO2、NOx和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
(1)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
①T1___________ T2(填“<"、“>”或“无法确定”),该反应的 H
H___________ 0(填“<”或“>”)。
②0~25min内乙容器中反应的平均速率:v(NO2)=___________ 。
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为___________ ,平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数)。
(1)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:

| 容器 | 甲 | 乙 |
| 温度/K | T1 | T2 |
| 容积/L | 2 | |
| 起始充入量 | 4molNO2和2molO3 | |
 H
H②0~25min内乙容器中反应的平均速率:v(NO2)=
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为
您最近一年使用:0次
2024高三下·全国·专题练习
6 . 在“碳达峰”“碳中和”的发展背景下, 催化加氢合成甲醇是重要的碳捕获利用与封
催化加氢合成甲醇是重要的碳捕获利用与封
存技术,该过程主要发生下列反应:
反应①

反应②

回答下列问题:
(1)①现向2L恒容密闭容器中加入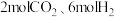 ,在恒温下发生上述反应。10s后反应达到平衡,此时容器内
,在恒温下发生上述反应。10s后反应达到平衡,此时容器内 的浓度为
的浓度为 ,CO为
,CO为 。则前10s内的平均反应速率
。则前10s内的平均反应速率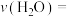
___________ 。
(2)0.5MPa下,将 的混合气体以一定流速通过装有催化剂的反应器,测得
的混合气体以一定流速通过装有催化剂的反应器,测得 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[ ]以及
]以及 的产率(
的产率( 的转化率×
的转化率× 的选择性)随温度的变化如图2所示。
的选择性)随温度的变化如图2所示。___________ (填“ ”或“CO”)的选择性随温度的变化,270℃时,对应
”或“CO”)的选择性随温度的变化,270℃时,对应 的转化率为
的转化率为___________ ;在210~250℃之间, 的产率增大的原因是
的产率增大的原因是___________ 。
 催化加氢合成甲醇是重要的碳捕获利用与封
催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:
反应①


反应②


回答下列问题:
(1)①现向2L恒容密闭容器中加入
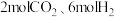 ,在恒温下发生上述反应。10s后反应达到平衡,此时容器内
,在恒温下发生上述反应。10s后反应达到平衡,此时容器内 的浓度为
的浓度为 ,CO为
,CO为 。则前10s内的平均反应速率
。则前10s内的平均反应速率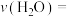
(2)0.5MPa下,将
 的混合气体以一定流速通过装有催化剂的反应器,测得
的混合气体以一定流速通过装有催化剂的反应器,测得 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[ ]以及
]以及 的产率(
的产率( 的转化率×
的转化率× 的选择性)随温度的变化如图2所示。
的选择性)随温度的变化如图2所示。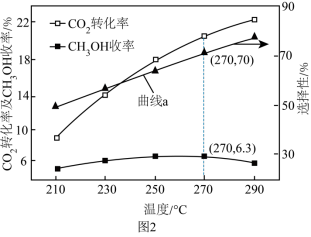
 ”或“CO”)的选择性随温度的变化,270℃时,对应
”或“CO”)的选择性随温度的变化,270℃时,对应 的转化率为
的转化率为 的产率增大的原因是
的产率增大的原因是
您最近一年使用:0次
2024高三下·全国·专题练习
7 . 某科研团队利用 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
(1) 均为
均为 的恒容密闭容器,向
的恒容密闭容器,向 容器中充入
容器中充入 和
和 ,向
,向 容器中充入
容器中充入 和
和 ,在催化剂存在下发生反应:
,在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图甲所示。
的平衡转化率随温度的变化如图甲所示。 容器中在温度为
容器中在温度为 时,
时, 到达
到达 点,用
点,用 表示
表示 内的化学反应速率为
内的化学反应速率为
___________ ,此时的化学平衡常数 为
为___________ (保留两位小数),若在此温度下时向 容器的平衡体系中再充入
容器的平衡体系中再充入 各
各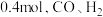 各
各 ,重新达到平衡前,
,重新达到平衡前,
___________  (填“
(填“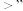 “
“ ”或
”或 )。
)。
② 点时该反应的平衡常数为
点时该反应的平衡常数为 ,则
,则
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③ 两点处容器内气体总压强分别是
两点处容器内气体总压强分别是 ,则
,则 的大小顺序为
的大小顺序为___________ 。
 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:(1)
 均为
均为 的恒容密闭容器,向
的恒容密闭容器,向 容器中充入
容器中充入 和
和 ,向
,向 容器中充入
容器中充入 和
和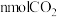 ,在催化剂存在下发生反应:
,在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图甲所示。
的平衡转化率随温度的变化如图甲所示。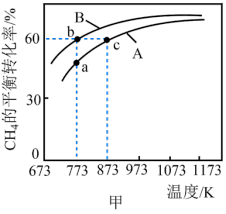
 容器中在温度为
容器中在温度为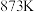 时,
时, 到达
到达 点,用
点,用 表示
表示 内的化学反应速率为
内的化学反应速率为
 为
为 容器的平衡体系中再充入
容器的平衡体系中再充入 各
各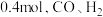 各
各 ,重新达到平衡前,
,重新达到平衡前,
 (填“
(填“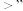 “
“ ”或
”或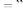 )。
)。②
 点时该反应的平衡常数为
点时该反应的平衡常数为 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③
 两点处容器内气体总压强分别是
两点处容器内气体总压强分别是 ,则
,则 的大小顺序为
的大小顺序为
您最近一年使用:0次
2024高三下·全国·专题练习
8 .  是重要的化工原料,合理使用
是重要的化工原料,合理使用 能发挥其在工业生产、物质合成、速率分析等领域的重要作用。
能发挥其在工业生产、物质合成、速率分析等领域的重要作用。
(1)650K时,某研究小组测得反应i: 的浓度、速率数据如下:
的浓度、速率数据如下:
已知k为速率常数,一般情况下只与温度有关,实验测得
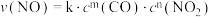 ,通过以上实验数据可知
,通过以上实验数据可知
___________ ,
___________ ;650K时,若 ,
, ,
,
___________  。
。
 是重要的化工原料,合理使用
是重要的化工原料,合理使用 能发挥其在工业生产、物质合成、速率分析等领域的重要作用。
能发挥其在工业生产、物质合成、速率分析等领域的重要作用。(1)650K时,某研究小组测得反应i:
 的浓度、速率数据如下:
的浓度、速率数据如下:| 实验编号 | 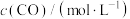 |  |  |
| ① | 0.025 | 0.040 | 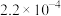 |
| ② | 0.050 | 0.040 |  |
| ③ | 0.025 | 0.120 |  |
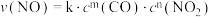 ,通过以上实验数据可知
,通过以上实验数据可知

 ,
, ,
,
 。
。
您最近一年使用:0次
2024高三下·全国·专题练习
9 . 一定条件下,水气变换反应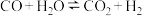 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
I.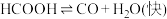
II.
研究发现,在反应I、II中, 仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)反应I正反应速率方程为: ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为___________  ,此时反应I的反应速率
,此时反应I的反应速率
___________  (用含
(用含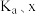 和k的代数式表示)。
和k的代数式表示)。
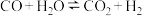 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:I.
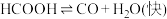
II.

研究发现,在反应I、II中,
 仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:(1)反应I正反应速率方程为:
 ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为 ,此时反应I的反应速率
,此时反应I的反应速率
 (用含
(用含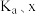 和k的代数式表示)。
和k的代数式表示)。
您最近一年使用:0次
10 . 工业合成氨中,常用亚铜盐的氨水溶液除去原料气中的 以防止催化剂中毒,反应的离子方程式为
以防止催化剂中毒,反应的离子方程式为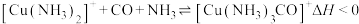 。吸收CO时,溶液中[Cu(NH3)2]+和[Cu(NH3)2CO]+的浓度(mol·L-1)变化情况如下:
。吸收CO时,溶液中[Cu(NH3)2]+和[Cu(NH3)2CO]+的浓度(mol·L-1)变化情况如下:
1.欲充分吸收CO,适宜的条件是_____。(不定项)
2.前30min[Cu(NH3)2]+的平均反应速率为_____ 。
3.60min时改变的条件可能是_____ 。
4.其他条件不变时,下列说法正确的有_____。(不定项)
5.基态铜原子的未成对电子数为_____ ,铜元素的焰色试验为绿色,为_____ (填“发射”或“吸收”)光谱。
6.无色的亚铜盐的氨水溶液放置一段时间的话,会变成深蓝色的溶液,请解释可能的原因_____ 。
 以防止催化剂中毒,反应的离子方程式为
以防止催化剂中毒,反应的离子方程式为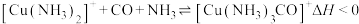 。吸收CO时,溶液中[Cu(NH3)2]+和[Cu(NH3)2CO]+的浓度(mol·L-1)变化情况如下:
。吸收CO时,溶液中[Cu(NH3)2]+和[Cu(NH3)2CO]+的浓度(mol·L-1)变化情况如下:| 0min | 30min | 45min | 60min | 90min | |
| [Cu(NH3)2]+ | 2.0 | 1.2 | 0.9 | 0.9 | 1.8 |
| [Cu(NH3)2CO]+ | 0 | a | 1.1 | 1.1 | 0.2 |
| A.升高温度 | B.增大压强 | C.增大亚铜盐浓度 | D.加水 |
3.60min时改变的条件可能是
4.其他条件不变时,下列说法正确的有_____。(不定项)
A. 与 与 的浓度相等时,反应达到平衡 的浓度相等时,反应达到平衡 |
B.平衡后增大 的浓度, 的浓度, 的转化率增大 的转化率增大 |
C.平衡后加水稀释, 与 与 的浓度之比增大 的浓度之比增大 |
D.可采用加热 溶液的方法实现 溶液的方法实现 的再生 的再生 |
6.无色的亚铜盐的氨水溶液放置一段时间的话,会变成深蓝色的溶液,请解释可能的原因
您最近一年使用:0次



