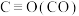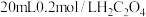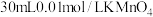1 . 氮氧化物( 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。
(1)反应 分为三步基元反应完成。
分为三步基元反应完成。
第一步: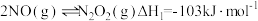 决速步骤)
决速步骤)
第二步: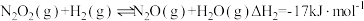
①活化能最高的是第___________ 步。
②为了提高总反应中NO的反应速率和转化率可采用的措施为___________ (写两条)。
(2)已知反应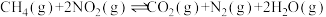 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入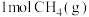 和
和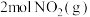 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
①用 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为___________ 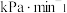 。
。
②该温度下的压强平衡常数
___________ kPa。
(3)NO催化分解ICl制取 和
和 的原理为:
的原理为:
反应I: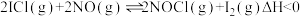 ;
;
反应Ⅱ: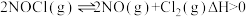 ;
; 。
。
反应的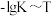 的关系如图所示。
的关系如图所示。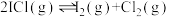 的
的
___________
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。 的电极反应式为
的电极反应式为___________ 。
②当电解电压为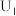 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。(1)反应
 分为三步基元反应完成。
分为三步基元反应完成。第一步:
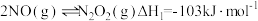 决速步骤)
决速步骤)第二步:
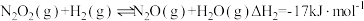
①活化能最高的是第
②为了提高总反应中NO的反应速率和转化率可采用的措施为
(2)已知反应
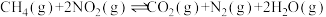 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入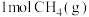 和
和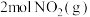 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:| 反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
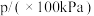 | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为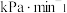 。
。②该温度下的压强平衡常数

(3)NO催化分解ICl制取
 和
和 的原理为:
的原理为:反应I:
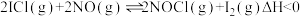 ;
;
反应Ⅱ:
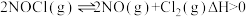 ;
; 。
。反应的
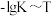 的关系如图所示。
的关系如图所示。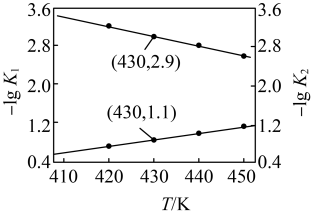
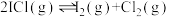 的
的
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为
 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
 的电极反应式为
的电极反应式为②当电解电压为
 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
2 . I.在恒温2L密闭容器中通入气体X并发生放热反应:2X(g) Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)______ 。
(2)图中c点对应的速率关系是v(正)______ v(逆)(填“>”或“<”或“=”);b曲线与a比改变的条件是______ 。
(3)反应进行到a点时放出的热量______ 反应进行到b点时放出的热量(填“>”或“<”或“=”)。
II.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。______ (计算保留2位有效数字)。
(5)能说明上述反应达到平衡状态的是______ (填字母)。
(6)平衡时CH3OH的体积分数为______ 。平衡混合气体中CO2(g)和H2(g)的质量之比是______ 。
(7)第3分钟时v正(CH3OH)______ 第9分钟时v逆(CH3OH)(填“>”“<”“=”或“无法比较”)。
III.在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。______ 。
(9)a、b、c、d四个点中,表示化学反应处于平衡状态的点是______ 。
 Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
| A.升高温度 | B.加入适量X |
| C.增大压强 | D.及时分离出Y |
(2)图中c点对应的速率关系是v(正)
(3)反应进行到a点时放出的热量
II.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(5)能说明上述反应达到平衡状态的是
| A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点) |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内生成1molH2,同时生成1molCH3OH |
| D.混合气体的平均相对分子质量不随时间的变化而变化 |
(6)平衡时CH3OH的体积分数为
(7)第3分钟时v正(CH3OH)
III.在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。

(9)a、b、c、d四个点中,表示化学反应处于平衡状态的点是
您最近一年使用:0次
名校
3 . 2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨CO2。该甲醇的制备反应及副反应如下:
ⅰ. (放热反应)
(放热反应)
ⅱ.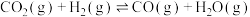 (吸热反应)
(吸热反应)
(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
若CO2与足量H2发生反应转化为1molCO和水蒸气时吸收热量为42kJ,则
______ 。
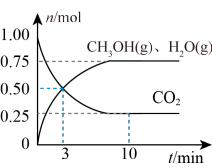
(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:______ 。
②下列措施一定可以提高甲醇生成速率的是______ 。
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是______ 。
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。______ 极,B极的电极反应式为____________ 。
ⅰ.
 (放热反应)
(放热反应)ⅱ.
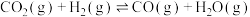 (吸热反应)
(吸热反应)(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
化学键 | H-O | C=O(CO2) | H-H |
|
键能/ | 462.8 | 803.0 | 436.0 | x |

(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
②下列措施一定可以提高甲醇生成速率的是
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

您最近一年使用:0次
4 . 一碳化学是化学反应过程中反应物只含一个碳原子的反应,一碳化学是从一碳氢化反应开始的,甲烷、一氧化碳是常见的一碳化学的原料。已知反应:
i.
ii.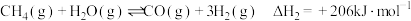
iii.
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解,该反应的热化学方程式为___________ ;反应i的正反应活化能为 ,则逆反应的活化能为
,则逆反应的活化能为___________  。
。
(2)向容积固定为 的密闭容器内充入
的密闭容器内充入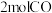 和
和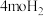 ,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
①从开始到 时,以CO浓度变化表示的平均反应速率
时,以CO浓度变化表示的平均反应速率
___________ 。
②反应达到平衡的时间段是___________ (填“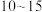 ”或“
”或“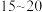 ”)min;该温度下,反应iii的平衡常数
”)min;该温度下,反应iii的平衡常数
___________ 。
③平衡后,下列措施中能使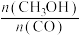 增大的有
增大的有___________ (填字母)。
a.升高温度 b.充入氦气 c.再充入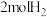 d.使用催化剂
d.使用催化剂
(3)电喷雾电离等方法得到的(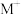
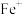 、
、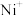 等)与
等)与 反应可得
反应可得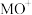 。
。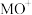 与
与 反应能高选择性地生成
反应能高选择性地生成 ,体系的能量随反应进程的变化如图所示:
,体系的能量随反应进程的变化如图所示: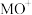 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线___________ (填“a”或“b”)。
②若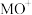 与
与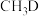 反应,生成的氘代甲醇有
反应,生成的氘代甲醇有___________ 种。
i.

ii.
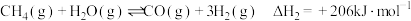
iii.

(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解,该反应的热化学方程式为
 ,则逆反应的活化能为
,则逆反应的活化能为 。
。(2)向容积固定为
 的密闭容器内充入
的密闭容器内充入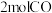 和
和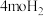 ,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:反应时间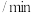 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强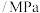 | p |  | 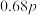 | x | 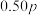 | 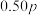 | 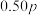 |
 时,以CO浓度变化表示的平均反应速率
时,以CO浓度变化表示的平均反应速率
②反应达到平衡的时间段是
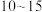 ”或“
”或“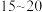 ”)min;该温度下,反应iii的平衡常数
”)min;该温度下,反应iii的平衡常数
③平衡后,下列措施中能使
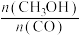 增大的有
增大的有a.升高温度 b.充入氦气 c.再充入
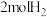 d.使用催化剂
d.使用催化剂(3)电喷雾电离等方法得到的(
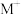
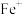 、
、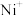 等)与
等)与 反应可得
反应可得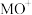 。
。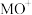 与
与 反应能高选择性地生成
反应能高选择性地生成 ,体系的能量随反应进程的变化如图所示:
,体系的能量随反应进程的变化如图所示: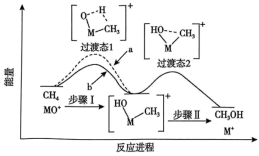
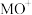 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线②若
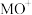 与
与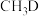 反应,生成的氘代甲醇有
反应,生成的氘代甲醇有
您最近一年使用:0次
5 . 从衣食住行到探索浩瀚宇宙,都有氮及其化合物的参与,但同时有毒含氮化合物的排放,也对环境产生污染。如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。回答下列问题:
(1)在25℃,101 kPa时,利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
ⅰ.
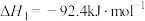
ⅱ.

ⅲ.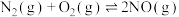

根据信息,写出NO(g)与NH3(g)反应生成N2(g)和H2O(l)的热化学方程式:__________ ;该反应自发进行的条件是__________ (填“高温”或“低温”)。
(2)活性炭还原法是消除氮氧化物污染的有效方法。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L,不同温度下,测得反应2小时NO去除率如图所示:__________ (填“C”“ CaO/C”或“La2O3/C”),该情况下,A点__________ (填“是”或“不是”)平衡点。
②400℃时,CaO/C催化下反应速率v(NO)=__________ mol/(L·h)。
(3)臭氧脱硝存在如下两个反应:
a. ;
;
b. 。
。
T℃时,将2 mol NO2和1 mol O3混合气体充入一个1 L恒容密闭容器中发生上述反应,测得NO2的物质的量浓度随时间变化关系如下表:
若起始压强为p0,T℃下反应达到平衡时,N2O4的分压与N2O5的分压相等,则O3的体积分数=__________ (保留两位有效数字),反应b平衡常数Kp=__________ (用含p0式子表示,Kp为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)工业上还可以利用原电池原理处理氮氧化合物,工作原理如图所示,则正极的电极反应式为__________ 。
(1)在25℃,101 kPa时,利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
ⅰ.

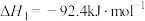
ⅱ.


ⅲ.
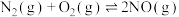

根据信息,写出NO(g)与NH3(g)反应生成N2(g)和H2O(l)的热化学方程式:
(2)活性炭还原法是消除氮氧化物污染的有效方法。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L,不同温度下,测得反应2小时NO去除率如图所示:

②400℃时,CaO/C催化下反应速率v(NO)=
(3)臭氧脱硝存在如下两个反应:
a.
 ;
;b.
 。
。T℃时,将2 mol NO2和1 mol O3混合气体充入一个1 L恒容密闭容器中发生上述反应,测得NO2的物质的量浓度随时间变化关系如下表:
| t/h | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| c(NO2)/(mol/L) | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
(4)工业上还可以利用原电池原理处理氮氧化合物,工作原理如图所示,则正极的电极反应式为
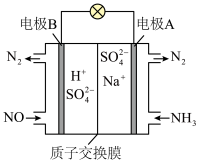
您最近一年使用:0次
名校
解题方法
6 . 2023年杭州亚运会主火炬创新使用了绿色“零碳甲醇”作为燃料,这不仅在亚运史上是第一次,在全球大型体育赛事上也是首次实现了废碳的再生利用。“零碳甲醇”是符合“碳中和”属性的绿色能源。
Ⅰ.直接法制甲醇
我国科研团队研究发现使用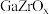 双金属氧化物可形成氧空位,具有催化氧化性能,实现
双金属氧化物可形成氧空位,具有催化氧化性能,实现 加氢制甲醇。该反应机理如图所示。
加氢制甲醇。该反应机理如图所示。
(2)向恒温恒压密闭容器中充入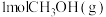 和
和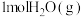 发生上述反应(反应Ⅰ)的逆过程,达到平衡时,
发生上述反应(反应Ⅰ)的逆过程,达到平衡时, 的转化率为
的转化率为 ,用摩尔分数表示反应Ⅰ的平衡常数
,用摩尔分数表示反应Ⅰ的平衡常数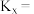
___________ 。(用分数表示,物质i的摩尔分数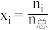 )
)
Ⅱ.间接法制甲醇
 和
和 通过逆水煤气反应,先合成
通过逆水煤气反应,先合成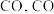 和
和 再合成甲醇。
再合成甲醇。
反应Ⅱ:
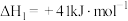
反应Ⅲ:

(3)反应Ⅱ的速率 ,其中
,其中 和
和 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时
___________ (填“增大”“减小”或“不变”)。
(4)在某催化剂下,反应Ⅲ的反应历程如图所示(图中的数据表示的仅为微粒的数目以及各个阶段微粒的相对总能量,*表示吸附在催化剂上)。已知V中有一种吸附在催化剂表面的物质,V可表示为___________ 。 ,向密闭容器中加入
,向密闭容器中加入 和
和 ,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内
,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内 的物质的量为
的物质的量为 为
为 。则
。则 分压的变化量为
分压的变化量为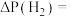
___________  (保留三位有效数字)。
(保留三位有效数字)。
(6)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是___________ ,理由是___________ 。
Ⅰ.直接法制甲醇
我国科研团队研究发现使用
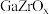 双金属氧化物可形成氧空位,具有催化氧化性能,实现
双金属氧化物可形成氧空位,具有催化氧化性能,实现 加氢制甲醇。该反应机理如图所示。
加氢制甲醇。该反应机理如图所示。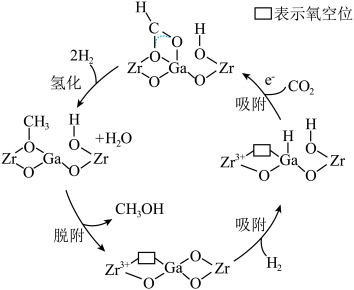
| A.增大催化剂的比表面积有利于提高平衡转化率 |
| B.催化剂表面甲醇及时脱附有利于提高反应速率 |
| C.在恒温恒容密闭容器中,通入惰性气体以增加体系压强,有利于提高甲醇的产率 |
D.若断开 键同时断开 键同时断开 键,则说明反应达到平衡状态 键,则说明反应达到平衡状态 |
(2)向恒温恒压密闭容器中充入
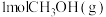 和
和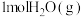 发生上述反应(反应Ⅰ)的逆过程,达到平衡时,
发生上述反应(反应Ⅰ)的逆过程,达到平衡时, 的转化率为
的转化率为 ,用摩尔分数表示反应Ⅰ的平衡常数
,用摩尔分数表示反应Ⅰ的平衡常数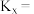
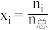 )
)Ⅱ.间接法制甲醇
 和
和 通过逆水煤气反应,先合成
通过逆水煤气反应,先合成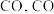 和
和 再合成甲醇。
再合成甲醇。反应Ⅱ:

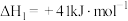
反应Ⅲ:


(3)反应Ⅱ的速率
 ,其中
,其中 和
和 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时
(4)在某催化剂下,反应Ⅲ的反应历程如图所示(图中的数据表示的仅为微粒的数目以及各个阶段微粒的相对总能量,*表示吸附在催化剂上)。已知V中有一种吸附在催化剂表面的物质,V可表示为
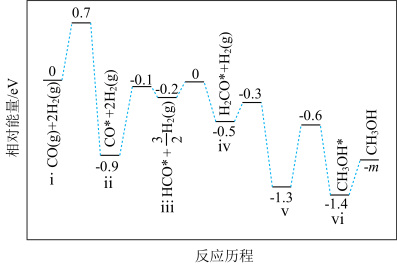
 ,向密闭容器中加入
,向密闭容器中加入 和
和 ,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内
,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内 的物质的量为
的物质的量为 为
为 。则
。则 分压的变化量为
分压的变化量为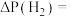
 (保留三位有效数字)。
(保留三位有效数字)。(6)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是
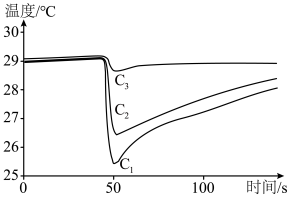
您最近一年使用:0次
7 . 草酸钙一水结晶水合物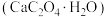 可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
(1)在隔绝空气条件下,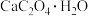 分解反应如下:
分解反应如下:
①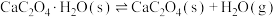
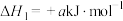 ;
;
②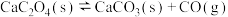
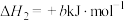 ;
;
③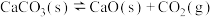
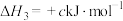 ;
;
④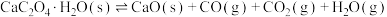

___________  (上述反应式中,a,b,c都大于0)。
(上述反应式中,a,b,c都大于0)。
(2)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生中反应:CaC2O4(s) CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=___________ 。
(3)已知反应②CaC2O4(s) CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g)
CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g) N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=
N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=___________ 。(用e,b,c来表示)
(4)在密闭容器中充入足量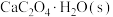 粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:
粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:___________ 。
②温度高于800℃时,曲线斜率减小,可能是产物之间发生了可逆的无机氧化还原反应,写出该反应的化学方程式:___________ 。
(5)在400℃时,向体积可变的密闭容器中充入足量CaC2O4•H2O粉末,只发生(1)中反应①。达到平衡时体积为1L,压强为p0kPa.温度保持不变,将体积变为2L并保持体积不变,直至反应达到平衡,平衡时压强为___________ 。
(6)氧化钙晶胞如图所示,已知: 代表阿伏加德罗常数的值,阳离子半径为100pm。
代表阿伏加德罗常数的值,阳离子半径为100pm。___________ (填字母)。
A.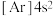 B.
B.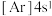 C.
C.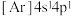 D.
D.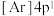
②氧化钙的摩尔体积为___________  。
。
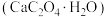 可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:(1)在隔绝空气条件下,
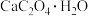 分解反应如下:
分解反应如下:①
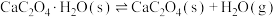
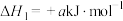 ;
;②
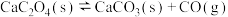
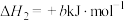 ;
;③
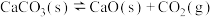
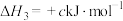 ;
;④
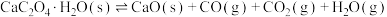

 (上述反应式中,a,b,c都大于0)。
(上述反应式中,a,b,c都大于0)。(2)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生中反应:CaC2O4(s)
 CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=(3)已知反应②CaC2O4(s)
 CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g)
CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g) N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=
N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=(4)在密闭容器中充入足量
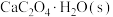 粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:
粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示: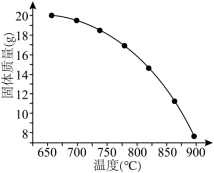
②温度高于800℃时,曲线斜率减小,可能是产物之间发生了可逆的无机氧化还原反应,写出该反应的化学方程式:
(5)在400℃时,向体积可变的密闭容器中充入足量CaC2O4•H2O粉末,只发生(1)中反应①。达到平衡时体积为1L,压强为p0kPa.温度保持不变,将体积变为2L并保持体积不变,直至反应达到平衡,平衡时压强为
(6)氧化钙晶胞如图所示,已知:
 代表阿伏加德罗常数的值,阳离子半径为100pm。
代表阿伏加德罗常数的值,阳离子半径为100pm。
A.
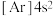 B.
B.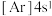 C.
C.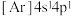 D.
D.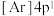
②氧化钙的摩尔体积为
 。
。
您最近一年使用:0次
名校
解题方法
8 . 汽车尾气中含有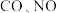 等有害气体。
等有害气体。
(1)汽车尾气中 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图:___________ 。
(2)利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 。
。
①该反应的化学方程式为___________ 。
②某温度下,在 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为___________  ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为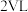 ,则该反应的速率会
,则该反应的速率会___________ (填“增大”“减小”或“不变”)。
③下列可以表明上述可逆反应已达到化学平衡状态的是___________ (填序号)。
a.容器中的气体压强保持不变
b.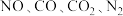 的浓度之比为
的浓度之比为
c. 的浓度不再改变
的浓度不再改变
d.相同时间内,反应消耗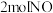 的同时消耗
的同时消耗
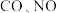 等有害气体。
等有害气体。(1)汽车尾气中
 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图: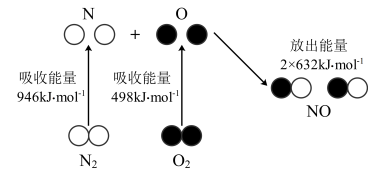
(2)利用催化技术可将汽车尾气中的
 和
和 转化为
转化为 和
和 。
。①该反应的化学方程式为
②某温度下,在
 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:时间/ | 0 | 1 | 2 | 3 | … |
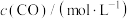 | 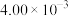 |  |  |  | … |
 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为 ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为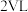 ,则该反应的速率会
,则该反应的速率会③下列可以表明上述可逆反应已达到化学平衡状态的是
a.容器中的气体压强保持不变
b.
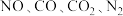 的浓度之比为
的浓度之比为
c.
 的浓度不再改变
的浓度不再改变d.相同时间内,反应消耗
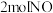 的同时消耗
的同时消耗
您最近一年使用:0次
9 . Ⅰ.某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图1所示。根据图中数据,填写下列空白。

(1)该反应的化学方程式为________________________________________ 。
(2)反应开始至2 min,气体Z的平均反应速率v(Z)=________ 。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________ 倍。
②若此时将容器的体积缩小为原来的 ,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为
,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________ (填“放热”或“吸热”)反应。
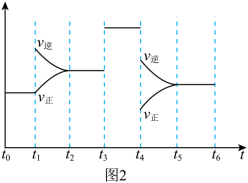
(4)上述反应在t1~t6内反应速率与时间图象如图2所示,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是 (填字母)。
Ⅱ.已知水溶液中c(H+)和c(OH-)的关系如图所示:
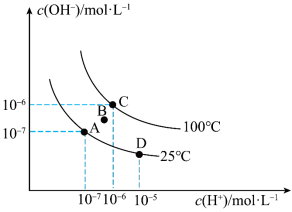
(5)图中B点水的离子积常数___________ 10-12(填“>”、“=”或“<”)。
(6)从A点到D点,可采取的措施是___________ 。
a.升温 b.加入少量盐酸 c.降温 d.加入少量NaOH
(7)100℃时,pH=2的盐酸中水电离产生的H+浓度为___________ mol/L。
(8)25℃时,将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为___________ 。

(1)该反应的化学方程式为
(2)反应开始至2 min,气体Z的平均反应速率v(Z)=
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的
②若此时将容器的体积缩小为原来的
 ,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为
,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为(4)上述反应在t1~t6内反应速率与时间图象如图2所示,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是 (填字母)。

| A.在t1时增大了压强 | B.B.在t3时加入催化剂 |
| C.在t4时降低了温度 | D.t2~t3时X的转化率最高 |
Ⅱ.已知水溶液中c(H+)和c(OH-)的关系如图所示:

(5)图中B点水的离子积常数
(6)从A点到D点,可采取的措施是
a.升温 b.加入少量盐酸 c.降温 d.加入少量NaOH
(7)100℃时,pH=2的盐酸中水电离产生的H+浓度为
(8)25℃时,将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为
您最近一年使用:0次
10 . 甲、乙两个实验小组同学分别用酸性 和
和 (草酸)溶液反应来探究影响反应速率的因素:
(草酸)溶液反应来探究影响反应速率的因素:
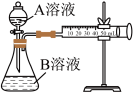
Ⅰ.甲组同学欲通过如图装置探究某种影响化学反应速率的因素,设计实验方案如下( 溶液已酸化):
溶液已酸化):
(1)写出酸性 溶液和
溶液和 (草酸)溶液反应的离子方程式
(草酸)溶液反应的离子方程式__________ 。
(2)相同时间内针筒中所得 的体积大小关系是①
的体积大小关系是①__________ ②(填“>”、“<”或“=”)。
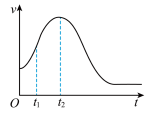
(3)该小组同学发现反应速率总是如下图所示,其中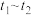 时间内速率变快的主要原因可能是:①产物
时间内速率变快的主要原因可能是:①产物 对该反应有催化作用:②
对该反应有催化作用:②__________ 。
(4)对于反应 ,速率方程
,速率方程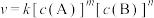 ,k为速率常数(只受温度影响),
,k为速率常数(只受温度影响),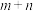 为反应级数。已知
为反应级数。已知
 ,CO的瞬时生成速率
,CO的瞬时生成速率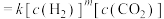 。一定温度下,控制
。一定温度下,控制 起始浓度为
起始浓度为 ,改变
,改变 的起始浓度,进行上述反应,得到CO的瞬时生成速率和
的起始浓度,进行上述反应,得到CO的瞬时生成速率和 起始浓度呈如图所示的直线关系。
起始浓度呈如图所示的直线关系。

①该反应的反应级数为__________ 。
②速率常数
__________ 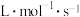 。
。
③当 的起始浓度为
的起始浓度为 ,反应进行到某一时刻时,测得
,反应进行到某一时刻时,测得 的浓度为
的浓度为 ,此时CO的瞬时生成速率
,此时CO的瞬时生成速率
__________  。
。
④该反应的反应速率(v)随时间(t)的变化关系如图所示,若 、
、 时刻只改变一个条件,下列说法错误的是
时刻只改变一个条件,下列说法错误的是__________ (填标号)。
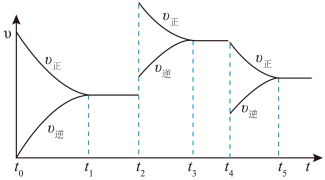
a.在 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度
b.在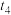 时,采取的措施可以是增大
时,采取的措施可以是增大 的浓度
的浓度
c.在 时,容器内
时,容器内 的转化率是整个过程中的最大值
的转化率是整个过程中的最大值
 和
和 (草酸)溶液反应来探究影响反应速率的因素:
(草酸)溶液反应来探究影响反应速率的因素:Ⅰ.甲组同学欲通过如图装置探究某种影响化学反应速率的因素,设计实验方案如下(
 溶液已酸化):
溶液已酸化):
实验序号 | A溶液 | B溶液 |
① |
|
|
② |
|
|
(1)写出酸性
 溶液和
溶液和 (草酸)溶液反应的离子方程式
(草酸)溶液反应的离子方程式(2)相同时间内针筒中所得
 的体积大小关系是①
的体积大小关系是①(3)该小组同学发现反应速率总是如下图所示,其中
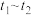 时间内速率变快的主要原因可能是:①产物
时间内速率变快的主要原因可能是:①产物 对该反应有催化作用:②
对该反应有催化作用:②
(4)对于反应
 ,速率方程
,速率方程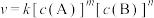 ,k为速率常数(只受温度影响),
,k为速率常数(只受温度影响),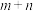 为反应级数。已知
为反应级数。已知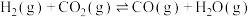
 ,CO的瞬时生成速率
,CO的瞬时生成速率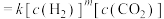 。一定温度下,控制
。一定温度下,控制 起始浓度为
起始浓度为 ,改变
,改变 的起始浓度,进行上述反应,得到CO的瞬时生成速率和
的起始浓度,进行上述反应,得到CO的瞬时生成速率和 起始浓度呈如图所示的直线关系。
起始浓度呈如图所示的直线关系。
①该反应的反应级数为
②速率常数

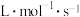 。
。③当
 的起始浓度为
的起始浓度为 ,反应进行到某一时刻时,测得
,反应进行到某一时刻时,测得 的浓度为
的浓度为 ,此时CO的瞬时生成速率
,此时CO的瞬时生成速率
 。
。④该反应的反应速率(v)随时间(t)的变化关系如图所示,若
 、
、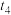 时刻只改变一个条件,下列说法错误的是
时刻只改变一个条件,下列说法错误的是
a.在
 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度b.在
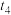 时,采取的措施可以是增大
时,采取的措施可以是增大 的浓度
的浓度c.在
 时,容器内
时,容器内 的转化率是整个过程中的最大值
的转化率是整个过程中的最大值
您最近一年使用:0次