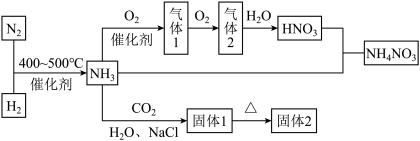
1 . 工业合成氨是人类科学技术的一项重大突破,我国目前氨的生产能力位居世界首位。其合成原理为:
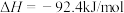
 。
。
(1)合成氨及其衍生工业是化工生产的重要门类,某工厂用下图流程合成氨及其含氮产物:
上流程中气体2为___________ ,在饱和 溶液中先通入过量
溶液中先通入过量 再通入过量
再通入过量 可得到固体
可得到固体___________ ;
(2)合成氨反应在常温下___________ (填“能”或“不能”)自发;
(3)在恒温恒容密闭容器中充入
 和
和
 进行合成氨的反应,下列能说明该反应已达平衡状态的是
进行合成氨的反应,下列能说明该反应已达平衡状态的是___________ ;
a.断裂
 同时生成
同时生成

b.容器内压强保持不变
c.混合气体密度保持不变
d。容器内 、
、 、
、 物质的量之比为1:3:2
物质的量之比为1:3:2
e. 的百分含量保持不变
的百分含量保持不变
(4)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位, 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 )。
)。
(ⅰ)
(ⅱ)
(ⅲ)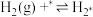
(ⅳ)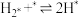
(ⅴ)
……
(…)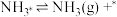
判断上述反应机理中,速率控制步骤(即速率最慢步骤)为___________ (填步骤前的标号),理由是___________ 。
(5)基于 载氮体的碳基化学链合成氨技术示反应如下:
载氮体的碳基化学链合成氨技术示反应如下:
吸氮反应:
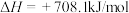
释氮反应:
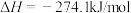
在温度为T、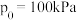 恒压条件下进行吸氮反应,平衡时氮气转化率为50%,分压平衡常数
恒压条件下进行吸氮反应,平衡时氮气转化率为50%,分压平衡常数
___________  。
。

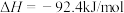
 。
。(1)合成氨及其衍生工业是化工生产的重要门类,某工厂用下图流程合成氨及其含氮产物:

上流程中气体2为
 溶液中先通入过量
溶液中先通入过量 再通入过量
再通入过量 可得到固体
可得到固体(2)合成氨反应在常温下
(3)在恒温恒容密闭容器中充入

 和
和
 进行合成氨的反应,下列能说明该反应已达平衡状态的是
进行合成氨的反应,下列能说明该反应已达平衡状态的是a.断裂

 同时生成
同时生成

b.容器内压强保持不变
c.混合气体密度保持不变
d。容器内
 、
、 、
、 物质的量之比为1:3:2
物质的量之比为1:3:2e.
 的百分含量保持不变
的百分含量保持不变(4)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位,
 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 )。
)。(ⅰ)

(ⅱ)

(ⅲ)
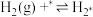
(ⅳ)
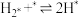
(ⅴ)

……
(…)
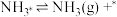
判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
(5)基于
 载氮体的碳基化学链合成氨技术示反应如下:
载氮体的碳基化学链合成氨技术示反应如下:吸氮反应:

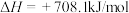
释氮反应:

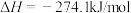
在温度为T、
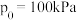 恒压条件下进行吸氮反应,平衡时氮气转化率为50%,分压平衡常数
恒压条件下进行吸氮反应,平衡时氮气转化率为50%,分压平衡常数
 。
。
您最近一年使用:0次
2 . Ⅰ.中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果由国际知名学术期刊《科学》在线发表。 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” 、
、 ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为: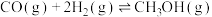
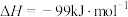
(1)若要该反应自发进行,_____ (填“高温”或“低温”)更有利。
(2)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_____ (填字母序号)。
A.反应物的物质的量的比值不变
B.混合气体的密度不再变化
C. 的百分含量不再变化
的百分含量不再变化
D.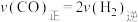
E.混合气体的平均相对分子质量不再变化
(3)把 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:
①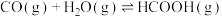
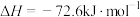
②

③
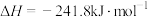
则 与
与 合成
合成 反应的热化学方程式:
反应的热化学方程式:_____
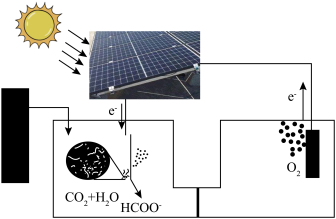
(4)受绿色植物光合作用的启示,太阳能固碳装置被设计出来,则固碳电极反应为_____ 。
Ⅱ.我国学者结合实验与计算机模拟结果,研究了 的反应历程。在催化剂作用下,此反应为
的反应历程。在催化剂作用下,此反应为  l可有效降低汽车尾气污染物排放。
l可有效降低汽车尾气污染物排放。
(5)探究温度、压强(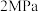 ,
,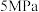 )对反应
)对反应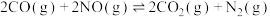 的影响,如图所示,表示
的影响,如图所示,表示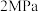 的是
的是_____ (填标号)。
(6)一定温度下,向一容积为1L的恒容密闭容器按体积3∶2比例充入CO和NO,压强为5MPa发生上述反应,当反应达到平衡时容器内压强变为起始时的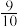 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数 =
=_____ ( 为压强平衡常数)。
为压强平衡常数)。
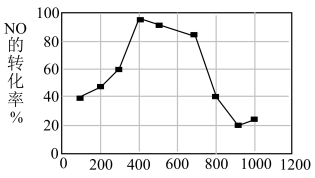
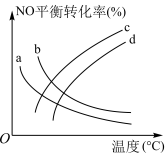
(7)若在相同时间内测得NO的转化率随温度的变化曲线如图,解释NO的转化率随温度的升高由上升到下降、下降由缓到急的主要原因是_____ 。
 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” 、
、 ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为: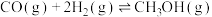
(1)若要该反应自发进行,
(2)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是
A.反应物的物质的量的比值不变
B.混合气体的密度不再变化
C.
 的百分含量不再变化
的百分含量不再变化D.
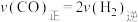
E.混合气体的平均相对分子质量不再变化
(3)把
 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:①
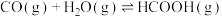
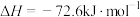
②


③

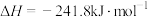
则
 与
与 合成
合成 反应的热化学方程式:
反应的热化学方程式:(4)受绿色植物光合作用的启示,太阳能固碳装置被设计出来,则固碳电极反应为

Ⅱ.我国学者结合实验与计算机模拟结果,研究了
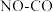 的反应历程。在催化剂作用下,此反应为
的反应历程。在催化剂作用下,此反应为  l可有效降低汽车尾气污染物排放。
l可有效降低汽车尾气污染物排放。(5)探究温度、压强(
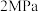 ,
,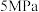 )对反应
)对反应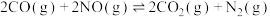 的影响,如图所示,表示
的影响,如图所示,表示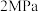 的是
的是
(6)一定温度下,向一容积为1L的恒容密闭容器按体积3∶2比例充入CO和NO,压强为5MPa发生上述反应,当反应达到平衡时容器内压强变为起始时的
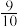 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数 =
= 为压强平衡常数)。
为压强平衡常数)。
(7)若在相同时间内测得NO的转化率随温度的变化曲线如图,解释NO的转化率随温度的升高由上升到下降、下降由缓到急的主要原因是
您最近一年使用:0次
名校
3 . I.甲醇是重要的化工原料,利用合成气(主要成分为 、
、 和
和 )在催化剂作用下合成甲醇,相关反应的热化学方程式为:
)在催化剂作用下合成甲醇,相关反应的热化学方程式为:
①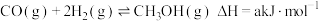 ;
;
②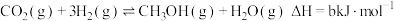 ;
;
③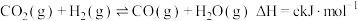 。
。
回答下列问题:
(1)
___________ (用b、c表示),已知反应②在一定条件下可自发进行,则
___________ (填“>”“<”或“=”)0。
(2)在一定温度下,向体积为 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 与
与 ,在催化剂的作用下仅发生反应③。①下列叙述能表示该反应达到平衡状态的是
,在催化剂的作用下仅发生反应③。①下列叙述能表示该反应达到平衡状态的是___________ (填标号)。
a.容器中混合气体的压强不再改变 b.容器中 、
、 的体积比值不变
的体积比值不变
c.容器中气体的密度不再改变 d.相同时间内,断裂 的数目是断裂
的数目是断裂 的2倍
的2倍
②该反应达到平衡时,其他条件不变,通入 时,则
时,则 (正)
(正)___________ (填“>”“<”或“=”)V(逆),平衡常数___________ (填“变大”“变小”或“不变”)。
Ⅱ.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运。氮热分解法制氢气:相关化学键的键能数据如下:
一定温度下,利用催化剂将 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:
(3)反应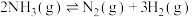

___________  ;
;
(4)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将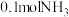 通入
通入 的密闭容器中进行反应(此时容器内总压为
的密闭容器中进行反应(此时容器内总压为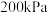 ),各物质的分压随时间的变化曲线如图所示。
),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变, 时反应达到平衡,用
时反应达到平衡,用 的浓度变化表示
的浓度变化表示 时间内的反应速率
时间内的反应速率
___________  (用含
(用含 的代数式表示)
的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是___________ (用图中a、b、c、d表示)。
 、
、 和
和 )在催化剂作用下合成甲醇,相关反应的热化学方程式为:
)在催化剂作用下合成甲醇,相关反应的热化学方程式为:①
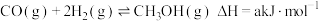 ;
;②
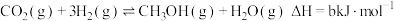 ;
;③
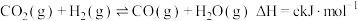 。
。回答下列问题:
(1)


(2)在一定温度下,向体积为
 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 与
与 ,在催化剂的作用下仅发生反应③。①下列叙述能表示该反应达到平衡状态的是
,在催化剂的作用下仅发生反应③。①下列叙述能表示该反应达到平衡状态的是a.容器中混合气体的压强不再改变 b.容器中
 、
、 的体积比值不变
的体积比值不变c.容器中气体的密度不再改变 d.相同时间内,断裂
 的数目是断裂
的数目是断裂 的2倍
的2倍②该反应达到平衡时,其他条件不变,通入
 时,则
时,则 (正)
(正)Ⅱ.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运。氮热分解法制氢气:相关化学键的键能数据如下:
| 化学键 |  |  |  |
键能 | 946 | 436.0 | 390.8 |
 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:(3)反应
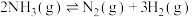

 ;
;(4)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将
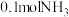 通入
通入 的密闭容器中进行反应(此时容器内总压为
的密闭容器中进行反应(此时容器内总压为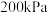 ),各物质的分压随时间的变化曲线如图所示。
),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,
 时反应达到平衡,用
时反应达到平衡,用 的浓度变化表示
的浓度变化表示 时间内的反应速率
时间内的反应速率
 (用含
(用含 的代数式表示)
的代数式表示)②
 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是
您最近一年使用:0次
2023·江苏扬州·三模
名校
4 . 含氮物质可发生如下反应:①
②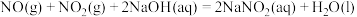
③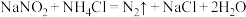
下列说法正确的是

②
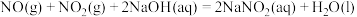
③
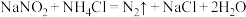
下列说法正确的是
A.常温下,NO与 混合能立即看到红棕色气体,说明该反应已达平衡 混合能立即看到红棕色气体,说明该反应已达平衡 |
B.反应②的 |
C.反应③消耗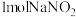 ,理论上会生成标准状况下约 ,理论上会生成标准状况下约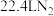 |
D.利用反应①、②、③可以同时处理 含量较高的废气和含 含量较高的废气和含 的废水 的废水 |
您最近一年使用:0次
2023-06-02更新
|
1271次组卷
|
8卷引用:选择题1-5
(已下线)选择题1-5江苏省扬州市2023届高三下学期三模化学试题考点巩固卷08 化学反应速率与化学平衡(3大考点45题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)第13讲氮及其化合物江苏省南通市如皋市2024届高三上学期期初考试押题卷化学试题(已下线)第28讲化化学平衡的移动及反应进行的方向(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江苏省清江中学、南通部分学校2023-2024学年高二下学期第一次调研(3月)化学试卷
5 . 汽车尾气中含有CO和NO等,可以用不同的方法净化处理,防止空气污染。回答下列问题:
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。
①该反应在常温下能自发进行,则该反应的△H_______ 0(填“>”或“<”)。
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:
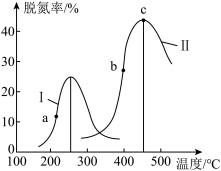
a点的v逆_______ b点的v正(填“>”“<”或“=”')。c点_______ (填“一定”或“不一定”)是平衡状态。
③对于反应2CO(g)+2NO(g) 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=_______ 。
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是_______ (填标号)。
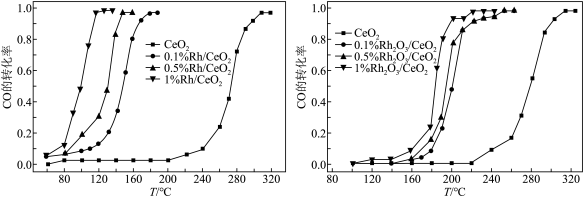
A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是__________ ,为了避免尿素过多造成的影响,可接一个氧化催化器,则氧化催化器中反应的化学方程式为_______ 。
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。①该反应在常温下能自发进行,则该反应的△H
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:

a点的v逆
③对于反应2CO(g)+2NO(g)
 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是

A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g)
 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
您最近一年使用:0次
名校
解题方法
6 . 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g) +H2O(g)。下图表示该反应进行过程中能量的变化。关于该反应的下列说法中正确的是


| A.ΔH>0, ΔS>0 | B.ΔH>0,ΔS<0 |
| C.ΔH<0, ΔS<0 | D.ΔH<0,ΔS>0 |
您最近一年使用:0次
2022-08-18更新
|
350次组卷
|
22卷引用:湖北省咸宁市通城二中2020-2021学年高二上学期10月月考化学试题
湖北省咸宁市通城二中2020-2021学年高二上学期10月月考化学试题湖北省恩施州高中教育联盟2020-2021学年高一下学期期末考试化学试题安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题河南省长垣市第十中学2020-2021学年高二上学期第二次月考化学试题内蒙古集宁新世纪中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题河北省石家庄市第一中学2021-2022学年高二上学期开学考试化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)山东省烟台市招远市第二中学2021-2022学年高二10月月考化学试题安徽省蚌埠第三中学2021-2022学年高二上学期10月教学质量检测化学试题辽宁省朝阳育英高考补习学校2021-2022学年高二10月月考化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题河南省范县第一中学2021-2022学年高二上学期第二次月考检测化学试题贵州省凯里市第一中学2021-2022学年高二上学期期中考试化学(理科)试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)贵州省毕节市金沙县第一中学2021-2022学年高二上学期期中考试化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题(已下线)第20讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市第三高级中学2022-2023学年高二上学期第一次月考化学试题福建泉州现代中学2021-2022学年高二上学期期中考试化学试题
2022·湖南·高考真题
7 . 钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
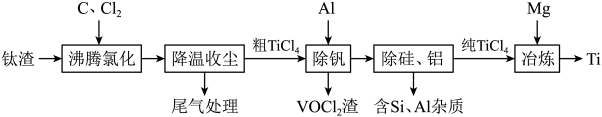
已知“降温收尘”后,粗 中含有的几种物质的沸点:
中含有的几种物质的沸点:
回答下列问题:
(1)已知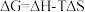 ,
, 的值只决定于反应体系的始态和终态,忽略
的值只决定于反应体系的始态和终态,忽略 、
、 随温度的变化。若
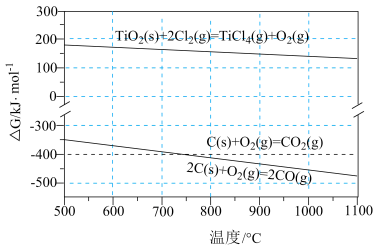
随温度的变化。若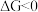 ,则该反应可以自发进行。根据下图判断:
,则该反应可以自发进行。根据下图判断: 时,下列反应不能自发进行的是_______。
时,下列反应不能自发进行的是_______。
(2) 与C、
与C、 ,在
,在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
①该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为_______ ;
②随着温度升高,尾气中 的含量升高,原因是
的含量升高,原因是_______ 。
(3)“除钒”过程中的化学方程式为_______ ;“除硅、铝”过程中,分离 中含
中含 、
、 杂质的方法是
杂质的方法是_______ 。
(4)“除钒”和“除硅、铝”的顺序_______ (填“能”或“不能”)交换,理由是_______ 。
(5)下列金属冶炼方法与本工艺流程中加入 冶炼
冶炼 的方法相似的是_______。
的方法相似的是_______。
 ,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗
 中含有的几种物质的沸点:
中含有的几种物质的沸点:| 物质 |  |  |  |  |
沸点/ | 136 | 127 | 57 | 180 |
(1)已知
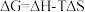 ,
, 的值只决定于反应体系的始态和终态,忽略
的值只决定于反应体系的始态和终态,忽略 、
、 随温度的变化。若
随温度的变化。若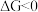 ,则该反应可以自发进行。根据下图判断:
,则该反应可以自发进行。根据下图判断: 时,下列反应不能自发进行的是_______。
时,下列反应不能自发进行的是_______。
A. | B. |
C. | D. |
 与C、
与C、 ,在
,在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
的沸腾炉中充分反应后,混合气体中各组分的分压如下表:| 物质 |  |  |  |  |
分压 | 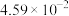 | 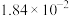 |  |  |
 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为②随着温度升高,尾气中
 的含量升高,原因是
的含量升高,原因是(3)“除钒”过程中的化学方程式为
 中含
中含 、
、 杂质的方法是
杂质的方法是(4)“除钒”和“除硅、铝”的顺序
(5)下列金属冶炼方法与本工艺流程中加入
 冶炼
冶炼 的方法相似的是_______。
的方法相似的是_______。| A.高炉炼铁 | B.电解熔融氯化钠制钠 | C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
2022-06-10更新
|
11211次组卷
|
19卷引用:2022年湖北省高考真题变式题16-19
(已下线)2022年湖北省高考真题变式题16-192022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)考点24 化学反应的方向-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年海南省高考真题变式题15-19(已下线)易错点08 金属材料-备战2023年高考化学考试易错题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 大题突破3 无机化工流程题题型研究(已下线)题型38 基于金属元素的工艺流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)云南省开远市第一中学校2022-2023学年高二下学期5月月考化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)福建省厦门第一中学2023-2024学年高二上学期期中考试化学试题河南省周口恒大中学2023-2024学年高二上学期12月月考化学试题
8 . 氮气是空气的重要组成气体,氮气的综合利用在农业和国防中有着重要意义。
(1)合成氨从实验室研究到实现工业生产,大约经历了150 年。
①写出工业合成氨的化学方程式___________
②已知该反应的ΔH= -92.4 kJ/mol, ΔS (T =298K) =- 198.76 J·mol -1·K-1,试判断室温(即298K) 下,合成氨的反应能否自发进行?___________ (填“能”或“否”)
(2) NH3和CO2在120 °C,催化剂作用下可以合成尿素。
①写出该反应的化学方程式___________
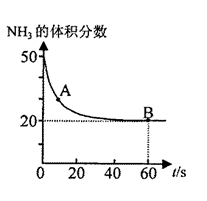
②混合气体中NH3 的含量变化关系如图所示(该条件下尿素为固体)。则A点的正反应速率v正 (CO2)___________ B点的逆反应速率为v逆(CO2) (填“大于”、“小于”或“等于”),NH3的平衡转化率为___________
(3) NH3可用工业上生产硝酸,其尾气中的NO2可用氨水吸收生成NH4NO3.25 °C时,将a mol NH4NO3溶于水,溶液显酸性,其原因是___________ (用离子方程式表示)向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将___________ (填 “正向”、“不”或“逆向”移动,所滴加氨水的浓度为___________ mol·L-1(25 °C时,NH3·H2O 的电离平衡常数取Kb= 2 ×10-5 mol·L-1)
(1)合成氨从实验室研究到实现工业生产,大约经历了150 年。
①写出工业合成氨的化学方程式
②已知该反应的ΔH= -92.4 kJ/mol, ΔS (T =298K) =- 198.76 J·mol -1·K-1,试判断室温(即298K) 下,合成氨的反应能否自发进行?
(2) NH3和CO2在120 °C,催化剂作用下可以合成尿素。
①写出该反应的化学方程式
②混合气体中NH3 的含量变化关系如图所示(该条件下尿素为固体)。则A点的正反应速率v正 (CO2)

(3) NH3可用工业上生产硝酸,其尾气中的NO2可用氨水吸收生成NH4NO3.25 °C时,将a mol NH4NO3溶于水,溶液显酸性,其原因是
您最近一年使用:0次
9 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I:氨热分解法制氢气
相关化学键的键能数据
一定温度下,利用催化剂将 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:
(1)反应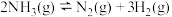

_______  ;
;
(2)已知该反应的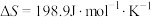 ,在下列哪些温度下反应能自发进行?
,在下列哪些温度下反应能自发进行?_______ (填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将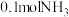 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
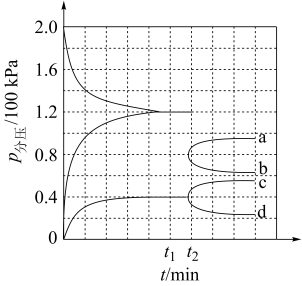
①若保持容器体积不变, 时反应达到平衡,用
时反应达到平衡,用 的浓度变化表示
的浓度变化表示 时间内的反应速率
时间内的反应速率
_______  (用含
(用含 的代数式表示)
的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是_______ (用图中a、b、c、d表示),理由是_______ ;
③在该温度下,反应的标准平衡常数
_______ 。(已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中 ,
,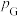 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。
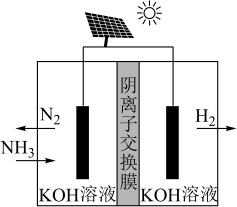
(4)电解过程中 的移动方向为
的移动方向为_______ (填“从左往右”或“从右往左”);
(5)阳极的电极反应式为_______ 。
方法I:氨热分解法制氢气
相关化学键的键能数据
| 化学键 |  |  |  |
键能 | 946 | 436.0 | 390.8 |
 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:(1)反应
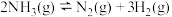

 ;
;(2)已知该反应的
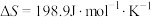 ,在下列哪些温度下反应能自发进行?
,在下列哪些温度下反应能自发进行?A.25℃ B.125℃ C.225℃ D.325℃
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将
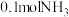 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,
 时反应达到平衡,用
时反应达到平衡,用 的浓度变化表示
的浓度变化表示 时间内的反应速率
时间内的反应速率
 (用含
(用含 的代数式表示)
的代数式表示)②
 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是③在该温度下,反应的标准平衡常数

 ,
, ,其中
,其中 ,
,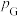 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。方法Ⅱ:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。

(4)电解过程中
 的移动方向为
的移动方向为(5)阳极的电极反应式为
您最近一年使用:0次
2021-06-09更新
|
10644次组卷
|
14卷引用:湖北省鄂西南三校2023-2024学年高二下学期3月联考化学试题
湖北省鄂西南三校2023-2024学年高二下学期3月联考化学试题2021年新高考湖南化学高考真题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)2021年湖南省高考化学试卷变式题11-19(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2022届高三下学期5月月考化学试题(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)
名校
解题方法
10 . 锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。
(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______ (填标号)。
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00ml。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
(5)用氢气还原GeO2可制得金属锗。其反应如下:
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________ ℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
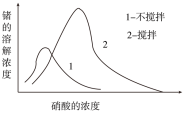
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________ 加剧所致。
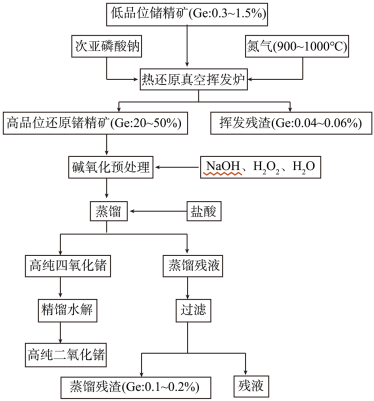
(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00ml。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是
②此样品中二氧化锗含量是
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时
您最近一年使用:0次
2018-03-29更新
|
903次组卷
|
2卷引用:湖北省八校(鄂南高中、华师一附中、黄冈中学、黄石二中、荆州中学、孝感高中、襄阳四中、襄阳五中)2018届高三第二次联考理综化学试题



