1 . 臭氧能氧化 ,故常被用来治理电镀工业中的含氰废水,其化学反应原理为:
,故常被用来治理电镀工业中的含氰废水,其化学反应原理为: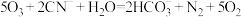 。下列说法错误的是
。下列说法错误的是
 ,故常被用来治理电镀工业中的含氰废水,其化学反应原理为:
,故常被用来治理电镀工业中的含氰废水,其化学反应原理为: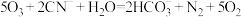 。下列说法错误的是
。下列说法错误的是A. 和 和 是同素异形体 是同素异形体 |
| B.该反应是熵增的过程 |
C.该反应中 为氧化产物 为氧化产物 |
| D.反应中所涉及的三种气体分子均为非极性分子 |
您最近一年使用:0次
2023-03-09更新
|
331次组卷
|
2卷引用:湖北省八市2023届高三3月联考化学试题
名校
2 . 绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措。回答下列问题:
(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下:
I.C3H8O3(g) 3CO(g)+4H2(g) ΔH1=+251kJ·mol-1
3CO(g)+4H2(g) ΔH1=+251kJ·mol-1
II.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41kJ·mol-1
CO2(g)+H2(g) ΔH2=-41kJ·mol-1
①反应I能够自发进行的条件是____ (填“高温”、“低温”或“任何温度”)。
②重整总反应C3H8O3(g)+3H2O(g) 3CO2(g)+7H2(g)的ΔH3=
3CO2(g)+7H2(g)的ΔH3=____ 。
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2 2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。
2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。
①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由大到小的关系为____ 。
②甲烷逐步脱氢过程中活化能最大的反应步骤是:____ (用化学方程式表示)。
③Sn12Ni双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:____ 。
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2 2CO+2H2,同时发生副反应b:CO2+H2
2CO+2H2,同时发生副反应b:CO2+H2 CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=____ (用含P和P0的计算式表示,已知分压=总压×物质的量分数)。
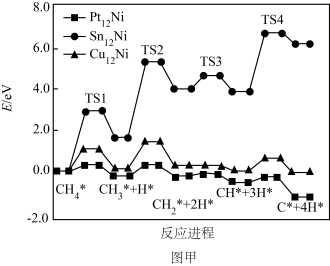
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂。CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为____ ;650℃条件下,1000s后,氢气的体积分数快速下降的原因是____ 。
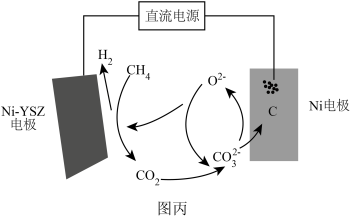
(5)我国科技工作者发明了一种电化学分解甲烷的直流电源方法,从而实现了碳和水的零排放方式生产氢气,电化学反应机理如图丙所示。阳极的电极反应式为____ 。
(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下:
I.C3H8O3(g)
 3CO(g)+4H2(g) ΔH1=+251kJ·mol-1
3CO(g)+4H2(g) ΔH1=+251kJ·mol-1II.CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41kJ·mol-1
CO2(g)+H2(g) ΔH2=-41kJ·mol-1①反应I能够自发进行的条件是
②重整总反应C3H8O3(g)+3H2O(g)
 3CO2(g)+7H2(g)的ΔH3=
3CO2(g)+7H2(g)的ΔH3=(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2
 2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。
2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由大到小的关系为
②甲烷逐步脱氢过程中活化能最大的反应步骤是:
③Sn12Ni双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:

(3)甲烷干法重整制H2的过程为反应a:CH4+CO2
 2CO+2H2,同时发生副反应b:CO2+H2
2CO+2H2,同时发生副反应b:CO2+H2 CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂。CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为

(5)我国科技工作者发明了一种电化学分解甲烷的直流电源方法,从而实现了碳和水的零排放方式生产氢气,电化学反应机理如图丙所示。阳极的电极反应式为

您最近一年使用:0次
2022-05-24更新
|
414次组卷
|
3卷引用:湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题
解题方法
3 . 我国科学家在(自然-通讯》发表了低温高效催化丁烷脱氢制丁烯的研究成果。该过程易发生积炭和裂化等副反应,催化反应历程如图a所示[注:0.06ev表示1个C4H8(g)+1个H2(g)的能量)]

(1)三种催化剂催化效果最好的是____ (填“A”、“B”或“C”),以C为催化剂时决速反应的方程式为____ 。
(2)该反应在____ 条件下能自发进行(填“高温”、“低温”或“任意温度”)。
(3)已知反应活化能Ea(看作不受温度影响),反应温度T和速率常数k之间的关系符合公式:ln k=-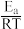 +C,下列ln k~
+C,下列ln k~ 图象与上述三种催化剂关系对应正确的是
图象与上述三种催化剂关系对应正确的是____ 。

(4)在一恒容密闭容器中通入1 mol丁烷和适量的催化剂,发生催化脱氢反应,欲提高丁烯的平衡产率,应采取的措施是___ (填标号)。
A.升高温度 B.通入Ar以增大压强 C.加入少量H2
若起始投料量不变,经过相同时间,测得不同温度下丁烷转化率和丁烯产率如图b所示。温度高于T1时,丁烯产率降低的原因可能是___ (写一条即可),温度高于T2时丁烷转化率增大的原因可能是____ (写一条即可)。


(1)三种催化剂催化效果最好的是
(2)该反应在
(3)已知反应活化能Ea(看作不受温度影响),反应温度T和速率常数k之间的关系符合公式:ln k=-
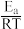 +C,下列ln k~
+C,下列ln k~ 图象与上述三种催化剂关系对应正确的是
图象与上述三种催化剂关系对应正确的是
(4)在一恒容密闭容器中通入1 mol丁烷和适量的催化剂,发生催化脱氢反应,欲提高丁烯的平衡产率,应采取的措施是
A.升高温度 B.通入Ar以增大压强 C.加入少量H2
若起始投料量不变,经过相同时间,测得不同温度下丁烷转化率和丁烯产率如图b所示。温度高于T1时,丁烯产率降低的原因可能是

您最近一年使用:0次
名校
4 . 利用CO2催化加氢可制乙烯,反应为2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) △H,在两个容积均为1L恒容密闭容器中,分别加入2molCO2、4molH2,分别选用两种催化剂,反应进行相同时间,测得CO2转化率随反应温度的变化如下图所示。下列说法正确的是
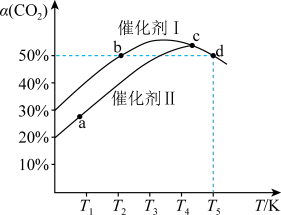

| A.使用催化剂I时反应的活化能低于催化剂II |
| B.△H>0 |
| C.b、d两状态下,化学反应速率相等 |
| D.d状态下,保持其他条件不变,向容器中再加入1molCO2与0.5molC2H4,v(正)<v(逆) |
您最近一年使用:0次
2022-03-30更新
|
1508次组卷
|
12卷引用:湖北省襄阳市第五中学2022届高三下学期适应性考试(二模)化学试题
湖北省襄阳市第五中学2022届高三下学期适应性考试(二模)化学试题(已下线)卷06 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)江苏省徐州市新沂市第一中学2021-2022学年高三下学期3月月考化学试题(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)河南省南阳市2022-2023学年高三上学期期中质量评估化学试题学科特色4 化学反应速率、平衡图像(已下线)题型23 平衡常数、平衡转化率图象河南省南阳市2022-2023学年高三上学期11月期中考试化学试题(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省宜春市宜丰中学2023-2024学年高二上学期9月月考化学试题河北省保定市六校联考2023-2024学年高二上学期11月期中考试化学试题(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建
名校
5 . 二甲醚是一种重要的化工原料,回答下列问题:
(1)已知:①C(s)+ O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;
O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;
②C(s)+ H2O(g)=CO(g) +H2(g) ∆H2 =130 kJ/mol;
③CO(g)+ 2H2(g)=CH3OH(g) ∆H3=- 90.1 kJ/mol;
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4= -134 kJ/mol。
则CH3OCH3(g)+ O2 (g)=2CO(g)+3H2(g) ∆H=
O2 (g)=2CO(g)+3H2(g) ∆H=______ kJ/mol;该反应能够自发进行所采用的有利条件是______ (填“高温”“低温”或“任意温度”)。
(2)在恒温恒压条件下,化工生产上利用二甲醚与氧气为原料制备合成气,实际生产过程中常常添加一定量的水蒸气,其目的是______ ;研究发现,所得平衡混合气体中H2的体积分数随n(O2)/n(CH3OCH3)变化如图所示,试解释该曲线先变大后减小的原因______ 。
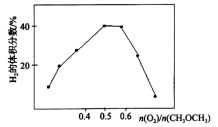
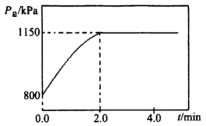
(3)某温度下,在VL的刚性容器中充入4.0molCH3OCH3、2.0molO2及2.0molH2O(g),在催化剂作用下仅发生反应CH3OCH3(g)+ O2(g)
O2(g) 2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)=
2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)=______ mol·min-1;该温度下其分压平衡常数Kp=______ (kPa)3.5(已知 =12.2)。
=12.2)。
(4)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如图所示,则负极的电极反应式为______ ,若消耗标准状况下5.6LO2,则理论上左右两室溶液质量变化的差为______ g。

(1)已知:①C(s)+
 O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;
O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;②C(s)+ H2O(g)=CO(g) +H2(g) ∆H2 =130 kJ/mol;
③CO(g)+ 2H2(g)=CH3OH(g) ∆H3=- 90.1 kJ/mol;
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4= -134 kJ/mol。
则CH3OCH3(g)+
 O2 (g)=2CO(g)+3H2(g) ∆H=
O2 (g)=2CO(g)+3H2(g) ∆H=(2)在恒温恒压条件下,化工生产上利用二甲醚与氧气为原料制备合成气,实际生产过程中常常添加一定量的水蒸气,其目的是

(3)某温度下,在VL的刚性容器中充入4.0molCH3OCH3、2.0molO2及2.0molH2O(g),在催化剂作用下仅发生反应CH3OCH3(g)+
 O2(g)
O2(g) 2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)=
2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)= =12.2)。
=12.2)。
(4)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如图所示,则负极的电极反应式为

您最近一年使用:0次
2021-04-04更新
|
648次组卷
|
5卷引用:湖北师大附中2021届高三下学期教学质量测评化学试题
6 . 下列说法不正确的是
A. 稀 稀 与 与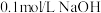 溶液混合时,其活化能接近于零,反应速率快,且该反应为放热反应 溶液混合时,其活化能接近于零,反应速率快,且该反应为放热反应 |
B.反应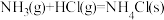 在低温下能自发进行,说明该反应的 在低温下能自发进行,说明该反应的 |
C.已知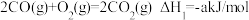 , ,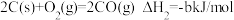 ,则 ,则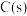 燃烧热的热化学方程式为 燃烧热的热化学方程式为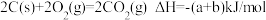 |
D.已知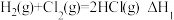 , ,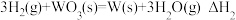 ,则 ,则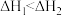 |
您最近一年使用:0次
7 . 合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)⇌2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
下列说法正确的是( )
| 实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
| CH4 | CO2 | CO | |||
| 甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
| 乙 | 300 | V2 | x | x | 0.05 |
| 丙 | 350 | V1 | y | y | 0.12 |
| A.该反应在低温条件下不能自发进行 |
| B.300 ℃时反应的平衡常数为25 |
| C.V1∶V2=3∶7 |
| D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7 |
您最近一年使用:0次
2020-05-14更新
|
492次组卷
|
4卷引用:湖北省2020年荆、荆、襄、宜四地七校考试联盟高一联考化学模拟试题
湖北省2020年荆、荆、襄、宜四地七校考试联盟高一联考化学模拟试题江苏省启东市2020届高三下学期阶段调研测试化学试题江苏省南通市2020届高三第二次模拟考试(5月) 化学 试题(已下线)专题19 化学平衡常数的计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
8 . 氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___ 。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___ 的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)__ K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___ (列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___ 。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___ 。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___ 。
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1Ⅱ.CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:
您最近一年使用:0次
2020-03-27更新
|
410次组卷
|
3卷引用:湖北省宜昌市2020届高三年级3月线上统一调研试题理综化学试题
9 . 含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下;2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应相关的化学键键能数据如表一:
表一:
则该反应的△H=___________ kJ/mol
(2)在恒容密闭容器中充入2 molNO2与1molO2发生反应如下:
4NO2(g)+O2(g) 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是____________________________________________ 。
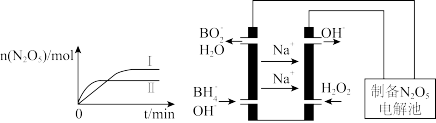
②下列有关该反应的说法正确的是___________ 。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为______________________ 。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各lmol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为______________________ 。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II: 2NO(g)+Cl2(g) 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________ (用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________ ;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2=___________ α1 (填“>”“<”或“=”)
(1)在一定条件下;2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应相关的化学键键能数据如表一:
表一:
| 化学键 |  | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=
(2)在恒容密闭容器中充入2 molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)
 2N2O5(g)
2N2O5(g)①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是
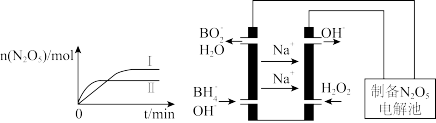
②下列有关该反应的说法正确的是
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各lmol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为
| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1II: 2NO(g)+Cl2(g)
 2ClNO(g) K2
2ClNO(g) K2①4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=
您最近一年使用:0次
解题方法
10 . 温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是| 容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A.容器Ⅰ中发生反应的平衡常数为0.8 | B.容器Ⅱ中发生反应的起始阶段有v正>v逆 |
C.达到平衡时,容器Ⅲ中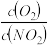 >1 >1 | D.达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17 |
您最近一年使用:0次
2018-05-16更新
|
638次组卷
|
4卷引用:【全国市级联考】湖北省武汉市2018届高中毕业生五月训练题理科综合化学试题
【全国市级联考】湖北省武汉市2018届高中毕业生五月训练题理科综合化学试题(已下线)2018年高考题及模拟题汇编 专题09 反应速率、化学平衡(已下线)高考母题题源07 化学反应速率与化学平衡2020届高三化学二轮冲刺新题专练——化学平衡状态及其判断(提升练)



