1 . 工业制硫酸的过程中, 转化为
转化为 是关键的一步,其反应方程式为:
是关键的一步,其反应方程式为: 。
。
(1)在使用催化剂和未使用催化剂时, 转化为
转化为 的反应过程能量变化如下图所示,过程Ⅰ释放的能量
的反应过程能量变化如下图所示,过程Ⅰ释放的能量___________ 过程Ⅱ释放的能量(填“大于”“小于”或“等于”)。
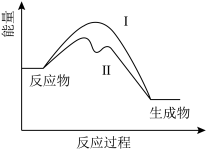
(2)一定温度下,在2L的恒容容器中发生以上转化,反应过程中部分数据见下表:
① 的平均反应速率
的平均反应速率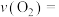
___________  。
。
②平衡时气体压强与初始时气体压强比为___________ 。
③能说明 转化为
转化为 的反应已达平衡状态的是
的反应已达平衡状态的是___________ 。
a. b.
b.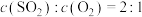
c.容器内压强保持不变 d.单位时间内消耗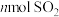 同时生成
同时生成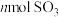
(3)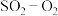 燃料电池可实现在能量利用的同时制备硫酸,其装置如下图所示。
燃料电池可实现在能量利用的同时制备硫酸,其装置如下图所示。
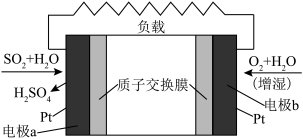
①该装置可以将___________ 能转化为___________ 能。
②电池工作时,电子导体中电子移动方向为___________ (选填“a到b”或“b到a”)
 转化为
转化为 是关键的一步,其反应方程式为:
是关键的一步,其反应方程式为: 。
。(1)在使用催化剂和未使用催化剂时,
 转化为
转化为 的反应过程能量变化如下图所示,过程Ⅰ释放的能量
的反应过程能量变化如下图所示,过程Ⅰ释放的能量
(2)一定温度下,在2L的恒容容器中发生以上转化,反应过程中部分数据见下表:
| 反应时间/min |  | 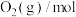 | 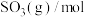 |
| 0 | 4 | 2 | 0 |
| 5 | 1.5 | ||
| 10 | 2 | ||
| 15 | 1 |
 的平均反应速率
的平均反应速率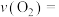
 。
。②平衡时气体压强与初始时气体压强比为
③能说明
 转化为
转化为 的反应已达平衡状态的是
的反应已达平衡状态的是a.
 b.
b.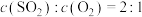
c.容器内压强保持不变 d.单位时间内消耗
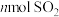 同时生成
同时生成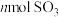
(3)
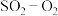 燃料电池可实现在能量利用的同时制备硫酸,其装置如下图所示。
燃料电池可实现在能量利用的同时制备硫酸,其装置如下图所示。
①该装置可以将
②电池工作时,电子导体中电子移动方向为
您最近一年使用:0次
名校
2 . 研究气体的制备和性质有重要意义。某兴趣小组分别对 和
和 的制备进行研究,回答下列问题。
的制备进行研究,回答下列问题。
Ⅰ.氨气的制备

(1)盛装碱石灰的仪器的名称_______ 。
(2)实验室用加热 和
和 固体混合物制备氨气,化学方程式为
固体混合物制备氨气,化学方程式为_______ 。
(3)收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:
_______  尾气处理(按气流方向表示)。
尾气处理(按气流方向表示)。
(4)检验集气瓶已收集满氨的方法:用_______ ,靠近集气瓶口,若出现_______ ,则说明收集满。
Ⅱ. 分解制备
分解制备
(5)探究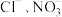 对
对 分解的影响
分解的影响
设计如图实验装置,在试管中分别添加了如下表的试剂和用量,再分别注入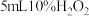 溶液,实验设计如下:
溶液,实验设计如下:

①实验结果显示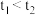 ,可得出的结论是:
,可得出的结论是:_______ (填化学式)更有利于 分解。
分解。
②甲同学查阅资料得知: 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学再进行实验:向两份
干扰,该同学再进行实验:向两份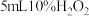 溶液中分别加入
溶液中分别加入 浓度均为
浓度均为_______  的
的_______ (填化学式)溶液和_______ (填化学式)溶液。 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下,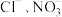 对
对 催化分解无影响。
催化分解无影响。
 和
和 的制备进行研究,回答下列问题。
的制备进行研究,回答下列问题。Ⅰ.氨气的制备

(1)盛装碱石灰的仪器的名称
(2)实验室用加热
 和
和 固体混合物制备氨气,化学方程式为
固体混合物制备氨气,化学方程式为(3)收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:

 尾气处理(按气流方向表示)。
尾气处理(按气流方向表示)。(4)检验集气瓶已收集满氨的方法:用
Ⅱ.
 分解制备
分解制备
(5)探究
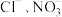 对
对 分解的影响
分解的影响设计如图实验装置,在试管中分别添加了如下表的试剂和用量,再分别注入
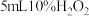 溶液,实验设计如下:
溶液,实验设计如下:
| 实验 | 添加试剂及用量 |  完全分解所需时间 完全分解所需时间 |
| 1 | 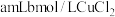 溶液 溶液 |  |
| 2 | 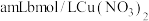 溶液 溶液 |  |
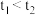 ,可得出的结论是:
,可得出的结论是: 分解。
分解。②甲同学查阅资料得知:
 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学再进行实验:向两份
干扰,该同学再进行实验:向两份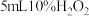 溶液中分别加入
溶液中分别加入 浓度均为
浓度均为 的
的 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下,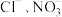 对
对 催化分解无影响。
催化分解无影响。
您最近一年使用:0次
2023-07-12更新
|
214次组卷
|
4卷引用:广东省中山市2022-2023学年高一下学期期末统一考试化学试题
名校
解题方法
3 . 制备乙酸乙酯是中学有机化学中的一个重要实验。某化学学习小组的同学查阅资料发现,某些无机盐类也可以催化乙酸乙酯的合成,为了探究不同盐的催化效果,设计了如下实验:
实验步骤:向大试管中加入一定量的无机盐催化剂,再加入3mL无水乙醇和2mL冰醋酸,按图连接装置。用酒精灯小心均匀地加热试管5min,产生的蒸气经导管通到饱和碳酸钠溶液上方。
实验记录:使用不同的催化剂,实验得到的酯层高度如下表。
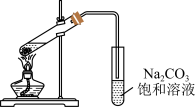
(1)实验时,需要加入几粒沸石,目的是_______ 。
(2)催化剂用量为3mmol(以阳离子计),选用的催化剂A可能是_______ (填标号)。
a.氯化铜晶体b.硫酸钙晶体c.碳酸钠晶体d.硝酸钾晶体
实验所用四种催化剂中,制备乙酸乙酯最好选用_______ 。
(3)若用18O标记乙醇中的O,用氯化铝作催化剂时,产生乙酸乙酯的化学方程式为_______ ,反应类型_______ 。
(4)实验中用饱和碳酸钠溶液的作用是_______ 。得到的混合液经_______ ,蒸馏,最终得到较纯净的乙酸乙酯。
实验步骤:向大试管中加入一定量的无机盐催化剂,再加入3mL无水乙醇和2mL冰醋酸,按图连接装置。用酒精灯小心均匀地加热试管5min,产生的蒸气经导管通到饱和碳酸钠溶液上方。
实验记录:使用不同的催化剂,实验得到的酯层高度如下表。

| 催化剂 | 酯层高度/cm | 催化剂 | 酯层高度/cm |
| 氯化铁晶体 | 2.7 | 氯化铝 | 3.2 |
| A | 2.2 | 氯化钠 | 0.0 |
(2)催化剂用量为3mmol(以阳离子计),选用的催化剂A可能是
a.氯化铜晶体b.硫酸钙晶体c.碳酸钠晶体d.硝酸钾晶体
实验所用四种催化剂中,制备乙酸乙酯最好选用
(3)若用18O标记乙醇中的O,用氯化铝作催化剂时,产生乙酸乙酯的化学方程式为
(4)实验中用饱和碳酸钠溶液的作用是
您最近一年使用:0次
2022-05-05更新
|
110次组卷
|
2卷引用:新疆维吾尔自治区阿克苏地区第二中学2021-2022学年高一年级下学期第二次月考化学试题
4 . 甲烷是一种重要的化工原料,在生产中有着重要的应用。
I.工业上以CH4和H2O为原料,通过下列反应来制备甲醇:
①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H=-129.0kJ•mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___________ 。
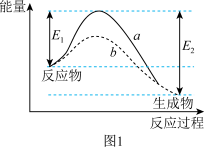
(2)1932年,美国理论化学家亨利·艾琳等人在统计力学和量子力学的基础上建立了过渡态理论,认为催化剂主要是通过改变过渡态物质而降低了活化能。对于反应②,在使用和未使用催化剂时,反应过程和能量的对应关系如图1所示。使用了催化剂的曲线是___________ (填“a”或“b”);断裂反应物中的化学键吸收的总能量___________ (填“>”、“<”或“=”)形成生成物中的化学键释放的总能量。
II.甲烷还可以制作燃料电池。如图2是甲烷燃料电池原理示意图,回答下列问题:
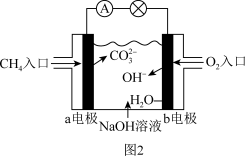
已知:总反应为CH4+2O2+2NaOH=Na2CO3+3H2O
(3)该装置的能量转换形式是___________ 。
(4)电池的负极是___________ (填“a”或“b”),该极的电极反应是 ___________ 。
(5)电池工作一段时间后电解质溶液的碱性___________ (填“增强”、“减弱”或“不变”)。
(6)标准状况下,消耗3.36L甲烷,电路中转移的电子数目为___________ 。
I.工业上以CH4和H2O为原料,通过下列反应来制备甲醇:
①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H=-129.0kJ•mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
(2)1932年,美国理论化学家亨利·艾琳等人在统计力学和量子力学的基础上建立了过渡态理论,认为催化剂主要是通过改变过渡态物质而降低了活化能。对于反应②,在使用和未使用催化剂时,反应过程和能量的对应关系如图1所示。使用了催化剂的曲线是

II.甲烷还可以制作燃料电池。如图2是甲烷燃料电池原理示意图,回答下列问题:

已知:总反应为CH4+2O2+2NaOH=Na2CO3+3H2O
(3)该装置的能量转换形式是
(4)电池的负极是
(5)电池工作一段时间后电解质溶液的碱性
(6)标准状况下,消耗3.36L甲烷,电路中转移的电子数目为
您最近一年使用:0次
名校
5 . 硫酸、硝酸均为重要的化工产品,它们的制备工艺流程示意图如下:

回答下列问题。
(1)若上述过程为工业制硫酸。
①若原料A为黄铁矿(主要成分为FeS2)时,设备I中高温煅烧后会生成固体废渣,该废渣的一种用途是_______ 。
②气体B制备气体C可在V2O5催化下进行,该反应的机理分为两步:
第一步:V2O5+SO2=2VO2+SO3(快)
第二步:_______ (慢)
关于该过程,说法正确的是_______ (填标号)。
A.该过程的反应速率主要取决于第一步
B.VO2是该反应的催化剂
C.增大SO2的浓度可显著提高反应速率
D.增大O2的浓度可显著提高反应速率
(2)若上述过程为工业制硝酸,原料A为氨气。
①气体C在设备III中转化为硝酸时,还需要通入气体E,则气体E的化学式为_______ ,通入气体E的目的是_______ 。
②尾气中的NO2会形成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知NO2用碳酸钠溶液吸收时会生成NaNO2,则吸收NO2的离子方程式为_______ 。
(3)目前,NaClO溶液广泛应用于脱硫脱硝。
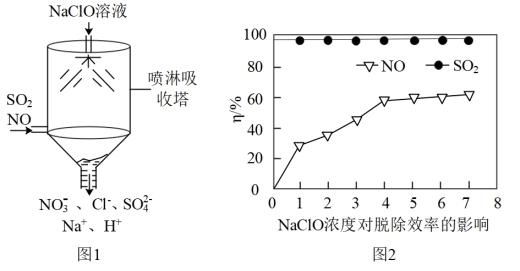
①某课外小组同学设计了如图喷淋吸收塔装置(如图1),设计该装置的优点是_______ 。
②如图2为NaClO浓度对脱硫脱硝效率(η/%)的影响。当温度为50°C,溶液的pH=10(溶液显碱性),c(SO2)=c(NO)=300mg·m-3时,SO2的脱除效率一直维持在98%以上,而NO脱除效率相对较低,其原因是_______ 。

回答下列问题。
(1)若上述过程为工业制硫酸。
①若原料A为黄铁矿(主要成分为FeS2)时,设备I中高温煅烧后会生成固体废渣,该废渣的一种用途是
②气体B制备气体C可在V2O5催化下进行,该反应的机理分为两步:
第一步:V2O5+SO2=2VO2+SO3(快)
第二步:
关于该过程,说法正确的是
A.该过程的反应速率主要取决于第一步
B.VO2是该反应的催化剂
C.增大SO2的浓度可显著提高反应速率
D.增大O2的浓度可显著提高反应速率
(2)若上述过程为工业制硝酸,原料A为氨气。
①气体C在设备III中转化为硝酸时,还需要通入气体E,则气体E的化学式为
②尾气中的NO2会形成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知NO2用碳酸钠溶液吸收时会生成NaNO2,则吸收NO2的离子方程式为
(3)目前,NaClO溶液广泛应用于脱硫脱硝。

①某课外小组同学设计了如图喷淋吸收塔装置(如图1),设计该装置的优点是
②如图2为NaClO浓度对脱硫脱硝效率(η/%)的影响。当温度为50°C,溶液的pH=10(溶液显碱性),c(SO2)=c(NO)=300mg·m-3时,SO2的脱除效率一直维持在98%以上,而NO脱除效率相对较低,其原因是
您最近一年使用:0次
2022-04-21更新
|
285次组卷
|
2卷引用:湖北省武汉市部分重点中学2021-2022学年高一下学期期中联考化学试题
10-11高一下·辽宁·期中
名校
6 . 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
(1)该同学的实验目的是________________________ ;要得出正确的实验结论,还需控制的实验条件是________________________________________ 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是____________________________ ;应该测定的实验数据是________________________________________________________________________ 。
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________ 的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是________ 。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快 |

(1)该同学的实验目的是
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
您最近一年使用:0次
2016-12-09更新
|
1012次组卷
|
6卷引用:2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷
(已下线)2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷(已下线)2012-2013学年新疆乌鲁木齐市一中高一(平行班)下学期期中考试化学试卷(已下线)2013届新疆乌鲁木齐市一中高一下学期平行班期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012年鲁科版高中化学选修6 2反应条件对化学反应的影响练习卷安徽省合肥市第十一中学2020-2021学年高二上学期第一次月考化学试题
13-14高一下·四川雅安·期中
名校
解题方法
7 . 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为_________________________________________ 。
(2)甲同学的实验目的是_____________ ;要得出正确的实验结论,还需控制的实验条件是____________ 。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
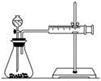
(3)乙同学在实验中应该测定的数据是___________________________________________________ 。
(4)乙同学完成该实验应选用的实验药品是________ ,该实验中不选用某浓度的硫酸,理由是___________ 。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________ 的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________ (填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为
(2)甲同学的实验目的是

(3)乙同学在实验中应该测定的数据是
(4)乙同学完成该实验应选用的实验药品是
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
您最近一年使用:0次
2016-12-09更新
|
1625次组卷
|
8卷引用:2013-2014四川省雅安中学下学期期中考试高一化学试卷
(已下线)2013-2014四川省雅安中学下学期期中考试高一化学试卷新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题(已下线)2013-2014重庆市重庆一中下学期期中考试高二化学试卷(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题
名校
8 . 利用下列图示装置进行实验,能达到相应目的的是
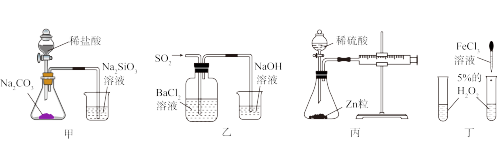

| A.用甲比较氯、碳、硅的非金属性强弱 |
| B.用乙制备BaSO3 |
| C.根据丙装置在反应开始后,针筒活塞向右移动确定该反应为放热反应 |
| D.用丁研究催化剂对化学反应速率的影响 |
您最近一年使用:0次
2022-09-14更新
|
478次组卷
|
3卷引用:四川省凉山州西昌市2021-2022学年高一下学期期中考试化学试题
四川省凉山州西昌市2021-2022学年高一下学期期中考试化学试题(已下线)广东省深圳市龙岗区龙城高级中学、深圳市第二高级中学2022-2023学年高一下学期期中联考化学试题辽宁省大连市第二十四中学2022-2023学年高一下学期期中考试化学试题
名校
9 . 利用下列图示装置进行实验,能达到相应目的的是


| A.用甲比较氯、碳、硅的非金属性强弱 |
| B.用乙制备BaSO3 |
| C.用丙证明苯与液溴反应产生了HBr |
| D.用丁研究催化剂对化学反应速率的影响 |
您最近一年使用:0次
2021-07-14更新
|
207次组卷
|
3卷引用:四川省绵阳市2020-2021学年高一下学期期末考试化学试题
10 . 某研究型学习小组的同学根据化学反应中的能量和速率变化对生产生活有着重要意义,进行下面的探究活动。
(1)甲同学为探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化,向装有铁片的试管中滴加lmol/L的H2SO4,试管内产生气泡,触摸试管外壁,温度升高。
①该反应为______ (填“放热” 或“吸热” ) 反应。
②下列措施中,能加快氢气生成速率的是______ (填字母)。
a.将铁片改成铁粉 b. 将稀H2SO4改成浓硫酸 c.加硫酸钠溶液
(2)乙学生依据原电池原理也可加快反应速率,设计了Fe与稀硫酸反应的装置图,观察到的现象是_____ ;铜片上发生反应的电极反应式为_____ 。

(3)丙同学根据4NH3+6NO 5N2+6H2O反应的发生条件,在老师的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
5N2+6H2O反应的发生条件,在老师的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。

①写出实验室用固体混合物加热的方法制备 NH3的化学方程式________ 。
②为了比较不同催化剂的催化性能,需要测量并记录的数据是__________ 。
③在不同催化剂时测得混合气体中NH3的物质的量与时间的关系如下图,则曲线_______ (填“①”或“②” 或“③”)使用的催化剂催化性能最好,理由是________ 。

(1)甲同学为探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化,向装有铁片的试管中滴加lmol/L的H2SO4,试管内产生气泡,触摸试管外壁,温度升高。
①该反应为
②下列措施中,能加快氢气生成速率的是
a.将铁片改成铁粉 b. 将稀H2SO4改成浓硫酸 c.加硫酸钠溶液
(2)乙学生依据原电池原理也可加快反应速率,设计了Fe与稀硫酸反应的装置图,观察到的现象是

(3)丙同学根据4NH3+6NO
 5N2+6H2O反应的发生条件,在老师的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
5N2+6H2O反应的发生条件,在老师的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
①写出实验室用固体混合物加热的方法制备 NH3的化学方程式
②为了比较不同催化剂的催化性能,需要测量并记录的数据是
③在不同催化剂时测得混合气体中NH3的物质的量与时间的关系如下图,则曲线

您最近一年使用:0次



