1 . 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:_________________
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为___________ 钛极附近的pH值______ (增大、减小、不变)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为______________ 。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: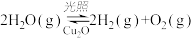 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是_______ (填字母)。
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu + H2O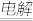 Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
②C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:
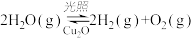 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。| 序号 | 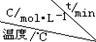 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
您最近半年使用:0次
名校
解题方法
2 . 铜及其化合物在工农业生产有着重要的用途,氯化铜、氯化业铜经常用作催化剂。其中CuCl广泛应用于化工和印染等行业。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15 -25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)
(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略) 制备氯化铜。
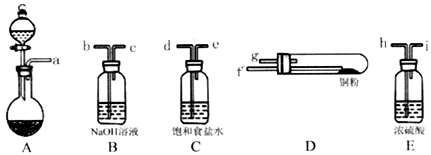
①按气流方向连接各仪器接口顺序是:
a→_____ 、_____ →_____ 、_____ →_____ 、_____ →_____ 。
②本套装置有两个仪器需要加热,加热的顺序为先_____ 后_______
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:_____________________ 。
(3)现欲从(2)所得溶液获得纯净的CuCl2•2H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X 用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3•H2O C.CuO d.CuSO4
②要获得纯净CuCl2•2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、_____ 、_____ 、洗涤、干燥。
(4)用CuCl2•2H2O为原料制备CuCl 时,发现其中含有少量的CuCl 2或CuO杂质,若杂质是CuCl2,则产生的原因是______________ 。
(5)设计简单的实验验证0.1mol/L 的CuCl2溶液中的Cu2+ 对H2O2的分解具有催化作用:_____ 。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15 -25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)

(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略) 制备氯化铜。

①按气流方向连接各仪器接口顺序是:
a→
②本套装置有两个仪器需要加热,加热的顺序为先
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:
(3)现欲从(2)所得溶液获得纯净的CuCl2•2H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X 用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3•H2O C.CuO d.CuSO4
②要获得纯净CuCl2•2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、
(4)用CuCl2•2H2O为原料制备CuCl 时,发现其中含有少量的CuCl 2或CuO杂质,若杂质是CuCl2,则产生的原因是
(5)设计简单的实验验证0.1mol/L 的CuCl2溶液中的Cu2+ 对H2O2的分解具有催化作用:
您最近半年使用:0次
2018-04-22更新
|
430次组卷
|
2卷引用:内蒙古赤峰市2018届高三4月模拟理科综合化学试题
名校
解题方法
3 . 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:________________________ 。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为______ 离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:_____________ 钛极附近的pH值________ (增大、减小、不变)。
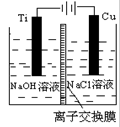
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:____________ 。
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O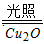 2H2+O2 ΔH>0
2H2+O2 ΔH>0
水蒸气的浓度随时间t变化如下表所示。
①对比实验的温度T2_____ T1(填“>”“<”或“=”)。
②实验①前20 min的平均反应速率v(O2)=______ 。
③催化剂催化效率:实验①______ 实验② (填“>”、“<")。
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu + H2O  Cu2O + H2↑ Cu2O + H2↑ |
| 方法d | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O
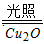 2H2+O2 ΔH>0
2H2+O2 ΔH>0水蒸气的浓度随时间t变化如下表所示。
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.0500 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.1000 | 0.0940 | 0.0900 | 0.0900 | 0.0900 | 0.0900 |
①对比实验的温度T2
②实验①前20 min的平均反应速率v(O2)=
③催化剂催化效率:实验①
您最近半年使用:0次
4 . 3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点 181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯 相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】
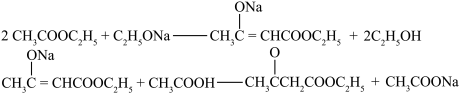
【实验装置】
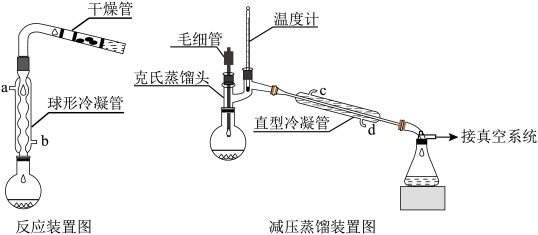
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是_____________ 。
(2)反应装置中加干燥管是为了__________ 。两个装置中冷凝管的作用__________ (填“相同”或“不相同”),冷却水进水口分别为__________ 和_____________ (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是__________ ,稀醋酸不能加多了,原因是___________ 。用分液漏斗分离出酯层的操作叫____________ 。碳酸钠溶液洗涤的目的是_________________ 。加碳酸钾的目的是______________ 。
(4)采用减压蒸馏的原因是_______________ 。
(5)本实验所得到的3-丁酮酸乙酯产率是_____________ (填正确答案标号)。
【反应原理】

【实验装置】

【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是
(2)反应装置中加干燥管是为了
(3)产物后处理中,滴加稀醋酸的目的是
(4)采用减压蒸馏的原因是
(5)本实验所得到的3-丁酮酸乙酯产率是
| A.10% | B.22% | C.19% | D.40% |
您最近半年使用:0次
2016-12-09更新
|
524次组卷
|
2卷引用:2015届湖北省襄阳市普通高中高三1月调研理综化学试卷
名校
5 . Ⅰ.某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
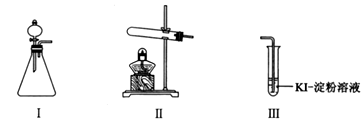
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
(2)丙实验中O2与KI溶液反应的离子方程式是_______________ 。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是________ 。为进一步探究该条件对反应速率的影响,可采取的实验措施是________ 。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列溶液________ (填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
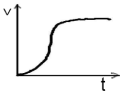
Ⅱ.酸性条件下KMnO4与H2C2O4(弱酸)反应常用于探究影响化学反应速率的因素。该反应的离子反应方程式为:__ ;由该反应生成气体体积与时间关系可得出反应过程中速率的变化情况为___ ,其原因是__
Ⅲ.为探讨化学反应速率的影响因素,某同学设计的实验方案如下表。(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
①该实验进行的目的是________ ,淀粉溶液的作用是_______ 。
②表中Vx=____ mL;实验①中用Na2S2O3表示反应速率v(Na2S2O3)=______

供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列溶液
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
Ⅱ.酸性条件下KMnO4与H2C2O4(弱酸)反应常用于探究影响化学反应速率的因素。该反应的离子反应方程式为:

Ⅲ.为探讨化学反应速率的影响因素,某同学设计的实验方案如下表。(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验 序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 0.1mol/L 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | 40 |
| ② | 7.0 | 2.0 | 4.0 | 3.0 | t1 |
| ③ | 5.0 | 2.0 | 4.0 | Vx | t2 |
②表中Vx=
您最近半年使用:0次



