名校
解题方法
1 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4==2MnSO4+10CO2↑+8H2O+K2SO4
【实验内容及记录】
请回答:
(1)请完成上述实验设计表:V1=_________ ,V2=__________ 。
(2)根据上表中的实验数据,可以得到的结论是_________________________________ 。
(3)利用实验1中数据计算,反应速率为v(KMnO4)=_________________________ 。
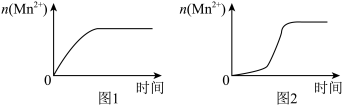
(4)该小组同学依据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。____________________________________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_______________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4==2MnSO4+10CO2↑+8H2O+K2SO4
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液褪色至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.1 mol/L KMnO4溶液 | 3 mol/L H2SO4溶液 | ||
| 1 | 3.0 | 13.0 | 2.0 | 2.0 | 8.0 |
| 2 | 2.0 | 14.0 | 2.0 | 2.0 | 10.4 |
| 3 | 1.0 | V1 | V2 | 2.0 | 12.8 |
(1)请完成上述实验设计表:V1=
(2)根据上表中的实验数据,可以得到的结论是
(3)利用实验1中数据计算,反应速率为v(KMnO4)=
(4)该小组同学依据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量 | 室温下溶液褪色至无色所需时间/min | ||||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.1 mol/L KMnO4溶液 | 3 mol/L H2SO4溶液 | 少量 | ||
| 4 | 3.0mL | 13.0mL | 2.0mL | 2.0mL | t | |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2020-09-05更新
|
535次组卷
|
6卷引用:河北正定中学2019-2020学年高一下学期摸底考试化学试题
2 . 某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________ 。
(2)该实验结论是_______________________ 。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________ 。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________ 。
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

a.该同学拟研究的影响因素是___________________ 。
b.你认为该同学的实验方案_______________ (填“合理”或“不合理”),理由是____________________________ 。
| 实验序号 | ① | ② | ③ |
| 加入试剂 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量MnSO4固体 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
(2)该实验结论是
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

a.该同学拟研究的影响因素是
b.你认为该同学的实验方案
您最近一年使用:0次
名校
解题方法
3 . 结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________ 。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________ 。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____ 。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某城市场上销售的一种食用精制盐包装袋上有如下部分说明:
已知:IO +5I-+6H+ = 3I2+3H2O,I2+2S2O
+5I-+6H+ = 3I2+3H2O,I2+2S2O = 2I-+S4O
= 2I-+S4O 某学生拟测定食用精制盐的碘含量,其步骤为
某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________ ,恰好完全反应时的现象是_______________ 。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________ (填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________ mg·kg-1(计算结果保留整数即可)。
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
| 实验序号 | ① | ② |
| 加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
| 褪色时间/s | 116 | 6 |
请回答:
(1)该实验结论是
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为
| 实验序号 | ③ |
| 加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
| 褪色时间/s |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
| 碘含量(以I计) | 20~50 mg·kg-1 |
 +5I-+6H+ = 3I2+3H2O,I2+2S2O
+5I-+6H+ = 3I2+3H2O,I2+2S2O = 2I-+S4O
= 2I-+S4O 某学生拟测定食用精制盐的碘含量,其步骤为
某学生拟测定食用精制盐的碘含量,其步骤为a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)
您最近一年使用:0次
2018-12-06更新
|
212次组卷
|
3卷引用:【校级联考】天津市七校(静海一中,杨村中学,宝坻一中,大港一中等)2018-2019学年高二上学期期中联考化学试题
名校
4 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol /L的溶液。在FeCl2溶 液中需加入少量铁屑,其目的是___________ 。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________ 。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1 mol/LFeCl3溶液混合。 分别取2 mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______ (填离子符号);实验①和实验③说明:在I-过量的情况下, 溶液中仍含有_____ (填离子符号);由此可以证明该氧化还原反应为___________ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________ 。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________ 。 生成沉淀的原因是______________ (用平衡移动原理解释)。
(6)某铁的氧化物(FexO) 1.52 g溶于足量盐酸中,向所得溶液通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化,则x值为________ 。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol /L的溶液。在FeCl2溶 液中需加入少量铁屑,其目的是
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1 mol/LFeCl3溶液混合。 分别取2 mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
(6)某铁的氧化物(FexO) 1.52 g溶于足量盐酸中,向所得溶液通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化,则x值为
您最近一年使用:0次
2018-06-02更新
|
181次组卷
|
2卷引用:【全国区级联考】天津市南开区2018届高三三模化学试题



