解题方法
1 . (1)已知拆开1molH-H键、1molI-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘反应生成1molHI需要___ (填“放出”或“吸收”)___ kJ的热量。
(2)为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
①上表中,反应速率最快的是___ (填实验序号);
②设计实验2、3的目的是___ ;
③实验3、4预期可得出的结论是___ 。
(2)为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
| 实验序号 | 温度 | H2O2溶液初始浓度 | MnO2颗粒大小 |
| 1 | 25℃ | 4% | 无MnO2 |
| 2 | 25℃ | 12% | 1g细颗粒MnO2 |
| 3 | 25℃ | 4% | 1g细颗粒MnO2 |
| 4 | 25℃ | 4% | 1g粗颗粒MnO2 |
①上表中,反应速率最快的是
②设计实验2、3的目的是
③实验3、4预期可得出的结论是
您最近一年使用:0次
名校
解题方法
2 . (1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
其他条件不变时:探究温度对化学反应速率的影响,应选择实验_______ (填实验编号); 若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为_______ 和_______ 。
(2)研究表明,SO2催化氧化的反应速率方程为:v = k(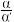 −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
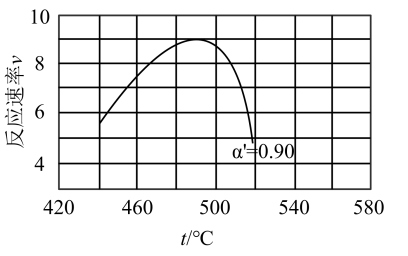
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是_______
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
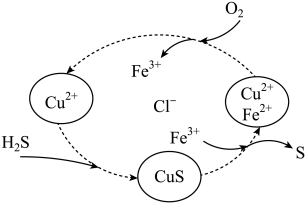
图2
①该循环过程中 Fe3+起的作用是:________ 写出该该反应的化学方程式_______
| 实验 编号 | 实验温 度/℃ | c(Na2S2O3) /(mol·L-1) | V(Na2S2O3) /mL | c(H2SO4) /(mol·L-1) | V(H2SO4) /mL | V(H2O) /mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
(2)研究表明,SO2催化氧化的反应速率方程为:v = k(
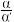 −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:

图2
①该循环过程中 Fe3+起的作用是:
您最近一年使用:0次
名校
3 . 硫酸工厂尾气中常常含有较多的SO2,常采用如下方法进行处理。
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是___________ (填字母)。
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO
Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=___________ KJ·mol-1。
Ⅲ.CO还原法。
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)_________ K(状态Ⅱ)(填“大于”、“小于”或“等于”,下同)。逆反应速率v逆:v逆(状态Ⅰ)_________ v逆(状态Ⅱ)
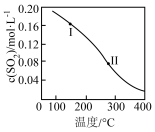
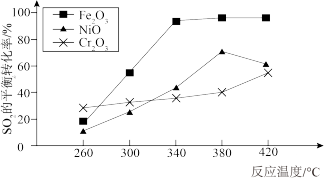
(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择_____ (填“Fe2O3”、“NiO”或“Cr2O3”)作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择Fe2O3作催化剂的优势是______ 。
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO

Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=
Ⅲ.CO还原法。
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)

(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择

您最近一年使用:0次
2020-12-15更新
|
112次组卷
|
2卷引用:江苏省如皋中学2020-2021学年高二上学期第二次阶段考试化学(选修)试题
解题方法
4 . 作为一种绿色消毒剂,H2O2在公共卫生事业中发挥了重要的作用。已知反应:H2O2(l)= H2O(1)+ 1/2O2(g)ΔH= -98 kJ·mol-1 K= 2.88×1020,回答问题:
(1) H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是_______ (填名称)。
(2) 纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l) = H2O(g)+ O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上 _____ (填“放出”或“吸收”)热量_____ 98kJ (填“大于”、“小于”或“等于”)。
(3) 纯H2O2相对稳定,实验表明在54℃下恒温贮存2周,浓度仍能保持99%,原因是H2O2分解反应的____ (填编号)。
a.ΔH比较小 b.K不够大 c.速率比较小 d.活化能比较大
(4) 向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起_________ 作用。
(5)某组实验数据如下:
0-30 min H2O2反应的平均速率v=_____ mol ·L-1·min-1
(6) 已知用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应): 。某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的计算式为
。某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的计算式为___________ 。
(1) H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2) 纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l) = H2O(g)+
 O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上 (3) 纯H2O2相对稳定,实验表明在54℃下恒温贮存2周,浓度仍能保持99%,原因是H2O2分解反应的
a.ΔH比较小 b.K不够大 c.速率比较小 d.活化能比较大
(4) 向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
(5)某组实验数据如下:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(H2O2)/mol ·L-1 | 0.70 | 0.49 | 0.35 | 0.25 | 0.17 | 0.12 |
(6) 已知用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):
 。某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的计算式为
。某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的计算式为
您最近一年使用:0次
名校
解题方法
5 . 实验一:已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计如下(所取溶液体积均为10mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________ 对化学反应速率的影响。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
请回答:
(2)表中V1=___________ ,V2=___________ 。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=________________________ 。
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________ 的影响。
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________ (填字母序号)。
A.硫酸钾B.硫酸锰C.氯化锰D.水
设计如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol·L-1) | c(H2SO4)/(mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/LKMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
| 3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
(2)表中V1=
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入
A.硫酸钾B.硫酸锰C.氯化锰D.水
您最近一年使用:0次
2020-11-26更新
|
305次组卷
|
5卷引用:福建省漳州市平和县第一中学2020-2021学年高二上学期期中考试化学试题
解题方法
6 . 工业上H2O2是一种重要的绿色氧化还原试剂,某小组对H2O2的催化分解实验进行探究。回答下列问题:
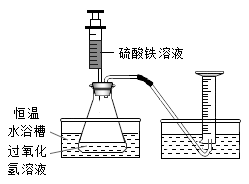
(1)在同浓度Fe3+的催化下,探究外界条件对H2O2分解反应速率的影响。实验装置如图所示:
①H2O2溶液在Fe3+催化下分解的反应历程如下:
第一步反应历程为:2Fe3+ + H2O2 = 2Fe2+ +O2 +2H+
第二步反应历程为:________ ;
除了图中所示仪器之外,该实验还必需的仪器是________ 。
②请完成下面表格中I、II、III的实验记录内容或数据:
V1=________ ,V2=________ ;根据所学的知识判断,当三个实验中均产生10ml气体时,所需反应时间最长的是___________ (填“t1”、“t2”或“t3”)
(2)该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。

①由图中信息可知________ 法制取得到的催化剂活性更高。
②推测Co2+、Ni2+两种离子中催化效果更好的是________ 。
(1)在同浓度Fe3+的催化下,探究外界条件对H2O2分解反应速率的影响。实验装置如图所示:

①H2O2溶液在Fe3+催化下分解的反应历程如下:
第一步反应历程为:2Fe3+ + H2O2 = 2Fe2+ +O2 +2H+
第二步反应历程为:
除了图中所示仪器之外,该实验还必需的仪器是
②请完成下面表格中I、II、III的实验记录内容或数据:
| 实验编号 | 0.1mol•L﹣1Fe2(SO4)3 | 0.1mol•L﹣1H2O2溶液 | 蒸馏水(mL) | 反应温度/℃ | 反应时间(秒) |
| Ⅰ | 2mL | 20mL | 0 | 20 | t1 |
| Ⅱ | 2mL | V1mL | 2mL | 20 | t2 |
| Ⅲ | V2 mL | 20mL | 0 | 50 | t3 |
(2)该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。

①由图中信息可知
②推测Co2+、Ni2+两种离子中催化效果更好的是
您最近一年使用:0次
11-12高二·安徽安庆·阶段练习
名校
解题方法
7 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________ 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_____________________ 。
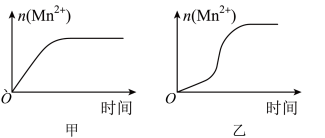
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。______________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_____________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液 颜色褪至无色 所需时间/min | |||
| 0.6 mol · L-1 H2C2O4溶液 | H2O | 0.2 mol · L-1 KMnO4溶液 | 3 mol · L-1 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2020-10-12更新
|
155次组卷
|
11卷引用:2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷
(已下线)2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时1 化学反应的速率山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题福建省福州重点中学2022-2023学年高一下学期期中考试化学试题安徽省黄山市屯溪第一中学、中科大附中2020-2021学年高一下学期期中联考化学试题黑龙江省哈尔滨市宾县一中2020-2021学年高一下学期第二次月考化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)河南省南阳市邓州市第一高级中学校2023-2024学年高一下学期第一次月考化学试题B卷
8 . 发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________ ;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。
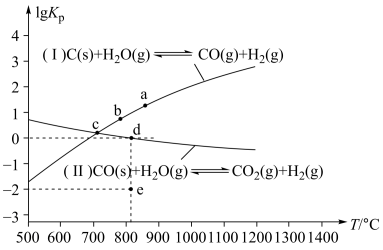
①反应(I)的△H______ 0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________ ;此时CO的转化率为________ ;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的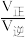 =
=______ ;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________ (填数值)。
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率
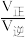 =
=③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为
您最近一年使用:0次
2020-06-19更新
|
299次组卷
|
3卷引用:广东省珠海市2020届高三第三次模拟理综化学试题
9 . 亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
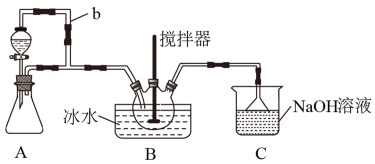
(1)装置A制取SO2
①A中反应的化学方程式为___ 。
②导管b的作用是___ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___ (只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___ 。
(3)装置C的主要作用是___ (用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___ 。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__ MnO4-+__ C2O42-+__ =__ Mn2++__ +__ H2O
②滴定终点时的现象为___ 。
③亚硝酰硫酸的纯度=___ 。(精确到0.1%)[M(NOSO4H)=127g·mol-1]

(1)装置A制取SO2
①A中反应的化学方程式为
②导管b的作用是
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是
(3)装置C的主要作用是
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:
②滴定终点时的现象为
③亚硝酰硫酸的纯度=
您最近一年使用:0次
2020-03-10更新
|
390次组卷
|
3卷引用:【市级联考】福建省泉州市2019届高三毕业班下学期第一次质量检查理科综合化学试题
名校
解题方法
10 . 氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为:2H2O2(aq)=2H2O(l)+O2(g) ΔH=akJ·mol-1
①相同条件下,H2O2分解时,使用催化剂,不会改变的是___ (填标号)。
A.反应热 B.反应速率 C.活化能 D.生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为:H2O2+2Fe3+=2Fe2++O2+2H+,第二步反应的化学方程式为___ 。
(2)已知:O2(g)+4HCl(g) 2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

①该反应的速率v=k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是___ (填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.平衡后分离出水蒸气,k变小
D.平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1___ T2(填“>”或“<”)。该反应的ΔH___ 0(填“>”或“<”)。
③T2时,HCl的平衡转化率=___ 。
(1)用H2O2制取O2时,分解的热化学方程式为:2H2O2(aq)=2H2O(l)+O2(g) ΔH=akJ·mol-1
①相同条件下,H2O2分解时,使用催化剂,不会改变的是
A.反应热 B.反应速率 C.活化能 D.生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为:H2O2+2Fe3+=2Fe2++O2+2H+,第二步反应的化学方程式为
(2)已知:O2(g)+4HCl(g)
 2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v=k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是
A.温度升高,k增大
B.使用催化剂,k不变
C.平衡后分离出水蒸气,k变小
D.平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1
③T2时,HCl的平衡转化率=
您最近一年使用:0次



