名校
解题方法
1 . 实验一:已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计如下(所取溶液体积均为10mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________ 对化学反应速率的影响。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
请回答:
(2)表中V1=___________ ,V2=___________ 。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=________________________ 。
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________ 的影响。
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________ (填字母序号)。
A.硫酸钾B.硫酸锰C.氯化锰D.水
设计如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol·L-1) | c(H2SO4)/(mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/LKMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
| 3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
(2)表中V1=
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入
A.硫酸钾B.硫酸锰C.氯化锰D.水
您最近一年使用:0次
2020-11-26更新
|
305次组卷
|
5卷引用:福建省漳州市平和县第一中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
2 . 某实验小组利用酸性KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
(1)上表中V=____________ ,若②③组为对比试验,则T____________ 25℃(填“>”、“<”或“=”)。
(2)上述反应的化学方程式为____________ 。
(3)t1_____ t2(填“>”、“<”、“=”),其理由是____________ 。
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:____________ (请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______ 。
A.硫酸钾B.硫酸锰C.水D.氯化锰
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | V | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | T | t3 |
(2)上述反应的化学方程式为
(3)t1
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是
A.硫酸钾B.硫酸锰C.水D.氯化锰
您最近一年使用:0次
2020-10-15更新
|
225次组卷
|
3卷引用:广东省广州市中山大学附属中学2019-2020学年高二10月月考化学试题
3 . 某研究型学习小组的同学根据化学反应中的能量和速率变化对生产生活有着重要意义,进行下面的探究活动。
(1)甲同学为探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化,向装有铁片的试管中滴加lmol/L的H2SO4,试管内产生气泡,触摸试管外壁,温度升高。
①该反应为______ (填“放热” 或“吸热” ) 反应。
②下列措施中,能加快氢气生成速率的是______ (填字母)。
a.将铁片改成铁粉 b. 将稀H2SO4改成浓硫酸 c.加硫酸钠溶液
(2)乙学生依据原电池原理也可加快反应速率,设计了Fe与稀硫酸反应的装置图,观察到的现象是_____ ;铜片上发生反应的电极反应式为_____ 。

(3)丙同学根据4NH3+6NO 5N2+6H2O反应的发生条件,在老师的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
5N2+6H2O反应的发生条件,在老师的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。

①写出实验室用固体混合物加热的方法制备 NH3的化学方程式________ 。
②为了比较不同催化剂的催化性能,需要测量并记录的数据是__________ 。
③在不同催化剂时测得混合气体中NH3的物质的量与时间的关系如下图,则曲线_______ (填“①”或“②” 或“③”)使用的催化剂催化性能最好,理由是________ 。

(1)甲同学为探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化,向装有铁片的试管中滴加lmol/L的H2SO4,试管内产生气泡,触摸试管外壁,温度升高。
①该反应为
②下列措施中,能加快氢气生成速率的是
a.将铁片改成铁粉 b. 将稀H2SO4改成浓硫酸 c.加硫酸钠溶液
(2)乙学生依据原电池原理也可加快反应速率,设计了Fe与稀硫酸反应的装置图,观察到的现象是

(3)丙同学根据4NH3+6NO
 5N2+6H2O反应的发生条件,在老师的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
5N2+6H2O反应的发生条件,在老师的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
①写出实验室用固体混合物加热的方法制备 NH3的化学方程式
②为了比较不同催化剂的催化性能,需要测量并记录的数据是
③在不同催化剂时测得混合气体中NH3的物质的量与时间的关系如下图,则曲线

您最近一年使用:0次
4 . 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=__________ 。当反应达到平衡时,若增大压强,则n(C2H4)___________ (填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
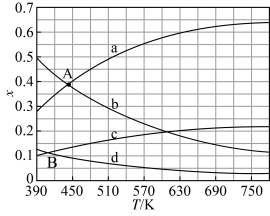
图中,表示C2H4、CO2变化的曲线分别是______ 、______ 。CO2催化加氢合成C2H4反应的ΔH______ 0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_________ (MPa)−3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________________ 。
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

图中,表示C2H4、CO2变化的曲线分别是
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当
您最近一年使用:0次
2020-07-09更新
|
16366次组卷
|
23卷引用:2020年全国统一考试化学试题(新课标Ⅲ)
2020年全国统一考试化学试题(新课标Ⅲ)(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编2020年全国卷Ⅲ化学真题变式题陕西省富平县蓝光中学2021-2022学年高三上学期期末教学检测化学试题(已下线)专题15 化学反应原理大题不丢分-2021年高考化学必做热点专题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)押全国卷理综第28题 化学反应原理-备战2021年高考化学临考题号押题选择性必修1 专题2 素养检测江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题吉林省白山市抚松县第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第28题 化学反应原理-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题15化学反应原理综合-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)第20讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(新教材新高考)吉林省洮南市第一中学2022-2023学年高二上学期第一次(10月)月考化学试题(已下线)专题十二化学反应速率与平衡(已下线)专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第七章 化学反应速率与化学平衡 第45讲 实际工业生产中图像问题分类突破(已下线)专题05 反应原理专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题17 原理综合题
5 . 合成氨反应N2( g ) +3H2( g ) = 2NH3( g ),反应过程的能量变化如图所示。已知N2( g )与H2( g )反应生成17 gNH3(g),放出46. 1kJ的热量。请回答下列问题:

(1)该反应通常用铁作催化剂,加催化剂会使图中E_______________ (填“变大”或“变小”),E的大小对该反应的反应热有无影响?___________ ,理由是__________ 。
(2)图中△H=________ kJ·mol-1。
(3)起始充入2mol·L-1N2和5.5mol·L-1H2,经过50min,NH3的浓度为1mol·L-1,则v(N2)=______ mol·L-1·min-1,c(H2)=_____ mol·L-1
(4)已知NH3(g)=NH3(l)△H=-QkJ·mol-1,则N2( g ) +3H2( g ) = 2NH3( l )的△H=_______ kJ·mol-1

(1)该反应通常用铁作催化剂,加催化剂会使图中E
(2)图中△H=
(3)起始充入2mol·L-1N2和5.5mol·L-1H2,经过50min,NH3的浓度为1mol·L-1,则v(N2)=
(4)已知NH3(g)=NH3(l)△H=-QkJ·mol-1,则N2( g ) +3H2( g ) = 2NH3( l )的△H=
您最近一年使用:0次
6 . I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:
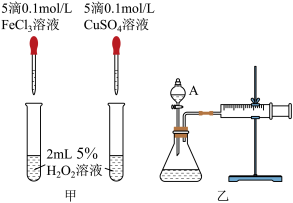
(1)定性分析:甲所示装置可通过观察___ ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___ 。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为___ ,实验中需要测量的数据是___ 。
Ⅱ.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
(1)写出实验①中H2O2分解的化学方程式___ 。
(2)通过实验①和②对比可知,化学反应速率与____ 有关;从实验③和④对比可知,化学反应速率与温度的关系是___ 。

(1)定性分析:甲所示装置可通过观察
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为
Ⅱ.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应所需时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
(2)通过实验①和②对比可知,化学反应速率与
您最近一年使用:0次
2019-11-04更新
|
124次组卷
|
2卷引用:陕西省榆林市第二中学2019-2020学年高二上学期期中考试化学试题
名校
7 . (1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________ (填“吸热”或“放热”)反应,其能量变化可用图中的____________ (填“B”或“C”)表示。

(2)已知拆开1molH-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mol NH3时反应___________ (填“放出”或“吸收”)________ kJ 的热量。
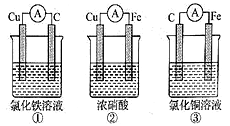
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______ (填序号),写出正极的电极反应_____________________ 。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________ g。

(2)已知拆开1molH-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mol NH3时反应
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是

您最近一年使用:0次
2018-06-23更新
|
131次组卷
|
3卷引用:陕西省澄城县城关中学2019-2020学年高一下学期第三次月考化学试题
名校
解题方法
8 . 研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:

(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验__________ (填“能”或“不能”)达到目的,原因是__________ 。(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
由此得到的结论是__________ ,设计实验Ⅲ的目的是__________ 。
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________ 和__________ (按反应发生的顺序写)。

(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
| 试管 | I | II | III |
| 滴加试剂 | 5滴0.lmol·L-1FeCl3 | 5 滴 0.1mol·L-1CuCl2 | 5 滴 0.3mol·L-1NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是
您最近一年使用:0次
9 . 硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志。生产硫酸的主要反应为:SO2(g)+  O2(g)
O2(g) SO3(g)。
SO3(g)。
(1)恒温恒容下,平衡体系中SO3的体积分数[ϕ(SO3)]和y与SO2、O2的物质的量之比[n(SO2)/n(O2)]的关系如图:


则b点n(SO2)/n(O2)=______ ;y为_______ (填编号)。
A.平衡常数 B.SO3的平衡产率
C.O2的平衡转化率 D.SO2的平衡转化率
(2)Kp是以各气体平衡分压代替浓度平衡常数Kc中各气体的浓度的平衡常数。在400~650 ℃时,Kp与温度(T/K)的关系为lgKp= —4.6455,则在此条件下SO2转化为SO3反应的△H
—4.6455,则在此条件下SO2转化为SO3反应的△H_______ (填“>0”或“<0”)。
(3)①该反应的催化剂为V2O5,其催化反应过程为:
SO2+V2O5 SO3+V2O4 K1
SO3+V2O4 K1
 O2+V2O4
O2+V2O4 V2O5 K2
V2O5 K2
则在相同温度下2SO2(g)+O2(g) 2SO3(g)的平衡常数K=
2SO3(g)的平衡常数K=______ (以含K1、K2的代数式表示)。
②V2O5加快反应速率的原因是_____________________________ ,其催化活性与温度的关系如图(左)。
(4)在7.0% SO2、11% O2、82% N2时,SO2平衡转化率与温度、压强的关系如下图(右):则460℃、1.0 atm下,SO2(g)+ O2(g)
O2(g) SO3(g)的Kp=
SO3(g)的Kp=____________ (各气体的分压=总压×各气体的体积分数)。


(5)压强通常采用常压的原因是______________________________________ ,综合第(3)、(4)题图给信息,工业生产最适宜的温度范围400℃-500℃,你认为最主要的原因是___________ 。
A.原料转化率最大
B.已达到反应装置所能承受的最高温度
C.催化剂的活性最高
 O2(g)
O2(g) SO3(g)。
SO3(g)。(1)恒温恒容下,平衡体系中SO3的体积分数[ϕ(SO3)]和y与SO2、O2的物质的量之比[n(SO2)/n(O2)]的关系如图:


则b点n(SO2)/n(O2)=
A.平衡常数 B.SO3的平衡产率
C.O2的平衡转化率 D.SO2的平衡转化率
(2)Kp是以各气体平衡分压代替浓度平衡常数Kc中各气体的浓度的平衡常数。在400~650 ℃时,Kp与温度(T/K)的关系为lgKp=
 —4.6455,则在此条件下SO2转化为SO3反应的△H
—4.6455,则在此条件下SO2转化为SO3反应的△H(3)①该反应的催化剂为V2O5,其催化反应过程为:
SO2+V2O5
 SO3+V2O4 K1
SO3+V2O4 K1 O2+V2O4
O2+V2O4 V2O5 K2
V2O5 K2则在相同温度下2SO2(g)+O2(g)
 2SO3(g)的平衡常数K=
2SO3(g)的平衡常数K=②V2O5加快反应速率的原因是
(4)在7.0% SO2、11% O2、82% N2时,SO2平衡转化率与温度、压强的关系如下图(右):则460℃、1.0 atm下,SO2(g)+
 O2(g)
O2(g) SO3(g)的Kp=
SO3(g)的Kp=

(5)压强通常采用常压的原因是
A.原料转化率最大
B.已达到反应装置所能承受的最高温度
C.催化剂的活性最高
您最近一年使用:0次
2017-05-18更新
|
239次组卷
|
2卷引用:陕西省西藏民族学院附属中学2017届高三下学期第四次模拟考试理科综合化学试题



