1 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的N2和CO2:
(1)已知:①N2(g) + O2(g)⇌2NO(g) ∆H1= +180.5 kJ/mol;②CO的燃烧热∆H2=−283.0 kJ/mol,则反应③2NO(g) + 2CO(g)⇌N2(g) + 2CO2(g) ∆H3=_____________ 。
(2)某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,发生反应③。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:
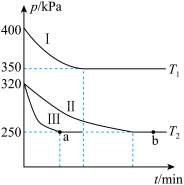
①温度:T1_______ T2(填“<”、“=”或“>”)
②CO的平衡转化率:α(Ⅰ)________ α(Ⅱ)________ α(Ⅲ)(填“<”、“=”或“>”)
③反应速率:a点的v正______ b点的v逆(填“<”、“=”或“>”)
④T2时反应③的压强平衡常数Kp=__________ 。
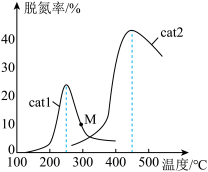
(3)将NO和CO以一定的流速通过两种不同的催化剂(Cat1、Cat2)进行反应,相同时间内测量的脱氮率 脱氮率即NO的转化率
脱氮率即NO的转化率 如图所示。M点
如图所示。M点___________ (填“是”或“不是”)对应温度下的平衡脱氮率,说明理由_________ 。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)⇌2I(g) 快速平衡,平衡常数为K
第二步:I(g)+N2O(g) =N2(g)+IO(g) 慢反应,v=k1·c(N2O)·c(I)
第三步:IO(g)+N2O(g) =N2(g)+O2(g)+ I2(g) 快反应
I2(g) 快反应
其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数 。
。
①k=_____ 用含K和 的代数式表示
的代数式表示 。
。
②下列表述正确的是_______ 。
A.IO为反应的中间产物
B.碘蒸气的浓度大小不会影响N2O的分解速率
C.第二步对总反应速率起决定作用
D.第二步反应的活化能小于第三步反应的活化能
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的N2和CO2:
(1)已知:①N2(g) + O2(g)⇌2NO(g) ∆H1= +180.5 kJ/mol;②CO的燃烧热∆H2=−283.0 kJ/mol,则反应③2NO(g) + 2CO(g)⇌N2(g) + 2CO2(g) ∆H3=
(2)某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,发生反应③。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:

①温度:T1
②CO的平衡转化率:α(Ⅰ)
③反应速率:a点的v正
④T2时反应③的压强平衡常数Kp=
(3)将NO和CO以一定的流速通过两种不同的催化剂(Cat1、Cat2)进行反应,相同时间内测量的脱氮率
 脱氮率即NO的转化率
脱氮率即NO的转化率 如图所示。M点
如图所示。M点
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)⇌2I(g) 快速平衡,平衡常数为K
第二步:I(g)+N2O(g) =N2(g)+IO(g) 慢反应,v=k1·c(N2O)·c(I)
第三步:IO(g)+N2O(g) =N2(g)+O2(g)+
 I2(g) 快反应
I2(g) 快反应其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数
 。
。①k=
 的代数式表示
的代数式表示 。
。②下列表述正确的是
A.IO为反应的中间产物
B.碘蒸气的浓度大小不会影响N2O的分解速率
C.第二步对总反应速率起决定作用
D.第二步反应的活化能小于第三步反应的活化能
您最近一年使用:0次
名校
解题方法
2 . 草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生反应:
(实验1)甲同学用8.00mL0.001mol/LKMnO4溶液与5.00mL0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
(1)写出草酸(H2C2O4)与高锰酸钾溶液在酸性条件下反应的离子方程式____ 。
(2)上述进行实验Ⅰ、Ⅲ的目的是探究____ 对化学反应速率的影响。
(实验2)乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_____ 的影响。
(4)若证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需试剂最合理的是___ (填字母)。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
(实验1)甲同学用8.00mL0.001mol/LKMnO4溶液与5.00mL0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | KMnO4溶液/mL | H2C2O4溶液/mL | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00mL蒸馏水 |
(2)上述进行实验Ⅰ、Ⅲ的目的是探究
(实验2)乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(4)若证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需试剂最合理的是
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
您最近一年使用:0次
名校
解题方法
3 . 某实验小组利用酸性KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
(1)上表中V=____________ ,若②③组为对比试验,则T____________ 25℃(填“>”、“<”或“=”)。
(2)上述反应的化学方程式为____________ 。
(3)t1_____ t2(填“>”、“<”、“=”),其理由是____________ 。
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:____________ (请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______ 。
A.硫酸钾B.硫酸锰C.水D.氯化锰
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | V | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | T | t3 |
(2)上述反应的化学方程式为
(3)t1
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是
A.硫酸钾B.硫酸锰C.水D.氯化锰
您最近一年使用:0次
2020-10-15更新
|
225次组卷
|
3卷引用:广东省广州市中山大学附属中学2019-2020学年高二10月月考化学试题
名校
解题方法
4 . 设计实验测定锌与硫酸反应的速率,按下列实验步骤完成实验:

①按图示安装装置,加入锌粒,然后快速加入40mL1mol/L的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安装一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol/L的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、50mL注射器、铁架台、________ 。
(2)观察到的现象是:____________________________________ ;
收集10mL气体②所用时间比①所用时间________ 。
(3)所能得出的实验结论是:_________________________________ 。
(4)若在①实验中加入适量MnO2,则:________
A.如果①比②速率慢,则证明MnO2无催化作用
B.如果①比②速率快,则不能证明MnO2有无催化作用
C.如果①比②速率慢,则不能证明MnO2有无催化作用
D.如果①比②速率快,则证明MnO2有催化作用

①按图示安装装置,加入锌粒,然后快速加入40mL1mol/L的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安装一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol/L的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、50mL注射器、铁架台、
(2)观察到的现象是:
收集10mL气体②所用时间比①所用时间
(3)所能得出的实验结论是:
(4)若在①实验中加入适量MnO2,则:
A.如果①比②速率慢,则证明MnO2无催化作用
B.如果①比②速率快,则不能证明MnO2有无催化作用
C.如果①比②速率慢,则不能证明MnO2有无催化作用
D.如果①比②速率快,则证明MnO2有催化作用
您最近一年使用:0次
2020-10-14更新
|
239次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题
11-12高二·安徽安庆·阶段练习
名校
解题方法
5 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________ 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_____________________ 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。______________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_____________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液 颜色褪至无色 所需时间/min | |||
| 0.6 mol · L-1 H2C2O4溶液 | H2O | 0.2 mol · L-1 KMnO4溶液 | 3 mol · L-1 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
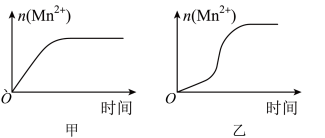
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2020-10-12更新
|
155次组卷
|
11卷引用:2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷
(已下线)2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时1 化学反应的速率山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题黑龙江省哈尔滨市宾县一中2020-2021学年高一下学期第二次月考化学试题安徽省黄山市屯溪第一中学、中科大附中2020-2021学年高一下学期期中联考化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)福建省福州重点中学2022-2023学年高一下学期期中考试化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一下学期第一次月考化学试题B卷
名校
6 . 汽车尾气中含有CO、NO等有害气体。
(1)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
(提示:O2-可在此固体电解质中自由移动)___________ 反应(填“氧化”或“还原”)。
②外电路中,电子是从_________ 电极流出(填“NiO”或“Pt”)。
③Pt电极上的电极反应式为_______________________________ 。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
①请将表中数据补充完整:a___________ 。
②能验证温度对化学反应速率规律的是实验____________________ (填实验序号)。
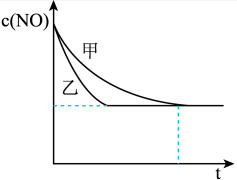
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________ (填“甲”或“乙”)。 2CO2+N2,
2CO2+N2,不能 说明已达到平衡状态的是________ (不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(1)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
(提示:O2-可在此固体电解质中自由移动)
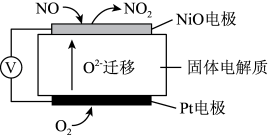
②外电路中,电子是从
③Pt电极上的电极反应式为
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO
 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。| 实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
| Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线
 2CO2+N2,
2CO2+N2,A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
您最近一年使用:0次
2020-09-18更新
|
292次组卷
|
3卷引用:广东省佛山市第一中学2019-2020学年高一下学期期中考试化学试题
名校
7 . 某实验探究小组用酸性KMnO4 溶液与H2C2O4 溶液反应过程中紫色消失快慢的方法,研究影响反应速率的因素。实验条件如下:所用酸性KMnO4 溶液浓度可选择 0.010 mol·L-1、0.001 mol·L-1,催化剂的量可选择0.5 g、0 g,实验温度可选择298 K、323K。每次实验酸性KMnO4 溶液量均为4 mL,H2C2O4 溶液(0.100 mol·L-1)的用量均为2 mL。
(1)写出反应的离子方程式并用单线桥表示电子转移方向和数目________ 。
(2)请将实验设计表补充完整。
实验目的:
a.实验①和②探究酸性KMnO4 溶液的浓度对该反应速率的影响;
b.实验①和③探究____ 对该反应速率的影响;
c.实验①和④探究催化剂对该反应速率的影响;
(3)该反应的催化剂应选择MnCl2还是MnSO4?______ ,简述选择的理由___________ 。
(4)某同学对实验①和②分别进 了三次重复实验,测得以下实验数据(从混合振荡均匀开始计时):
实验②中KMnO4 的浓度变化表示的平均反应速率为________ (忽略混合前后溶液的体积变化,结果保留3 位有效数字)
(1)写出反应的离子方程式并用单线桥表示电子转移方向和数目
(2)请将实验设计表补充完整。
| 实验编号 | T/K | 催化剂的量/g | 酸性KMnO4 溶液的浓度/(mol·L-1) |
| ① | 298 | 0.5 | 0.010 |
| ② | 298 | 0.5 | 0.001 |
| ③ | 323 | 0.5 | 0.010 |
| ④ |
实验目的:
a.实验①和②探究酸性KMnO4 溶液的浓度对该反应速率的影响;
b.实验①和③探究
c.实验①和④探究催化剂对该反应速率的影响;
(3)该反应的催化剂应选择MnCl2还是MnSO4?
(4)某同学对实验①和②分别进 了三次重复实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪所需时间t/min | ||
| 第1 次 | 第2次 | 第3 次 | |
| ① | 12.8 | 13.0 | 11.0 |
| ② | 4.9 | 5.1 | 5.0 |
实验②中KMnO4 的浓度变化表示的平均反应速率为
您最近一年使用:0次
名校
解题方法
8 . 如图是研究催化剂对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(瓶中已有适量催化剂),记录各时间段收集到的氧气的体积。
实验一:以二氧化锰作催化剂,进行以下四组实验。
第1组:粉末状的二氧化锰0.2g+5mL6%H2O2
第2组:粉末状的二氧化锰0.2g+5mL10%H2O2
第3组:粉末状的二氧化锰0.1g+5mL6%H2O2
第4组:颗粒状的二氧化锰0.1g+5mL6%H2O2
实验二:以不同的催化剂对过氧化氢(均为5mL6%H2O2)分解反应速率影响进行研究,记录反应的时间t和相应的量筒内的气体体积读数V,用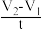 t作为反应速率的表达式(单位:mL•s﹣1),得到以下实验数据:
t作为反应速率的表达式(单位:mL•s﹣1),得到以下实验数据:
(1)写出实验一中H2O2分解的反应方程式_________ 。
(2)实验一的几组数据能够说明在实验中影响反应速率的因素主要有_________ 。
(3)实验二的几组数据反映出的问题是_________ 。
(4)用碰撞理论解释使用正催化剂能增大化学反应速率的原因_________ 。
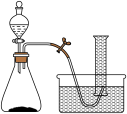
实验一:以二氧化锰作催化剂,进行以下四组实验。
第1组:粉末状的二氧化锰0.2g+5mL6%H2O2
第2组:粉末状的二氧化锰0.2g+5mL10%H2O2
第3组:粉末状的二氧化锰0.1g+5mL6%H2O2
第4组:颗粒状的二氧化锰0.1g+5mL6%H2O2
| 催化剂:MnO2 | 0.2g粉末状的MnO2+5mL6%H2O2 | 0.2g粉末状的MnO2+5mL10%H2O2 | 0.1g粉末状的MnO2+5mL6%H2O2 | 0.1g颗粒状的MnO2+5mL6%H2O2 |
| 前15s产生O2(mL) | 11 | 15 | 8 | 7 |
| 前30s产生O2(mL) | 21 | 24 | 11 | 9 |
| 前45s产生O2(mL) | 31 | 35 | 18 | 12 |
| 前60s产生O2(mL) | 45 | 48 | 26 | 15 |
实验二:以不同的催化剂对过氧化氢(均为5mL6%H2O2)分解反应速率影响进行研究,记录反应的时间t和相应的量筒内的气体体积读数V,用
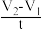 t作为反应速率的表达式(单位:mL•s﹣1),得到以下实验数据:
t作为反应速率的表达式(单位:mL•s﹣1),得到以下实验数据:| 催化剂 | 产生气体速率/mL•s﹣1 | 催化剂 | 产生气体速率/mL•s﹣1 |
| MnO2 | 0.03 | 土豆 | 0.03 |
| CuO | 0.07 | 活性炭 | 0.12 |
(1)写出实验一中H2O2分解的反应方程式
(2)实验一的几组数据能够说明在实验中影响反应速率的因素主要有
(3)实验二的几组数据反映出的问题是
(4)用碰撞理论解释使用正催化剂能增大化学反应速率的原因

您最近一年使用:0次
名校
解题方法
9 . 某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。

(1)上述反应后草酸被氧化为______ (填化学式)。
(2)实验①和②的结果表明_____________ ;实验①中O~t1时间段反应速率v(Cr3+)=____________ mol·L-1·min-1(用代数式表示)。
(3)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:________________ ;
假设三:________________ ;
………
(4)请你设计实验验证上述假设一,完成下表中内容。[除了上述实验提供的试剂外,可供选择的试剂有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中 的浓度可用仪器测定]
的浓度可用仪器测定]
 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 | 20 |
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(1)上述反应后草酸被氧化为
(2)实验①和②的结果表明
(3)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:
假设三:
………
(4)请你设计实验验证上述假设一,完成下表中内容。[除了上述实验提供的试剂外,可供选择的试剂有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中
 的浓度可用仪器测定]
的浓度可用仪器测定]| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
您最近一年使用:0次
10 . 草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:5H2C2O4+2MnO +6H+→2Mn2++10CO2↑+8H2O
+6H+→2Mn2++10CO2↑+8H2O
甲同学用8.00mL0.001 mol•L-1 KMnO4 溶液与 5.00mL 0.01 mol•L-1 H2C2O4 溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
(l)对比实验l和3,主要探究____ 对化学反应速率的影响;实验3中加入2.00mL蒸馏水的目的是________ 。
(2)甲同学在研究反应的影响因素时发现, 草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显, 但不久后突然褪色, 反应速率明显加快.甲同学认为除了反应放热,导致溶液温度升高,还可能是________ 的影响,为了证明猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是_ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
(3)乙同学为了测定某高锰酸钾产品的质量分数,取0.500g的高锰酸钾产品,配成50.00 mL溶液,取出 10.00 mL, 用 0.100 mol•L-1草酸标准溶液滴定至终点,消耗草酸标准溶液15.00 mL。计算该样品中高锰酸钾的质量分数(写出计算过程)。_________
 +6H+→2Mn2++10CO2↑+8H2O
+6H+→2Mn2++10CO2↑+8H2O甲同学用8.00mL0.001 mol•L-1 KMnO4 溶液与 5.00mL 0.01 mol•L-1 H2C2O4 溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
| 序号 | KMnO4/mL | H2C2O4/mL | 10%H2SO4/mL | 温度/℃ | 其他物质 |
| 1 | 8.00 | 5.00 | 3.00 | 20 | |
| 2 | 8.00 | 5.00 | 3.00 | 30 | |
| 3 | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL蒸馏水 |
(l)对比实验l和3,主要探究
(2)甲同学在研究反应的影响因素时发现, 草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显, 但不久后突然褪色, 反应速率明显加快.甲同学认为除了反应放热,导致溶液温度升高,还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
(3)乙同学为了测定某高锰酸钾产品的质量分数,取0.500g的高锰酸钾产品,配成50.00 mL溶液,取出 10.00 mL, 用 0.100 mol•L-1草酸标准溶液滴定至终点,消耗草酸标准溶液15.00 mL。计算该样品中高锰酸钾的质量分数(写出计算过程)。
您最近一年使用:0次
2020-08-02更新
|
144次组卷
|
2卷引用:江苏省南通市通州区2019-2020学年高一下学期期末学业质量监测化学试题



