2020高三·全国·专题练习
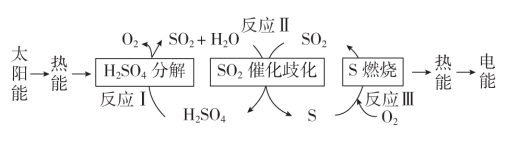
1 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
(1)反应Ⅱ:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1;对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
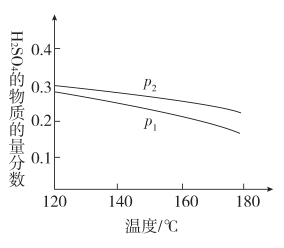
p2_______ p1(填“>”或“<”),得出该结论的理由是_______ 。
(2)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+=S↓+2I2+2H2O
ⅱ.I2+2H2O+_______ =_______ +_______ +2I-
(3)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如表:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明,SO2的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:_______ 。

(1)反应Ⅱ:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1;对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2
(2)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+=S↓+2I2+2H2O
ⅱ.I2+2H2O+
(3)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如表:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI,0.2mol·L-1 H2SO4 | 0.2mol·L-1H2SO4 | 0.2 mol·L-1 KI,0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
您最近一年使用:0次
2021-09-06更新
|
195次组卷
|
8卷引用:专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训
(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训鲁科版(2019)高一必修第二册 模块复习备考攻略(已下线)专题讲座(七) 常考速率、平衡图像题解题策略 (精讲)——2021年高考化学一轮复习讲练测(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(五)反应速率、平衡图像题解题策略(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)
解题方法
2 . 合成氨工业对国民经济和社会发展有重要的意义。
(1)合成氨工业中常以天然气与水蒸气为原料制取H2:CH4(g) + H2O(g) CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
则CH4(g) + H2O(g) CO(g) + 3H2(g) △H=
CO(g) + 3H2(g) △H=________ kJ·mol−1。
(2)某科技小组在实验室中模拟合成氨反应,在430℃、20KPa时,将一定量的N2、 H2置于2L的恒容密闭容器中发生反应,N2(g) + 3H2(g) 2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
①前10min内的H2的平均反应速率为_______ mol/(L·min)
②反应进行到10min 时,曲线发生变化的原因可能是____
A.加入N2 B.减小容器容积
C.加入催化剂 D.降低温度
③反应进行到25min时,曲线发生变化的原因是__________ ,再次达平衡时,平衡常数______ (填“增大”“减小”或“不变”)。
(3)工业上还利用天然和水蒸气反应的产物合成甲醇:CO(g) + 2H2(g) CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:

①p1_____ p2 (填“>”、“<“或“=”,下同)
②比较该反应在A、B两点的平衡常数大小:K(A)_______ K(B)。
(1)合成氨工业中常以天然气与水蒸气为原料制取H2:CH4(g) + H2O(g)
 CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,| 化学键 | C−H | H−H |  (CO) (CO) | H−O |
| 键能(kJ·mol−1) | 413 | 436 | 1075 | 465 |
 CO(g) + 3H2(g) △H=
CO(g) + 3H2(g) △H=(2)某科技小组在实验室中模拟合成氨反应,在430℃、20KPa时,将一定量的N2、 H2置于2L的恒容密闭容器中发生反应,N2(g) + 3H2(g)
 2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
①前10min内的H2的平均反应速率为
②反应进行到10min 时,曲线发生变化的原因可能是
A.加入N2 B.减小容器容积
C.加入催化剂 D.降低温度
③反应进行到25min时,曲线发生变化的原因是
(3)工业上还利用天然和水蒸气反应的产物合成甲醇:CO(g) + 2H2(g)
 CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
①p1
②比较该反应在A、B两点的平衡常数大小:K(A)
您最近一年使用:0次
3 . 国家主席习近平在9月22日召开的联合国大会上表示:“中国将争取在2060年前实现碳中和”。所谓“碳中和”,通俗地说,日常活动可能制造的二氧化碳排放量,通过植树、节能减排等方法来中和抵消。
(1)CO2甲烷化反应是由法国化学家PaulSabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图1:

①上述过程中,加入铁粉的作用是____ 。
②HCOOH是CO2转化为CH4的中间体:CO2 HCOOH
HCOOH CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是____ 。
(2)一定条件下,Pd-Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为____ ,反应过程中碳元素的化合价为-2价的中间体是____ 。

(3)CO2和CH4是两种重要的温室气体,通过化学反应可以将它们转化为其他物质。以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示,250~300℃时,温度升高而乙酸的生成速率降低的原因是______ 。
②为了提高该反应中CH4的转化率,可以采取的措施是______ 。

(1)CO2甲烷化反应是由法国化学家PaulSabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图1:

①上述过程中,加入铁粉的作用是
②HCOOH是CO2转化为CH4的中间体:CO2
 HCOOH
HCOOH CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是(2)一定条件下,Pd-Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为

(3)CO2和CH4是两种重要的温室气体,通过化学反应可以将它们转化为其他物质。以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示,250~300℃时,温度升高而乙酸的生成速率降低的原因是
②为了提高该反应中CH4的转化率,可以采取的措施是

您最近一年使用:0次
解题方法
4 . 某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL0.001mol·L-1KMnO4溶液中分别加入不同浓度的草酸溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001mol·L-1KMnO4溶液,实验结果如图2。回答有关问题:
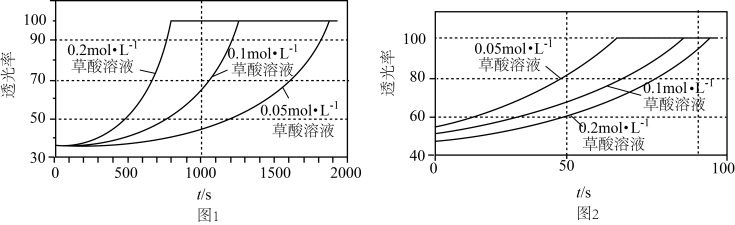
已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同) Mn(VI)
Mn(VI) Mn(IV)
Mn(IV) Mn(III)
Mn(III) Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
(1)实验时发生总反应的离子方程式为___ 。
(2)由题可知,Mn(II)的作用是___ ;由图2可知,在当前实验条件下,增大草酸的浓度,褪色时间___ (填“变大”、“变小”或“不变”)。
(3)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
①请完成此实验设计:V5=___ ,V6=___ 。
②设计A号试管实验的目的是___ 。
(4)已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5。
①写出H2C2O4与少量的KOH溶液反应的离子方程式:___ 。
②已知25℃时CH3COOH的电离常数为K=1.75×10-5,则等浓度的草酸溶液和醋酸溶液中,pH较小的是___ 。

已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同)
 Mn(VI)
Mn(VI) Mn(IV)
Mn(IV) Mn(III)
Mn(III) Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2(1)实验时发生总反应的离子方程式为
(2)由题可知,Mn(II)的作用是
(3)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
| 试管编号 | 0.01mol•L-1KMnO4溶液/mL | 0.2mol•L-1 H2C2O4溶液/mL | 蒸馏水/mL | 2.0mol•L-1H2SO4溶液/mL |
| A | 4.0 | 2.0 | 2.0 | 0 |
| B | V1 | V2 | 1.5 | V3 |
| C | V4 | 2.0 | V5 | 1.0 |
| D | V6 | 2.0 | 0 | 2.0 |
①请完成此实验设计:V5=
②设计A号试管实验的目的是
(4)已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5。
①写出H2C2O4与少量的KOH溶液反应的离子方程式:
②已知25℃时CH3COOH的电离常数为K=1.75×10-5,则等浓度的草酸溶液和醋酸溶液中,pH较小的是
您最近一年使用:0次
名校
解题方法
5 . H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2(2%和5%两种浓度)分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察_______ 定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______ 。

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为______ ,检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看______ ,实验中需要测量的数据是______ 。
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如丙图所示。由D到A过程中,随着反应的进行反应速率逐渐______ (填“加快”或“减慢”),其变化的原因是______ 。(选填字母编号)

A.改变了反应的活化能
B.改变活化分子百分比
C.改变了反应途径
D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
可得到的结论是浓度越大,H2O2分解速率越快。
(1)定性分析:图甲可通过观察

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如丙图所示。由D到A过程中,随着反应的进行反应速率逐渐

A.改变了反应的活化能
B.改变活化分子百分比
C.改变了反应途径
D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
| 实验编号 | T/K | 催化剂 | 浓度 |
| 实验1 | 298 | 3滴FeCl3溶液 | 10mL2%H2O2 |
| 实验2 | 298 |
您最近一年使用:0次
6 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+8H2O+K2SO4(实验内容及记录)
请回答:
(1)请完成上述实验设计表:V1=_______ ,V2=_______ 。
(2)根据上表中的实验数据,可以得到的结论是_______________ 。
(3)利用实验1中数据计算,反应速率为v(KMnO4)=_________ 。
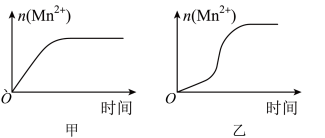
(4)该小组同学依据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

该小组同学提出的假设是_____________________ 。
(实验原理)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+8H2O+K2SO4(实验内容及记录)
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液褪色至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.1 mol/L KMnO4溶液 | 3 mol/L H2SO4溶液 | ||
| 1 | 3.0 | 13.0 | 2.0 | 2.0 | 8.0 |
| 2 | 2.0 | 14.0 | 2.0 | 2.0 | 10.4 |
| 3 | 1.0 | V1 | V2 | 2.0 | 12.8 |
(1)请完成上述实验设计表:V1=
(2)根据上表中的实验数据,可以得到的结论是
(3)利用实验1中数据计算,反应速率为v(KMnO4)=
(4)该小组同学依据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

该小组同学提出的假设是
您最近一年使用:0次
7 . KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02mol·L-1、0.002mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol·L-1、4mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL。
(1)已知:①H2C2O4电离常数,Ka1=5.9×10-2,Ka2=6.4×10-5。
②与KMnO4反应时,H2C2O4转化为CO2和H2O。
写出草酸与酸性高锰酸钾溶液反应的离子方程式___ 。
(2)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成___ 组实验进行对比即可得出结论。
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
①用0.002mol·L-1KMnO4酸性溶液进行实验时,KMnO4的平均反应速率___ (忽略混合前后溶液体积变化)。
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
则表中a=___ ;b=___ ;c=___ 。
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应初始时变化不大一段时间后快速增大的原因:___ 。

①所用KMnO4酸性溶液的浓度可选择:0.02mol·L-1、0.002mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol·L-1、4mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL。
(1)已知:①H2C2O4电离常数,Ka1=5.9×10-2,Ka2=6.4×10-5。
②与KMnO4反应时,H2C2O4转化为CO2和H2O。
写出草酸与酸性高锰酸钾溶液反应的离子方程式
(2)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应初始时变化不大一段时间后快速增大的原因:

您最近一年使用:0次
名校
解题方法
8 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________ 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_____________________ 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。______________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_____________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液 颜色褪至无色 所需时间/min | |||
| 0.6 mol · L-1 H2C2O4溶液 | H2O | 0.2 mol · L-1 KMnO4溶液 | 3 mol · L-1 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2020-10-12更新
|
154次组卷
|
11卷引用:【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题
【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时1 化学反应的速率(已下线)2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题安徽省黄山市屯溪第一中学、中科大附中2020-2021学年高一下学期期中联考化学试题黑龙江省哈尔滨市宾县一中2020-2021学年高一下学期第二次月考化学试题福建省福州重点中学2022-2023学年高一下学期期中考试化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一下学期第一次月考化学试题B卷(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)
9 . 证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图所示装置进行实验,实验时均以生成相同状况下25mL气体为准,其他可能影响实验的因素均已忽略,相关数据如表所示:
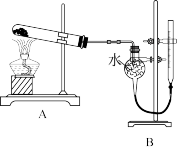
回答下列问题:
(1)上述实验中的“待测数据”是指__________ 。
(2)若要证明实验②中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管,拔去干燥管上的单孔像皮塞,____________________ 。
(3)若a__________ b(填“>”“=”或“<”),则可证明氧化铜能加快氯酸钾的分解。

| 实验序号 |  质量 质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | a | |
| ② | 1.2g | CuO 0.5g | b |
| ③ | 1.2g |  0.5g 0.5g | c |
回答下列问题:
(1)上述实验中的“待测数据”是指
(2)若要证明实验②中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管,拔去干燥管上的单孔像皮塞,
(3)若a
您最近一年使用:0次
解题方法
10 . 某同学在实验室研究化学反应快慢的影响因素。
(1)研究催化剂对化学反应快慢的影响,实验步骤如下:
I.向3支大小相同的试管a、b、c中各加入相同体积(2mL)5% 溶液;
溶液;
Ⅱ.向试管a中加入少量 粉末,向试管b中滴加1~2滴
粉末,向试管b中滴加1~2滴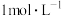
 溶液。
溶液。
得出实验结论: 与
与 均能加快
均能加快 的分解,且前者的催化效率高得多。
的分解,且前者的催化效率高得多。
①步骤Ⅰ中分别向3支试管中加入相同体积的溶液的目的是_________ 。
②设计试管c的目的是_________ 。
③若继续用上述实验药品研究温度对 分解快慢的影响,为了便于观察,选择的催化剂是
分解快慢的影响,为了便于观察,选择的催化剂是_____ ,原因是_________ 。
(2)现提供下列实验用品研究化学反应快慢的影响因素。
实验仪器:试管、烧杯、量筒、天平、秒表
实验药品:铝片、铝粉、 盐酸、
盐酸、 盐酸
盐酸
①利用所提供实验用品,可研究的化学反应快慢的影响因素是________ ,为了便于观察,你建议记录的数据是_____ 。
②设计实验探究温度对化学反应快慢的影响,说明实验步骤(实验仪器和药品任选):________ 。
(1)研究催化剂对化学反应快慢的影响,实验步骤如下:
I.向3支大小相同的试管a、b、c中各加入相同体积(2mL)5%
 溶液;
溶液;Ⅱ.向试管a中加入少量
 粉末,向试管b中滴加1~2滴
粉末,向试管b中滴加1~2滴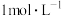
 溶液。
溶液。得出实验结论:
 与
与 均能加快
均能加快 的分解,且前者的催化效率高得多。
的分解,且前者的催化效率高得多。①步骤Ⅰ中分别向3支试管中加入相同体积的溶液的目的是
②设计试管c的目的是
③若继续用上述实验药品研究温度对
 分解快慢的影响,为了便于观察,选择的催化剂是
分解快慢的影响,为了便于观察,选择的催化剂是(2)现提供下列实验用品研究化学反应快慢的影响因素。
实验仪器:试管、烧杯、量筒、天平、秒表
实验药品:铝片、铝粉、
 盐酸、
盐酸、 盐酸
盐酸①利用所提供实验用品,可研究的化学反应快慢的影响因素是
②设计实验探究温度对化学反应快慢的影响,说明实验步骤(实验仪器和药品任选):
您最近一年使用:0次



