名校
1 . 控制变量思想在探究实验中有重要应用,下列实验对影响化学反应速率的因素进行探究。
Ⅰ.催化剂对速率的影响
探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2 mL 5%的H2O2溶液,再向其中分别滴入1 mL浓度均为0.1 mol·L-1 的FeCl3溶液和CuSO4溶液。
(1)H2O2分解的化学方程式是_____ 。
(2)有同学建议将CuSO4改为CuCl2溶液,理由是______ ;还有同学认为即使改用了 CuCl2溶液,仍不严谨,建议补做对比实验:向2 mL 5%的H2O2溶液中滴入的试剂及其用量是____ 。
Ⅱ.浓度对速率的影响
实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
(3)配平下列化学方程式:
____ KMnO4+____ H2C2O4+____ =____ K2SO4+____ MnSO4+____ CO2↑+____ H2O
(4)实验1中t min 时溶液褪色,用草酸表示的反应速率v(H2C2O4)=___ mol·L-1· min-1。
联系实验1、2,预期结论是_________ 。
(5)n(CO2)随时间的变化如下图1所示,其变化的原因是________ 。

(6)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是_______ 。
Ⅰ.催化剂对速率的影响
探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2 mL 5%的H2O2溶液,再向其中分别滴入1 mL浓度均为0.1 mol·L-1 的FeCl3溶液和CuSO4溶液。
(1)H2O2分解的化学方程式是
(2)有同学建议将CuSO4改为CuCl2溶液,理由是
Ⅱ.浓度对速率的影响
实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
| 实验1 | 实验2 | |
| 试剂1 | 2 mL 0.1mol·L-1的草酸溶液 | 2 mL 0.2mol·L-1的草酸溶液 |
| 试剂2 | 4 mL 0.01 mol·L-1的高锰酸钾酸性溶液 | 4 mL 0.01 mol·L-1的高锰酸钾酸性溶液 |
(3)配平下列化学方程式:
(4)实验1中t min 时溶液褪色,用草酸表示的反应速率v(H2C2O4)=
联系实验1、2,预期结论是
(5)n(CO2)随时间的变化如下图1所示,其变化的原因是

(6)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是
您最近一年使用:0次
2020-11-16更新
|
374次组卷
|
3卷引用:四川省成都七中2020-2021学年度高二上学期期中考试化学试题
2 . 一种利用含硫物质的热化学循环来实现能量的转化与存储的构想如图所示:
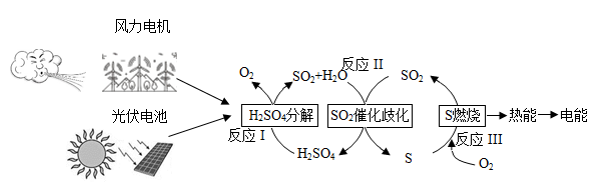
回答下列问题:
(1)举出图中两种形式的能量转化:________ 、________ 。
(2)反应I的化学方程式为_________ 。
(3)研究表明,I-可以作为水溶液中SO2歧化反应的催化剂,催化过程如下:
i.________ (请补充完整);
ii. I2+2H2O+SO2=4H++SO +2I-。
+2I-。
(4)SO2歧化反应速率与i、ii反应速率有一定关系,某同学设计实验如下:分别将18 mL SO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。
已知:I2易溶解在KI溶液中。
①B是A的对比实验,a=_______ ;A、B对比实验说明________ ;A、C对比实验说明________ 。
②实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________ 。
(5)已知原子利用率是指目标产物中某原子的总质量与反应物中某原子的总质量之比。反应Ⅱ若目标产物是H2SO4,则硫原子利用率为________ %(结果保留三位有效数字)。

回答下列问题:
(1)举出图中两种形式的能量转化:
(2)反应I的化学方程式为
(3)研究表明,I-可以作为水溶液中SO2歧化反应的催化剂,催化过程如下:
i.
ii. I2+2H2O+SO2=4H++SO
 +2I-。
+2I-。(4)SO2歧化反应速率与i、ii反应速率有一定关系,某同学设计实验如下:分别将18 mL SO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol•L-1的KI | a mol•L-1的KI 0.2 mol•L-1的H2SO4混合物 | 0.2 mol•L-1的H2SO4 | 0.2 mol•L-1的KI和0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,a=
②实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
(5)已知原子利用率是指目标产物中某原子的总质量与反应物中某原子的总质量之比。反应Ⅱ若目标产物是H2SO4,则硫原子利用率为
您最近一年使用:0次
2020-11-10更新
|
112次组卷
|
2卷引用:湖南河北联考2021届2020-2021学年高三新高考10月质量检测化学试题
名校
3 . (1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)
①在反应体系中加入催化剂,反应速率______ ,该反应的反应热_______ (填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=_________ ,H2的转化率为______ (保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是________ 。
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(g)⇌4NH3(g)+3O2(g) ∆H=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
此合成反应的a_________ 0。(填“大于”、“小于”或“等于”)
①在反应体系中加入催化剂,反应速率
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=
③欲提高②容器中H2的转化率,下列措施可行的是
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(g)⇌4NH3(g)+3O2(g) ∆H=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a
您最近一年使用:0次
4 . 含氰根(CN−)的废水必须经处理后排放。某电镀废水pH≈12,氰化物以CN−、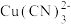 等形式存在(均以CN−计),处理流程如下:
等形式存在(均以CN−计),处理流程如下:

(1)HCN是一元弱酸,用离子方程式表示NaCN水溶液显碱性的原因:______ 。
(2)二次处理阶段,使用不同方法氧化。
①过硫酸钾(K2S2O8)氧化法:K2S2O8溶液将CN−(N为-3价)氧化成毒性弱的CNO−(N为-3价)。
Ⅰ.碱性溶液中 在一定条件下氧化CN−生成CNO−和
在一定条件下氧化CN−生成CNO−和 的离子方程式是
的离子方程式是______ 。
Ⅱ.不同浓度的K2S2O8溶液对CN−的去除率如图1。工业上选用浓度为1 mmol·L−1
K2S2O8溶液,不用0.75 mmol·L−1和2 mmol·L−1的原因是______ 。

Ⅲ.研究CN−的氧化去除机理。(文献中为碱性条件下的结论)
文献:a.没有Cu+, 对CN−没有去除效果。
对CN−没有去除效果。
b. 和Cu+反应生成硫酸根自由基(
和Cu+反应生成硫酸根自由基(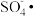 )和CuO。
)和CuO。
c.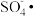 可能转变为羟基自由基(·OH)。
可能转变为羟基自由基(·OH)。
d.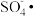 、·OH均可将CN−氧化为CNO−。叔丁醇只可以使·OH失
、·OH均可将CN−氧化为CNO−。叔丁醇只可以使·OH失
去活性,乙醇可以使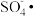 、·OH均失去活性。
、·OH均失去活性。
实验:相同条件下,向含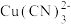 的碱性废水中加入叔丁醇,CN−的去除率没有影响;加入乙醇,CN−的去除率降低50%。两种不同的CN−的氧化去除机理如图2,结合
的碱性废水中加入叔丁醇,CN−的去除率没有影响;加入乙醇,CN−的去除率降低50%。两种不同的CN−的氧化去除机理如图2,结合文献 和实验 回答下列问题:
ⅰ.补全“机理一”_______________ 。
ⅱ.从“机理二”可看出CuO参与了去除CN−,列举其证据:______ 。
②电解法:碱性环境中,在阳极发生两步反应,CN−放电生成CNO−,CNO−再放电生成CO2和N2,第二步的阳极反应式是______ 。
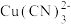 等形式存在(均以CN−计),处理流程如下:
等形式存在(均以CN−计),处理流程如下:
(1)HCN是一元弱酸,用离子方程式表示NaCN水溶液显碱性的原因:
(2)二次处理阶段,使用不同方法氧化。
①过硫酸钾(K2S2O8)氧化法:K2S2O8溶液将CN−(N为-3价)氧化成毒性弱的CNO−(N为-3价)。
Ⅰ.碱性溶液中
 在一定条件下氧化CN−生成CNO−和
在一定条件下氧化CN−生成CNO−和 的离子方程式是
的离子方程式是Ⅱ.不同浓度的K2S2O8溶液对CN−的去除率如图1。工业上选用浓度为1 mmol·L−1
K2S2O8溶液,不用0.75 mmol·L−1和2 mmol·L−1的原因是

Ⅲ.研究CN−的氧化去除机理。(文献中为碱性条件下的结论)
文献:a.没有Cu+,
 对CN−没有去除效果。
对CN−没有去除效果。b.
 和Cu+反应生成硫酸根自由基(
和Cu+反应生成硫酸根自由基(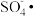 )和CuO。
)和CuO。 c.
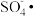 可能转变为羟基自由基(·OH)。
可能转变为羟基自由基(·OH)。d.
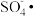 、·OH均可将CN−氧化为CNO−。叔丁醇只可以使·OH失
、·OH均可将CN−氧化为CNO−。叔丁醇只可以使·OH失去活性,乙醇可以使
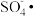 、·OH均失去活性。
、·OH均失去活性。实验:相同条件下,向含
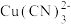 的碱性废水中加入叔丁醇,CN−的去除率没有影响;加入乙醇,CN−的去除率降低50%。两种不同的CN−的氧化去除机理如图2,结合
的碱性废水中加入叔丁醇,CN−的去除率没有影响;加入乙醇,CN−的去除率降低50%。两种不同的CN−的氧化去除机理如图2,结合ⅰ.补全“机理一”
ⅱ.从“机理二”可看出CuO参与了去除CN−,列举其证据:
②电解法:碱性环境中,在阳极发生两步反应,CN−放电生成CNO−,CNO−再放电生成CO2和N2,第二步的阳极反应式是
您最近一年使用:0次
2020-01-12更新
|
213次组卷
|
2卷引用:北京市西城区2020届高三上学期期末考试化学试题
名校
5 . 按要求回答下列问题
(1)某蓄电池的正负极标志难以辨别,请设计实验方案,将蓄电池的正负极辨别出来____________________ 。
(2)解释下列化学反应的反应速率变化关系曲线
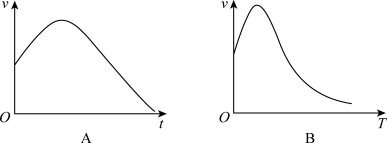
①将除去氧化膜的镁条投入盛有稀盐酸的试管中,产生氢气的速率随时间的变化关系如图A所示,试解释原因:_________________________________________________________ 。
②过氧化氢在酶的催化作用下的分解速率随温度的变化关系如图B所示,试解释原因:______________________ 。
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接_______________ 。
②改变开关连接方式,可得O2,电极反应式为___________________________ 。
③结合①和②中电极3的电极反应式,说明电极3的作用:______________________________ 。
(4)甲醇燃料电池DMFC可作电脑、汽车的能量来源。在实验室完成一个实验,用DMFC电解NaClO3溶液可制取NaClO4溶液,装置如图所示(其中DMFC以KOH作电解质)。

①写出电源负极电极反应式:______________________________ 。
②写出电解的总反应化学方程式:__________________________ 。
(1)某蓄电池的正负极标志难以辨别,请设计实验方案,将蓄电池的正负极辨别出来
(2)解释下列化学反应的反应速率变化关系曲线

①将除去氧化膜的镁条投入盛有稀盐酸的试管中,产生氢气的速率随时间的变化关系如图A所示,试解释原因:
②过氧化氢在酶的催化作用下的分解速率随温度的变化关系如图B所示,试解释原因:
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接
②改变开关连接方式,可得O2,电极反应式为
③结合①和②中电极3的电极反应式,说明电极3的作用:
(4)甲醇燃料电池DMFC可作电脑、汽车的能量来源。在实验室完成一个实验,用DMFC电解NaClO3溶液可制取NaClO4溶液,装置如图所示(其中DMFC以KOH作电解质)。

①写出电源负极电极反应式:
②写出电解的总反应化学方程式:
您最近一年使用:0次
2019-11-02更新
|
88次组卷
|
2卷引用:浙江省杭州市西湖高级中学2019-2020学年高二10月月考化学试题
13-14高一下·四川雅安·期中
名校
解题方法
6 . 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为_________________________________________ 。
(2)甲同学的实验目的是_____________ ;要得出正确的实验结论,还需控制的实验条件是____________ 。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
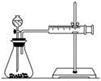
(3)乙同学在实验中应该测定的数据是___________________________________________________ 。
(4)乙同学完成该实验应选用的实验药品是________ ,该实验中不选用某浓度的硫酸,理由是___________ 。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________ 的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________ (填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为
(2)甲同学的实验目的是

(3)乙同学在实验中应该测定的数据是
(4)乙同学完成该实验应选用的实验药品是
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
您最近一年使用:0次
2016-12-09更新
|
1626次组卷
|
8卷引用:新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题
新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题(已下线)2013-2014四川省雅安中学下学期期中考试高一化学试卷(已下线)2013-2014重庆市重庆一中下学期期中考试高二化学试卷(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题
10-11高一下·辽宁·期中
名校
7 . 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
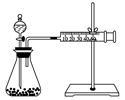
(1)该同学的实验目的是________________________ ;要得出正确的实验结论,还需控制的实验条件是________________________________________ 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是____________________________ ;应该测定的实验数据是________________________________________________________________________ 。
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________ 的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是________ 。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快 |

(1)该同学的实验目的是
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
您最近一年使用:0次
2016-12-09更新
|
1012次组卷
|
6卷引用:2012-2013学年新疆乌鲁木齐市一中高一(平行班)下学期期中考试化学试卷
(已下线)2012-2013学年新疆乌鲁木齐市一中高一(平行班)下学期期中考试化学试卷(已下线)2013届新疆乌鲁木齐市一中高一下学期平行班期中考试化学试卷(已下线)2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012年鲁科版高中化学选修6 2反应条件对化学反应的影响练习卷安徽省合肥市第十一中学2020-2021学年高二上学期第一次月考化学试题



