名校
1 . 用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定。单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1所示(KMnO4溶液已酸化):
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定。单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1所示(KMnO4溶液已酸化):

(1)该实验探究的是___________ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是①___________ ②(填“>”、“<”或“=”)。
(2)若实验①在2 min末收集了4.48 mLCO2(标准状况下),则在2 min末c(MnO )=
)=___________ mol•L-1(假设混合溶液体积为50 mL)
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定___________ 来比较化学反应速率。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、②___________ 。

 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定。单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1所示(KMnO4溶液已酸化):
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定。单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1所示(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL0.1 mol•L-1H2C2O4溶液 | 30 mL0.1 mol•L-1KMnO4溶液 |
| ② | 20 mL0.2 mol•L-1H2C2O4溶液 | 30 mL0.1 mol•L-1KMnO4溶液 |
(2)若实验①在2 min末收集了4.48 mLCO2(标准状况下),则在2 min末c(MnO
 )=
)=(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、②

您最近一年使用:0次
2021-10-12更新
|
98次组卷
|
3卷引用:四川省成都市蒲江县蒲江中学2020-2021学年高二上学期10月月考化学试题
名校
解题方法
2 . 实验一:已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计如下(所取溶液体积均为10mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________ 对化学反应速率的影响。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
请回答:
(2)表中V1=___________ ,V2=___________ 。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=________________________ 。
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________ 的影响。
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________ (填字母序号)。
A.硫酸钾B.硫酸锰C.氯化锰D.水
设计如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol·L-1) | c(H2SO4)/(mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/LKMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
| 3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
(2)表中V1=
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入
A.硫酸钾B.硫酸锰C.氯化锰D.水
您最近一年使用:0次
2020-11-26更新
|
304次组卷
|
5卷引用:福建省漳州市平和县第一中学2020-2021学年高二上学期期中考试化学试题
3 . KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02mol·L-1、0.002mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol·L-1、4mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL。
(1)已知:①H2C2O4电离常数,Ka1=5.9×10-2,Ka2=6.4×10-5。
②与KMnO4反应时,H2C2O4转化为CO2和H2O。
写出草酸与酸性高锰酸钾溶液反应的离子方程式___ 。
(2)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成___ 组实验进行对比即可得出结论。
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
①用0.002mol·L-1KMnO4酸性溶液进行实验时,KMnO4的平均反应速率___ (忽略混合前后溶液体积变化)。
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
则表中a=___ ;b=___ ;c=___ 。
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应初始时变化不大一段时间后快速增大的原因:___ 。

①所用KMnO4酸性溶液的浓度可选择:0.02mol·L-1、0.002mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol·L-1、4mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL。
(1)已知:①H2C2O4电离常数,Ka1=5.9×10-2,Ka2=6.4×10-5。
②与KMnO4反应时,H2C2O4转化为CO2和H2O。
写出草酸与酸性高锰酸钾溶液反应的离子方程式
(2)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应初始时变化不大一段时间后快速增大的原因:

您最近一年使用:0次
名校
4 . 某实验小组对 分解速率的影响因素做了如下探究:
分解速率的影响因素做了如下探究:
Ⅰ 甲同学依据实验①和实验②所得数据进行处理得图1曲线;乙同学依据实验③和实验④所得数据进行处理得图2曲线。
甲同学依据实验①和实验②所得数据进行处理得图1曲线;乙同学依据实验③和实验④所得数据进行处理得图2曲线。
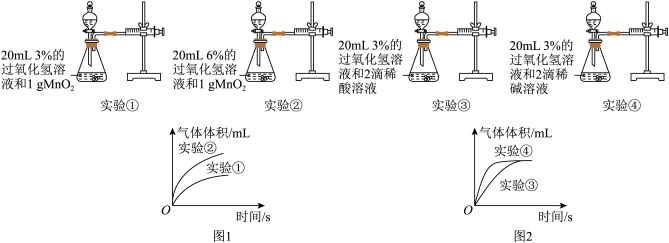
(1)由图1可知:该因素对过氧化氢分解速率的影响是_________ 。
(2)分析图2,可得出的结论是_________ 。
Ⅱ 丙同学设计了几组实验,探究
丙同学设计了几组实验,探究 影响分解速率的其他因素,记录数据如表。已知表中“时间
影响分解速率的其他因素,记录数据如表。已知表中“时间 ”表示用
”表示用 制取
制取 常温常压下
常温常压下 所需的时间
所需的时间
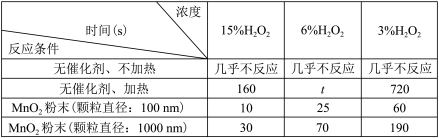
(3)推测时间t的范围为___________ 。
(4)写出上述实验中发生反应的化学方程式:_____________ 。
(5)实验结果表明,催化剂的催化效果与__________ 有关。
 分解速率的影响因素做了如下探究:
分解速率的影响因素做了如下探究:Ⅰ
 甲同学依据实验①和实验②所得数据进行处理得图1曲线;乙同学依据实验③和实验④所得数据进行处理得图2曲线。
甲同学依据实验①和实验②所得数据进行处理得图1曲线;乙同学依据实验③和实验④所得数据进行处理得图2曲线。
(1)由图1可知:该因素对过氧化氢分解速率的影响是
(2)分析图2,可得出的结论是
Ⅱ
 丙同学设计了几组实验,探究
丙同学设计了几组实验,探究 影响分解速率的其他因素,记录数据如表。已知表中“时间
影响分解速率的其他因素,记录数据如表。已知表中“时间 ”表示用
”表示用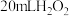 制取
制取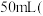 常温常压下
常温常压下 所需的时间
所需的时间
(3)推测时间t的范围为
(4)写出上述实验中发生反应的化学方程式:
(5)实验结果表明,催化剂的催化效果与
您最近一年使用:0次
11-12高二·安徽安庆·阶段练习
名校
解题方法
5 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________ 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_____________________ 。
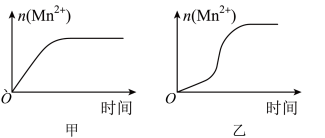
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。______________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_____________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液 颜色褪至无色 所需时间/min | |||
| 0.6 mol · L-1 H2C2O4溶液 | H2O | 0.2 mol · L-1 KMnO4溶液 | 3 mol · L-1 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2020-10-12更新
|
154次组卷
|
11卷引用:2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷
(已下线)2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时1 化学反应的速率山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题安徽省黄山市屯溪第一中学、中科大附中2020-2021学年高一下学期期中联考化学试题黑龙江省哈尔滨市宾县一中2020-2021学年高一下学期第二次月考化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)福建省福州重点中学2022-2023学年高一下学期期中考试化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一下学期第一次月考化学试题B卷
名校
解题方法
6 . 为比较Fe3+和Cu2+对H2O2分解的催化效果,某体学研究小组的同学分别设计了图甲、乙所示的实验。请回答相关问题:

(1)定性比较:图甲可通过观察_____ ,定性比较得出结论。有同学提出将CuSO4改为CuCl2更合理一些,其理由是______ 。
(2)定量比较:如图乙所示,实验时均以生成40 mL气体为标准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是________ ,实验中需要测量的数据是_______ 。
(3)将0.10 mol MnO2粉末加入到50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

①写出H2O2在MnO2作用下发生反应的化学方程式:_______ 。
②H2O2的初始物质的量浓度为________ 。(保留两位有效数字)

(1)定性比较:图甲可通过观察
(2)定量比较:如图乙所示,实验时均以生成40 mL气体为标准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是
(3)将0.10 mol MnO2粉末加入到50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

①写出H2O2在MnO2作用下发生反应的化学方程式:
②H2O2的初始物质的量浓度为
您最近一年使用:0次
2020-07-03更新
|
208次组卷
|
2卷引用:安徽省安庆市怀宁县第二中学2019-2020学年高二下学期期中线上检测化学试题
名校
解题方法
7 . I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如下图甲、乙所示的实验装置。请回答相关问题:
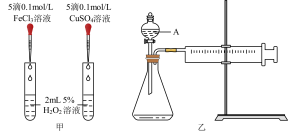
(1)定性分析:甲所示装置可通过观察_________ ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________ 。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______ ,实验中需要测量的数据是________ 。
II.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
(3)通过实验①和②对比可知,化学反应速率与_____ 有关;从实验③和④对比可知,化学反应速率与温度的关系是_____ 。

(1)定性分析:甲所示装置可通过观察
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为
II.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
| 实验 序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2用量/g | 收集O2的体积/mL | 反应所需时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
您最近一年使用:0次
名校
解题方法
8 . (1)0.92g甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量。该反应的热化学方程式为__________ 。
(2)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。
已知:①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1,
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1,
结合上述热化学方程式,计算得出△H1=_______ 。
(3)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是___________ 反应(填“吸热”、“放热”)。
②在反应体系中加入催化剂,化学反应速率增大, E1、E2和ΔH的变化是:E1________ ,E2_______ ,ΔH _______ (填“增大”、“减小”或“不变”)
③当反应达到平衡时,其他条件不变,升高温度,A的转化率______ (填“增大”、“减小”或“不变”)。
(2)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。
已知:①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1,
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1,
结合上述热化学方程式,计算得出△H1=
(3)反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
①该反应是
②在反应体系中加入催化剂,化学反应速率增大, E1、E2和ΔH的变化是:E1
③当反应达到平衡时,其他条件不变,升高温度,A的转化率
您最近一年使用:0次
名校
9 . 某小组利用H2C2O4 溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
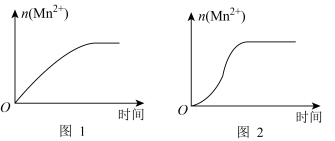
(1)根据上表中的实验数据,可以得到的结论是_______ 。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是_______ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
固体X是_______ 。
③若该小组同学提出的假设成立,时间t_______ 4.0min(填>、=或<)。
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计_______ 。
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 2.0 | 1.0 | 6.4 |

(1)根据上表中的实验数据,可以得到的结论是
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜 色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
③若该小组同学提出的假设成立,时间t
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计
您最近一年使用:0次
2019-11-18更新
|
147次组卷
|
3卷引用:安徽省铜陵市第一中学2019-2020学年高二上学期期中考试化学试题
名校
解题方法
10 . 研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
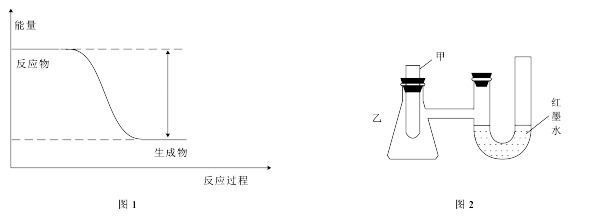
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为__________ (填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________ 。
③若要使该反应的反应速率加快,下列措施可行的是__________ (填字母)。
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
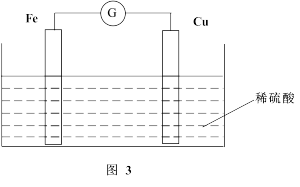
①铜为__________ (填“正”或“负”)极;负极的电极反应式为______ 。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________ L。

(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是
③若要使该反应的反应速率加快,下列措施可行的是
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。

①铜为
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是
您最近一年使用:0次
2019-10-12更新
|
197次组卷
|
5卷引用:福建省永安市第三中学2019-2020学年高二10月月考化学试题



