(1)CH4—CO催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C≡O |
| 键能/kJ•mol-1 | 413 | 745 | 436 | 1075 |
(2)对于反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得不同温度下CH3OH生成量随时间变化关系如图1。曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ
CH3OH(g)+H2O(g),测得不同温度下CH3OH生成量随时间变化关系如图1。曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ
(3)TiO2/Cu2Al2O4催化CO2和CH4可生成乙酸。在不同温度下催化效率与乙酸生成速率关系如图2。250℃~300℃时,升高温度反应速率降低的原因是


(4)最新报道中国科学家首次用CO2高效合成乙酸,其反应路径如图3所示,该反应路径中第1步反应方程式为
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO

Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=
Ⅲ.CO还原法。
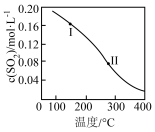
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)
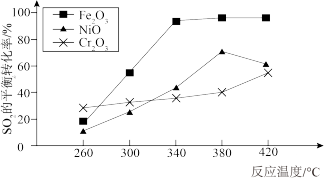
(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择
(1)CO2甲烷化反应是由法国化学家PaulSabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图1:

①上述过程中,加入铁粉的作用是
②HCOOH是CO2转化为CH4的中间体:CO2
 HCOOH
HCOOH CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是(2)一定条件下,Pd-Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为

(3)CO2和CH4是两种重要的温室气体,通过化学反应可以将它们转化为其他物质。以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示,250~300℃时,温度升高而乙酸的生成速率降低的原因是
②为了提高该反应中CH4的转化率,可以采取的措施是

 +6H+→2Mn2++10CO2↑+8H2O
+6H+→2Mn2++10CO2↑+8H2O甲同学用8.00mL0.001 mol•L-1 KMnO4 溶液与 5.00mL 0.01 mol•L-1 H2C2O4 溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
| 序号 | KMnO4/mL | H2C2O4/mL | 10%H2SO4/mL | 温度/℃ | 其他物质 |
| 1 | 8.00 | 5.00 | 3.00 | 20 | |
| 2 | 8.00 | 5.00 | 3.00 | 30 | |
| 3 | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL蒸馏水 |
(l)对比实验l和3,主要探究
(2)甲同学在研究反应的影响因素时发现, 草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显, 但不久后突然褪色, 反应速率明显加快.甲同学认为除了反应放热,导致溶液温度升高,还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
(3)乙同学为了测定某高锰酸钾产品的质量分数,取0.500g的高锰酸钾产品,配成50.00 mL溶液,取出 10.00 mL, 用 0.100 mol•L-1草酸标准溶液滴定至终点,消耗草酸标准溶液15.00 mL。计算该样品中高锰酸钾的质量分数(写出计算过程)。
| MnO2 | 触摸试管 | 现象 | 反应时间/min |
| 粉末 | 发烫 | 反应剧烈,带火星的木条迅速复燃 | t1 |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | t2 |
(2)实验结果证明了催化剂的催化效果与
(3)表中t1
(4)控制该反应速率,除了改变催化剂因素,可行的方法还有
(5)某同学用一定浓度的H2O2溶液10mL,加入适量MnO2在某温度下反应,测量放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是

6 . CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。

(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为
(2) HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。

①电池负极电极反应式为
②图-2所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为
(3) HCOOH催化释氢。在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如图-3所示。

①HCOOD催化释氢反应除生成CO2外,还生成
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是
(1)已知: H2(g)+
 O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+
O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+  O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=
O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=(2)工业生产中可利用H2还原CO2制备清洁能源甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0 ①保持温度、体积一定,能说明上述反应达到平衡状态的是
A.容器内压强不变 B.3v正 (CH3OH)= v正 (H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变

②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图所示,催化效果最好的是催化剂

(3)固体氧化物电解池(SOEC)可用于高温电解CO2/H2O,既可高效制备合成气(CO和H2),又可实现CO2的减排,其工作原理如图。
①电源正极为
②阴阳两极生成的气体的物质的量之比为
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色 褪至无色所需时间/min | |||
 | H2O | 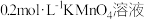 | 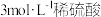 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)以上反应的化学方程式:
(2)根据上表中的实验数据,可以得到的结论是:
(3)利用实验1中数据计算,用KMnO4的浓度变化表示反应速率v(KMnO4)=

(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①小组同学提出的假设是
②请你帮助该小组同学完成实验方案
Ⅰ. 某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液+1 mL H2O | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+1 mL HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+1 mL NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
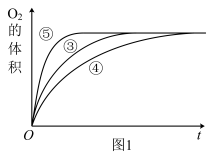
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图1所示。分析该图能够得出的实验结论是
Ⅱ. MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将状态不同的0.1 g MnO2分别加入盛有50 mL等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2状态 | 触摸试管情况 | 观察结果 | 反应完成所需时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 4 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(2)实验结果表明,催化剂的催化效果与
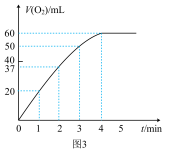
(3)实验过程中放出气体的体积(标准状况)和时间的关系如图3所示。解释反应速率变化的原因:
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水



