解题方法
1 . 合成氨工业对国民经济和社会发展有重要的意义。
(1)合成氨工业中常以天然气与水蒸气为原料制取H2:CH4(g) + H2O(g)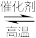 CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
则CH4(g) + H2O(g) CO(g) + 3H2(g) △H=
CO(g) + 3H2(g) △H=________ kJ·mol−1。
(2)某科技小组在实验室中模拟合成氨反应,在430℃、20KPa时,将一定量的N2、 H2置于2L的恒容密闭容器中发生反应,N2(g) + 3H2(g) 2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
①前10min内的H2的平均反应速率为_______ mol/(L·min)
②反应进行到10min 时,曲线发生变化的原因可能是____
A.加入N2 B.减小容器容积
C.加入催化剂 D.降低温度
③反应进行到25min时,曲线发生变化的原因是__________ ,再次达平衡时,平衡常数______ (填“增大”“减小”或“不变”)。
(3)工业上还利用天然和水蒸气反应的产物合成甲醇:CO(g) + 2H2(g) CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:

①p1_____ p2 (填“>”、“<“或“=”,下同)
②比较该反应在A、B两点的平衡常数大小:K(A)_______ K(B)。
(1)合成氨工业中常以天然气与水蒸气为原料制取H2:CH4(g) + H2O(g)
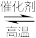 CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,| 化学键 | C−H | H−H |  (CO) (CO) | H−O |
| 键能(kJ·mol−1) | 413 | 436 | 1075 | 465 |
 CO(g) + 3H2(g) △H=
CO(g) + 3H2(g) △H=(2)某科技小组在实验室中模拟合成氨反应,在430℃、20KPa时,将一定量的N2、 H2置于2L的恒容密闭容器中发生反应,N2(g) + 3H2(g)
 2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
①前10min内的H2的平均反应速率为
②反应进行到10min 时,曲线发生变化的原因可能是
A.加入N2 B.减小容器容积
C.加入催化剂 D.降低温度
③反应进行到25min时,曲线发生变化的原因是
(3)工业上还利用天然和水蒸气反应的产物合成甲醇:CO(g) + 2H2(g)
 CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
①p1
②比较该反应在A、B两点的平衡常数大小:K(A)
您最近一年使用:0次
名校
解题方法
2 . 实验一:已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计如下(所取溶液体积均为10mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________ 对化学反应速率的影响。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
请回答:
(2)表中V1=___________ ,V2=___________ 。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=________________________ 。
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________ 的影响。
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________ (填字母序号)。
A.硫酸钾B.硫酸锰C.氯化锰D.水
设计如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol·L-1) | c(H2SO4)/(mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/LKMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
| 3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
(2)表中V1=
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入
A.硫酸钾B.硫酸锰C.氯化锰D.水
您最近一年使用:0次
2020-11-26更新
|
305次组卷
|
5卷引用:福建省漳州市平和县第一中学2020-2021学年高二上学期期中考试化学试题
3 . 研究硫元素及其化合物的性质具有重要意义。
I.已知I-可以催化二氧化硫在水溶液中发生歧化反应:3SO2(g) +2H2O(l)=2H2SO4(aq) +S(s) △H<0。催化原理分为两步,第一步反应为吸热的慢反应:SO2+4I- +4H+ =2H2O+ S↓ +2I2,第二步反应为放热的快反应:2H2O + I2 + = + + 2I-。
(1)请补充第二步反应________ 。
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为____ 。

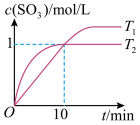
II.工业制硫酸,在接触室发生反应2SO2(g) +O2(g) 2SO3(g)。在1L的恒容密闭容器中充人2 mol SO2和1 mol O2,在不同温度下测得c(SO3)与时间的关系如下图所示:
2SO3(g)。在1L的恒容密闭容器中充人2 mol SO2和1 mol O2,在不同温度下测得c(SO3)与时间的关系如下图所示:
(3)能证明反应已经达到平衡状态的是_____ 。
①c(SO2):c(O2):c(SO3) =2:1 :2
②单位时间内生成n mol SO3的同时消耗n mol SO2
③反应速率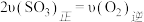
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4) 反应开始到10 min时SO2的平均反应速率 (SO2)=
(SO2)= ____ mol/(L•min)。T2时反应SO3(g) SO2(g)+
SO2(g)+ O2(g)的平衡常数 K =
O2(g)的平衡常数 K =_______ 。
I.已知I-可以催化二氧化硫在水溶液中发生歧化反应:3SO2(g) +2H2O(l)=2H2SO4(aq) +S(s) △H<0。催化原理分为两步,第一步反应为吸热的慢反应:SO2+4I- +4H+ =2H2O+ S↓ +2I2,第二步反应为放热的快反应:2H2O + I2 + = + + 2I-。
(1)请补充第二步反应
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为

II.工业制硫酸,在接触室发生反应2SO2(g) +O2(g)
 2SO3(g)。在1L的恒容密闭容器中充人2 mol SO2和1 mol O2,在不同温度下测得c(SO3)与时间的关系如下图所示:
2SO3(g)。在1L的恒容密闭容器中充人2 mol SO2和1 mol O2,在不同温度下测得c(SO3)与时间的关系如下图所示:
(3)能证明反应已经达到平衡状态的是
①c(SO2):c(O2):c(SO3) =2:1 :2
②单位时间内生成n mol SO3的同时消耗n mol SO2
③反应速率
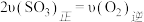
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4) 反应开始到10 min时SO2的平均反应速率
 (SO2)=
(SO2)=  SO2(g)+
SO2(g)+ O2(g)的平衡常数 K =
O2(g)的平衡常数 K =
您最近一年使用:0次
11-12高二·安徽安庆·阶段练习
名校
解题方法
4 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________ 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_____________________ 。
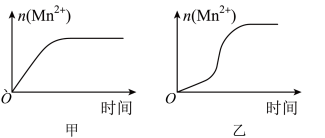
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。______________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_____________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液 颜色褪至无色 所需时间/min | |||
| 0.6 mol · L-1 H2C2O4溶液 | H2O | 0.2 mol · L-1 KMnO4溶液 | 3 mol · L-1 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2020-10-12更新
|
155次组卷
|
11卷引用:河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题
河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题(已下线)2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时1 化学反应的速率山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一下学期第一次月考化学试题B卷安徽省黄山市屯溪第一中学、中科大附中2020-2021学年高一下学期期中联考化学试题黑龙江省哈尔滨市宾县一中2020-2021学年高一下学期第二次月考化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)福建省福州重点中学2022-2023学年高一下学期期中考试化学试题
解题方法
5 . 碳、氮能形成多种氧化物、氢化物。
(1)已知:①
②
则 与
与 反应生成两种无毒气体的热化学方程式为
反应生成两种无毒气体的热化学方程式为_____________ 。
(2)使用高效催化剂可大大减少汽车尾气排放出的 含量,某研究所的科研人员探究了
含量,某研究所的科研人员探究了 时等质量的三种催化剂对
时等质量的三种催化剂对 还原
还原 的催化效果(其他条件相同),所得结果如图所示:
的催化效果(其他条件相同),所得结果如图所示:

①如果不考虑催化剂价格,则使用催化剂______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成 的速率大小关系是
的速率大小关系是___________ 。
②若容器容积为2L,开始时加入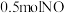 、
、 ,在催化剂Ⅰ的作用下达到如图所示平衡,则反应
,在催化剂Ⅰ的作用下达到如图所示平衡,则反应 在该温度下的平衡常数
在该温度下的平衡常数
______  。
。
③在如图坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率( 转化率)与温度的关系图
转化率)与温度的关系图___________ 。

(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应: ,其速率方程式为
,其速率方程式为 (k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应 ,在温度低于
,在温度低于 时是由两个基元反应构成的复杂反应,该反应的速率方程式为
时是由两个基元反应构成的复杂反应,该反应的速率方程式为 ,则其两个基元反应分别为:Ⅰ.
,则其两个基元反应分别为:Ⅰ.______ 
______ ;Ⅱ.略,这两个反应中活化能较小的是__________ 。
②某科研小组测得 时该反应的
时该反应的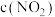 、
、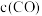 生成
生成 的速率
的速率 的关系如下:
的关系如下:
则该温度下的反应速率常数
______ 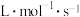 。
。
(1)已知:①

②

则
 与
与 反应生成两种无毒气体的热化学方程式为
反应生成两种无毒气体的热化学方程式为(2)使用高效催化剂可大大减少汽车尾气排放出的
 含量,某研究所的科研人员探究了
含量,某研究所的科研人员探究了 时等质量的三种催化剂对
时等质量的三种催化剂对 还原
还原 的催化效果(其他条件相同),所得结果如图所示:
的催化效果(其他条件相同),所得结果如图所示:
①如果不考虑催化剂价格,则使用催化剂
 的速率大小关系是
的速率大小关系是②若容器容积为2L,开始时加入
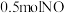 、
、 ,在催化剂Ⅰ的作用下达到如图所示平衡,则反应
,在催化剂Ⅰ的作用下达到如图所示平衡,则反应 在该温度下的平衡常数
在该温度下的平衡常数
 。
。③在如图坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率(
 转化率)与温度的关系图
转化率)与温度的关系图
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:
 ,其速率方程式为
,其速率方程式为 (k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。①已知反应
 ,在温度低于
,在温度低于 时是由两个基元反应构成的复杂反应,该反应的速率方程式为
时是由两个基元反应构成的复杂反应,该反应的速率方程式为 ,则其两个基元反应分别为:Ⅰ.
,则其两个基元反应分别为:Ⅰ.
②某科研小组测得
 时该反应的
时该反应的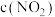 、
、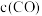 生成
生成 的速率
的速率 的关系如下:
的关系如下: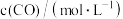 | 0.025 | 0.05 | 0.025 |
 | 0.04 | 0.04 | 0.12 |
 | 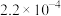 |  |  |

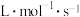 。
。
您最近一年使用:0次
解题方法
6 . 催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
Ⅰ.(1)催化剂的选择性指在能发生多种反应的反应系统中,同一催化剂促进不同反应的程度的比较,实质上是反应系统中目的反应与副反应之间反应速度竞争的表现。如图所示为一定条件下 与
与 发生反应时,生成
发生反应时,生成 、
、 或
或 的能量变化图[反应物
的能量变化图[反应物 和生成物
和生成物 略去]。在有催化剂作用下,
略去]。在有催化剂作用下, 与
与 反应主要生成
反应主要生成____ (选填“ 或
或 或
或 ”)。
”)。

(2)2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家哈德·埃特尔,他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。埃特尔研究的氮气和氢气分子在固体催化剂表面发生的部分变化过程如图所示:

①下列说法不正确 的是_________ 。
A.升高温度可以提高一段时间内 的生产效率
的生产效率
B.图示中的②→③以及后面几个过程均是放热过程
C.此图示中存在 键断裂和
键断裂和 键断裂,以及
键断裂,以及 键的形成过程
键的形成过程
②合成氨工业中,原料气( 、
、 及少量
及少量 、
、 的混合气)在进入合成塔前常用
的混合气)在进入合成塔前常用 (醋酸二氨合亚铜,
(醋酸二氨合亚铜,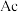 代表醋酸根)溶液来吸收原料气中的
代表醋酸根)溶液来吸收原料气中的 ,其反应是:
,其反应是: ,生产中必须除去原料气中
,生产中必须除去原料气中 的原因是
的原因是_________ ; 溶液吸收原料气中的
溶液吸收原料气中的 的生产适宜条件应是
的生产适宜条件应是____________ 。
Ⅱ.氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,存在较多蓝、绿藻类的酸性水体中存在如有图所示的氮循环,请回答相关问题。

(3) 硝化过程的方程式是
硝化过程的方程式是 ,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是
,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____ (填标号)。
A.溶液的 不再改变
不再改变
B. 的消耗速率和
的消耗速率和 的生成速率相等
的生成速率相等
C.溶液中 、
、 、
、 的总物质的量保持不变
的总物质的量保持不变
实验测得在其它条件一定时, 硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是
硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是__________________ 。

(4)亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,因此要对亚硝酸盐含量过高的废水进行处理。处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是 。在25℃和35℃下,分别向
。在25℃和35℃下,分别向 初始浓度为
初始浓度为 的溶液中按不同的投料比
的溶液中按不同的投料比 加入次氯酸钠固体(忽略溶液体积的变化),平衡时
加入次氯酸钠固体(忽略溶液体积的变化),平衡时 的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点
的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点 的转化率由小到大的顺序是
的转化率由小到大的顺序是______ ,35℃时该反应的平衡常数
______ (保留三位有效数字)。
Ⅰ.(1)催化剂的选择性指在能发生多种反应的反应系统中,同一催化剂促进不同反应的程度的比较,实质上是反应系统中目的反应与副反应之间反应速度竞争的表现。如图所示为一定条件下
 与
与 发生反应时,生成
发生反应时,生成 、
、 或
或 的能量变化图[反应物
的能量变化图[反应物 和生成物
和生成物 略去]。在有催化剂作用下,
略去]。在有催化剂作用下, 与
与 反应主要生成
反应主要生成 或
或 或
或 ”)。
”)。
(2)2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家哈德·埃特尔,他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。埃特尔研究的氮气和氢气分子在固体催化剂表面发生的部分变化过程如图所示:

①下列说法
A.升高温度可以提高一段时间内
 的生产效率
的生产效率B.图示中的②→③以及后面几个过程均是放热过程
C.此图示中存在
 键断裂和
键断裂和 键断裂,以及
键断裂,以及 键的形成过程
键的形成过程②合成氨工业中,原料气(
 、
、 及少量
及少量 、
、 的混合气)在进入合成塔前常用
的混合气)在进入合成塔前常用 (醋酸二氨合亚铜,
(醋酸二氨合亚铜,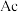 代表醋酸根)溶液来吸收原料气中的
代表醋酸根)溶液来吸收原料气中的 ,其反应是:
,其反应是: ,生产中必须除去原料气中
,生产中必须除去原料气中 的原因是
的原因是 溶液吸收原料气中的
溶液吸收原料气中的 的生产适宜条件应是
的生产适宜条件应是Ⅱ.氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,存在较多蓝、绿藻类的酸性水体中存在如有图所示的氮循环,请回答相关问题。

(3)
 硝化过程的方程式是
硝化过程的方程式是 ,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是
,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是A.溶液的
 不再改变
不再改变B.
 的消耗速率和
的消耗速率和 的生成速率相等
的生成速率相等C.溶液中
 、
、 、
、 的总物质的量保持不变
的总物质的量保持不变实验测得在其它条件一定时,
 硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是
硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是
(4)亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,因此要对亚硝酸盐含量过高的废水进行处理。处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是
 。在25℃和35℃下,分别向
。在25℃和35℃下,分别向 初始浓度为
初始浓度为 的溶液中按不同的投料比
的溶液中按不同的投料比 加入次氯酸钠固体(忽略溶液体积的变化),平衡时
加入次氯酸钠固体(忽略溶液体积的变化),平衡时 的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点
的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点 的转化率由小到大的顺序是
的转化率由小到大的顺序是
您最近一年使用:0次
7 . 乙醛(CH3CHO)是有机合成中的二碳试剂,是合成乙酸、乙醇、乙酸乙酯、农药DDT等的原料。回答下列问题:
(1)Andrea Dasic 等提出在金属催化剂M作用下以N2O为氧化剂可以氧化乙烯生成乙醛。催化体系氧化还原循环如图所示。(物质与氧原子的结合力用OA表示)
氧原子与N生成NO的结合力OA(N)= 167.4kJ·mol-1,氧原子与乙烯生成乙醛的结合力OA(C2 H4)=473 kJ∙mol-1,则可用作该反应催化剂的金属M与氧原子的结合力OA(M)的值应满足:_______ ,使用催化剂会使该反应的活化能____ (填“增大”或“减小”)。
(2)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ∙mol-1、890.31 kJ· mol-1、1167.9 kJ∙mol-1,则乙醛的分解反应CH3CHO(l) CH4(g)+CO(g)的 ∆H =
CH4(g)+CO(g)的 ∆H =________ 。
(3)已知:在含有少量I2的溶液中,反应CH3CHO(aq) CH4 (g)+CO(g)分两步进行:
CH4 (g)+CO(g)分两步进行:
第I步反应为CH3CHO(aq) +I2(aq)→CH3I(l) + HI(aq) +CO(g)(慢反应),第II步为快反应。
①请写出第II步反应的化学方程式:__________ 。
②增大I2的浓度______ (填“能"或“不能")明显增大总反应的平均速率,理由为_________ 。
(4)乙醛可以与饱和的NaHSO3溶液发生反应生成水溶性的 -羟基磺酸钠:CH3CHO+ NaHSO3
-羟基磺酸钠:CH3CHO+ NaHSO3 CH3CH(OH)SO3Na(
CH3CH(OH)SO3Na( -羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将
-羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将___ (填“ 正向”“逆向”或“不")移动。
(5)在100~120 °C、PdCl2 – CuCl2催化剂存在下,乙烯可以与O2反应生成乙醛: 2CH2=CH2(g) +O2(g)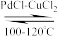 2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为
2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为____ (结果保留3位有效数字),T °C时该反应的平衡常数K为________ 。
(1)Andrea Dasic 等提出在金属催化剂M作用下以N2O为氧化剂可以氧化乙烯生成乙醛。催化体系氧化还原循环如图所示。(物质与氧原子的结合力用OA表示)
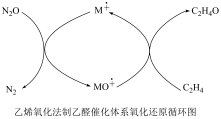
氧原子与N生成NO的结合力OA(N)= 167.4kJ·mol-1,氧原子与乙烯生成乙醛的结合力OA(C2 H4)=473 kJ∙mol-1,则可用作该反应催化剂的金属M与氧原子的结合力OA(M)的值应满足:
(2)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ∙mol-1、890.31 kJ· mol-1、1167.9 kJ∙mol-1,则乙醛的分解反应CH3CHO(l)
 CH4(g)+CO(g)的 ∆H =
CH4(g)+CO(g)的 ∆H =(3)已知:在含有少量I2的溶液中,反应CH3CHO(aq)
 CH4 (g)+CO(g)分两步进行:
CH4 (g)+CO(g)分两步进行:第I步反应为CH3CHO(aq) +I2(aq)→CH3I(l) + HI(aq) +CO(g)(慢反应),第II步为快反应。
①请写出第II步反应的化学方程式:
②增大I2的浓度
(4)乙醛可以与饱和的NaHSO3溶液发生反应生成水溶性的
 -羟基磺酸钠:CH3CHO+ NaHSO3
-羟基磺酸钠:CH3CHO+ NaHSO3 CH3CH(OH)SO3Na(
CH3CH(OH)SO3Na( -羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将
-羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将(5)在100~120 °C、PdCl2 – CuCl2催化剂存在下,乙烯可以与O2反应生成乙醛: 2CH2=CH2(g) +O2(g)
 2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为
2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为
您最近一年使用:0次
名校
解题方法
8 . 氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是_______ (填标号)。
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为____________ 。
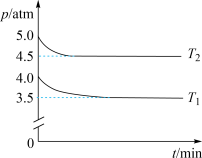
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g) 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是____________ (填标号)。
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1________ T2(填“>”或“<”)。该反应的ΔH______ 0(填“>”或“<”),判断的依据是_________ 。
③T2时,HCl的平衡转化率=________ ,反应的Kx=_____ (Kx为以物质的量分数表示的平衡常数)。
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g)
 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1
③T2时,HCl的平衡转化率=
您最近一年使用:0次
名校
9 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________ ,T1=_______ ;通过实验___________ 可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1______ (填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________ 。(用含有t1的式子表示)
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________ 。
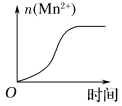
| 实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=
(2)C组实验中溶液褪色时间t1
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:

您最近一年使用:0次
2019-06-06更新
|
809次组卷
|
7卷引用:湖南省张家界市慈利县2018-2019学年高一第二学期期中检测化学试题
名校
解题方法
10 . CuSO4溶液对过氧化氢的分解反应具有催化作用。有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下探究。
(1)请你帮助他们完成实验报告:
(2)已知FeCl3在水中可电离出Fe3+和Cl-,同学们提出以下猜想。
甲同学的猜想:真正催化H2O2分解的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Cl-。
你认为最不可能的是_______ 同学的猜想,理由是________ 。
(3)同学们对余下的两个猜想用实验进行了探究。请你仔细分析后完成下表:
(1)请你帮助他们完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管 | FeCl3溶液可以催化H2O2分解 |
(2)已知FeCl3在水中可电离出Fe3+和Cl-,同学们提出以下猜想。
甲同学的猜想:真正催化H2O2分解的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Cl-。
你认为最不可能的是
(3)同学们对余下的两个猜想用实验进行了探究。请你仔细分析后完成下表:
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有5 mL 5%的H2O2溶液的试管中加入少量的盐酸,并把带火星的木条伸入试管 | 无明显现象 | |
| 向盛有5 mL 5%的H2O2溶液的试管中加入少量的 |
您最近一年使用:0次
2019-05-20更新
|
193次组卷
|
4卷引用:2014-2015内蒙古满洲里市七中高二上学期第二次月考化学试卷



