解题方法
1 . H2O2能缓慢分解生成水和氧气,但分解速率较慢,加入催化剂会加快分解速率。某化学兴趣小组为研究不同催化剂对H2O2分解反应的催化效果,设计了如图甲、乙、丙所示的三组实验。


请回答有关问题:
(1)定性分析:可以通过观察甲装置__________ 现象,而定性得出结论。有同学指出:应将实验中将FeCl3溶液改为Fe2(SO4)3溶液,理由是_______________ 。
(2)定量测定:用乙装置做对照试验,仪器A的名称是___________ 。实验时组装好装置乙,关闭A的旋塞,将注射器活塞向外拉出一段。这一操作的实验目的是____________ 。实验时以2min时间为准,需要测量的数据是________ 。(其它可能影响实验的因素均已忽略)
(3)定量分析:利用丙装置探究MnO2对H2O2分解的催化效果。将30mL5%H2O2溶液一次性加入盛有0.10molMnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)]与时间(t/min)的关系如图所示。图中b点___________ 90mL(填“大于”、“小于”或“等于”)。
(4)补充实验:该小组补充进行了如下对比实验,实验药品及其用量如下表所示。实验设计的目的是为了探究_________________________ 。


请回答有关问题:
(1)定性分析:可以通过观察甲装置
(2)定量测定:用乙装置做对照试验,仪器A的名称是
(3)定量分析:利用丙装置探究MnO2对H2O2分解的催化效果。将30mL5%H2O2溶液一次性加入盛有0.10molMnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)]与时间(t/min)的关系如图所示。图中b点
(4)补充实验:该小组补充进行了如下对比实验,实验药品及其用量如下表所示。实验设计的目的是为了探究
| 编号 | 反应物 | 催化剂 |
① | 30mL5%H2O2溶液,10滴H2O | 0.10molMnO2 |
② | 30mL5%H2O2溶液,10滴0.1mol/LHCl溶液 | 0.10molMnO2 |
③ | 30mL5%H2O2溶液,10滴0.1mol/LNaOH溶液 | 0.10molMnO2 |
您最近一年使用:0次
名校
解题方法
2 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4==2MnSO4+10CO2↑+8H2O+K2SO4
【实验内容及记录】
请回答:
(1)请完成上述实验设计表:V1=_________ ,V2=__________ 。
(2)根据上表中的实验数据,可以得到的结论是_________________________________ 。
(3)利用实验1中数据计算,反应速率为v(KMnO4)=_________________________ 。
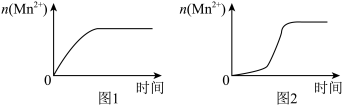
(4)该小组同学依据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。____________________________________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_______________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4==2MnSO4+10CO2↑+8H2O+K2SO4
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液褪色至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.1 mol/L KMnO4溶液 | 3 mol/L H2SO4溶液 | ||
| 1 | 3.0 | 13.0 | 2.0 | 2.0 | 8.0 |
| 2 | 2.0 | 14.0 | 2.0 | 2.0 | 10.4 |
| 3 | 1.0 | V1 | V2 | 2.0 | 12.8 |
(1)请完成上述实验设计表:V1=
(2)根据上表中的实验数据,可以得到的结论是
(3)利用实验1中数据计算,反应速率为v(KMnO4)=
(4)该小组同学依据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量 | 室温下溶液褪色至无色所需时间/min | ||||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.1 mol/L KMnO4溶液 | 3 mol/L H2SO4溶液 | 少量 | ||
| 4 | 3.0mL | 13.0mL | 2.0mL | 2.0mL | t | |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2020-09-05更新
|
535次组卷
|
6卷引用:河北正定中学2019-2020学年高一下学期摸底考试化学试题
3 . 用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是_______________________________________________ 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______ (填字母)。
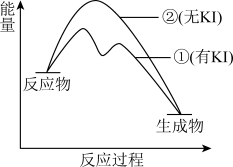
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I = H2O + IO
= H2O + IO 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________ ,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________ 。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________ 。
(4)资料4:I + I
+ I
 I
I K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
① a =____________________ 。
② 该平衡体系中除了含有I 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是_____________________ 。
(1)资料1:KI在该反应中的作用:H2O2 + I
 = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是

a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I
 = H2O + IO
= H2O + IO 是放热反应
是放热反应(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ.
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是
(4)资料4:I
 + I
+ I
 I
I K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
| 微粒 | I | I | I |
| 浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
② 该平衡体系中除了含有I
 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
2020-01-23更新
|
358次组卷
|
11卷引用:湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练
湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练北京师范大学附中2019-2020学年高二上学期期中考试化学试题2020年北京新高考试测化学试题北京市海淀区清华大学附属中学2020届高三下学期统一测试化学试题北京市2020普通高中学业水平考试等级性抽样测试化学试题(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率
4 . CO2的资源化利用能有效减少CO2排放,充分利用碳资源。科学家设想了一系列捕捉和封存CO2的方法。
(1) Bosch反应: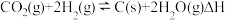
已知CO2(g)和H2O(g)常温下的生成焓分别为-393.5 kJ/mol和-241.8 kJ/mol(生成焓是指压力为101 kPa,一定温度下时,由元素最稳定的单质生成生成1mol纯化合物时的反应焙变)。则Bosch反应的△H=________________ 。
(2)在Pd-MgO/SiO2催化下,以CO2和H2为原料完成Sabatie反应的机理妇下图:
Sabatier反应的化学方程式为___________________________________________ 。
(3)可将二氧化碳转化为甲醇,其原理是: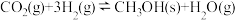 △H=-53.7 kJ/mol。526K时,向3 L刚性密闭容器中通入0.2 mol CO2和0.4 mol H2,若测得其压强(p)随时间(t)变化如图中曲线Ⅰ所示,则有:
△H=-53.7 kJ/mol。526K时,向3 L刚性密闭容器中通入0.2 mol CO2和0.4 mol H2,若测得其压强(p)随时间(t)变化如图中曲线Ⅰ所示,则有:
①反应经过5 min达到平衡。反应开始至达平衡时,v(H2) =_________ ;该温度下反应的平衡常数为________ 。
②只改变某一条件,其他条件相同时,测得曲线变化为曲线Ⅱ,则改变的条件可能是_____ 。
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O2·H2O热分解可制备CaO。在隔绝空气的条件下,CaC2O2·H2O加热升温过程中固体的质量变化见下图。
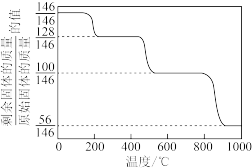
①写出400~600℃范围内分解反应的化学方程式:_________________ 。
②与CaCO3热分解制备的CaO相比,CaC2O2·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因可能是__________________________________________________ 。
(1) Bosch反应:
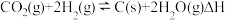
已知CO2(g)和H2O(g)常温下的生成焓分别为-393.5 kJ/mol和-241.8 kJ/mol(生成焓是指压力为101 kPa,一定温度下时,由元素最稳定的单质生成生成1mol纯化合物时的反应焙变)。则Bosch反应的△H=
(2)在Pd-MgO/SiO2催化下,以CO2和H2为原料完成Sabatie反应的机理妇下图:

Sabatier反应的化学方程式为
(3)可将二氧化碳转化为甲醇,其原理是:
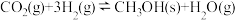 △H=-53.7 kJ/mol。526K时,向3 L刚性密闭容器中通入0.2 mol CO2和0.4 mol H2,若测得其压强(p)随时间(t)变化如图中曲线Ⅰ所示,则有:
△H=-53.7 kJ/mol。526K时,向3 L刚性密闭容器中通入0.2 mol CO2和0.4 mol H2,若测得其压强(p)随时间(t)变化如图中曲线Ⅰ所示,则有: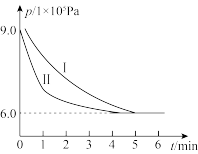
①反应经过5 min达到平衡。反应开始至达平衡时,v(H2) =
②只改变某一条件,其他条件相同时,测得曲线变化为曲线Ⅱ,则改变的条件可能是
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O2·H2O热分解可制备CaO。在隔绝空气的条件下,CaC2O2·H2O加热升温过程中固体的质量变化见下图。

①写出400~600℃范围内分解反应的化学方程式:
②与CaCO3热分解制备的CaO相比,CaC2O2·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因可能是
您最近一年使用:0次
名校
5 . 研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:

(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验________ (填“能”或“不能”)达到目的,原因是___________ 。
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1%H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
由此得出的结论是______________ 。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有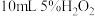 )
)
结论是___________ ,实验III的目的是___________ 。
(4)查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从催化剂的角度 分析,这两个氧化还原反应的化学方程式分别是_________________ 和_________________ (按反应发生的顺序写)。

(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1%H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积 | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有
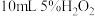 )
)| 试管 | I | II | III |
| 滴加试剂 | 5滴 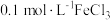 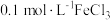 | 5滴 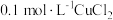 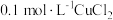 | 5滴 0.3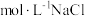 |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)查阅资料得知:将作为催化剂的
 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从
您最近一年使用:0次
名校
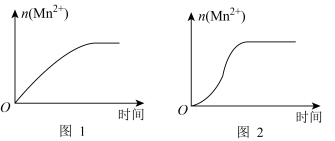
6 . 某小组利用H2C2O4 溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
(1)根据上表中的实验数据,可以得到的结论是_______ 。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是_______ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
固体X是_______ 。
③若该小组同学提出的假设成立,时间t_______ 4.0min(填>、=或<)。
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计_______ 。
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 2.0 | 1.0 | 6.4 |

(1)根据上表中的实验数据,可以得到的结论是
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜 色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
③若该小组同学提出的假设成立,时间t
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计
您最近一年使用:0次
2019-11-18更新
|
147次组卷
|
3卷引用:湖北省随州一中2019-2020学年高二上学期期中考试化学试题
名校
解题方法
7 . 为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)实验①的目的是其它条件相同时,探究______ 条件对H2O2分解速率的影响。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是____________________________________ 。
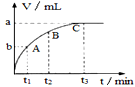
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是____ (填字母代号)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
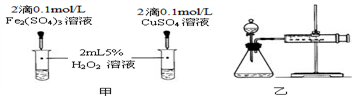
①定性分析:如图甲可通过观察________________________ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是______________________ 。
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是________________ ,所需仪器为_______ 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________ 思想方法的应用。
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增多。 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液。 | 两支试管中均未明显见到有气泡产生。 |
(1)实验①的目的是其它条件相同时,探究
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是

(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(5)通过对上述实验过程的分析,在实验设计时,要考虑
您最近一年使用:0次
2018-04-25更新
|
652次组卷
|
4卷引用:湖北省沙市中学2017-2018学年高一下学期期中考试化学试题
湖北省沙市中学2017-2018学年高一下学期期中考试化学试题江苏省启东中学2017-2018学年高一下学期期中考试化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第二单元 化学反应速率与化学平衡单元测试A卷河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学(实验班)试题
名校
解题方法
8 . 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:________________________ 。
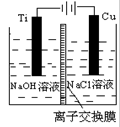
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为______ 离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:_____________ 钛极附近的pH值________ (增大、减小、不变)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:____________ 。
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O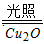 2H2+O2 ΔH>0
2H2+O2 ΔH>0
水蒸气的浓度随时间t变化如下表所示。
①对比实验的温度T2_____ T1(填“>”“<”或“=”)。
②实验①前20 min的平均反应速率v(O2)=______ 。
③催化剂催化效率:实验①______ 实验② (填“>”、“<")。
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu + H2O  Cu2O + H2↑ Cu2O + H2↑ |
| 方法d | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O
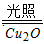 2H2+O2 ΔH>0
2H2+O2 ΔH>0水蒸气的浓度随时间t变化如下表所示。
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.0500 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.1000 | 0.0940 | 0.0900 | 0.0900 | 0.0900 | 0.0900 |
①对比实验的温度T2
②实验①前20 min的平均反应速率v(O2)=
③催化剂催化效率:实验①
您最近一年使用:0次
名校
解题方法
9 . 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。该反应的离子方程式为2 + 5H2C2O4+ 6H+===2Mn2+ +10CO2+8H2O
+ 5H2C2O4+ 6H+===2Mn2+ +10CO2+8H2O
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
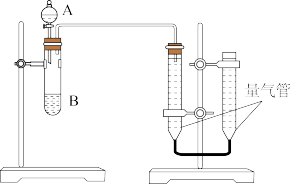
某同学进行实验,实验装置如下左图。其中A、B的成分见下右表
(1)该实验的目的是_______________________________________________ 。
(2)实验开始前需要检查气密性。分液漏斗中A溶液应该______________ 加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要__________ (填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平。
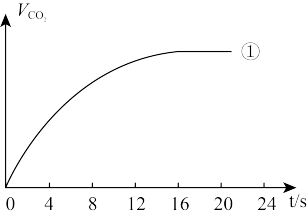
(4)请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
(5)X=____________ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是__________________________________ 。
(6)2号反应中,H2C2O4的反应速率为____________________________ 。
(7)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
结合实验目的与表中数据,你得出的结论是_____________________________ 。
(8)从影响化学反应速率的因素看,你的猜想还可能是______________________ 的影响。
 + 5H2C2O4+ 6H+===2Mn2+ +10CO2+8H2O
+ 5H2C2O4+ 6H+===2Mn2+ +10CO2+8H2O 设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
某同学进行实验,实验装置如下左图。其中A、B的成分见下右表

| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L H2C2O4溶液 | 4 mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L KMnO4溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4 mL 0.01mol/L KMnO4溶液和少量MnSO4 |
(2)实验开始前需要检查气密性。分液漏斗中A溶液应该
(3)完成该实验还需要
(4)请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图。

乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5 mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2 mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
(6)2号反应中,H2C2O4的反应速率为
(7)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
(8)从影响化学反应速率的因素看,你的猜想还可能是
您最近一年使用:0次
2016-12-09更新
|
623次组卷
|
2卷引用:2015-2016学年福建省厦门市六中高二下学期期中考试化学试卷
10 . 3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点 181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯 相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】
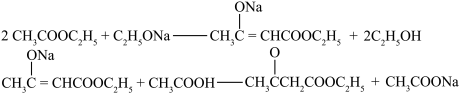
【实验装置】
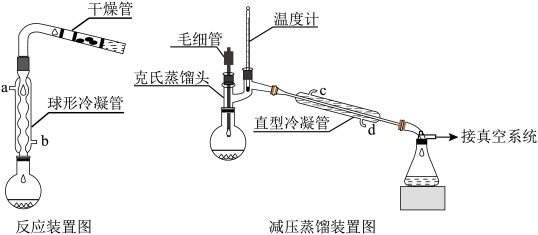
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是_____________ 。
(2)反应装置中加干燥管是为了__________ 。两个装置中冷凝管的作用__________ (填“相同”或“不相同”),冷却水进水口分别为__________ 和_____________ (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是__________ ,稀醋酸不能加多了,原因是___________ 。用分液漏斗分离出酯层的操作叫____________ 。碳酸钠溶液洗涤的目的是_________________ 。加碳酸钾的目的是______________ 。
(4)采用减压蒸馏的原因是_______________ 。
(5)本实验所得到的3-丁酮酸乙酯产率是_____________ (填正确答案标号)。
【反应原理】

【实验装置】

【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是
(2)反应装置中加干燥管是为了
(3)产物后处理中,滴加稀醋酸的目的是
(4)采用减压蒸馏的原因是
(5)本实验所得到的3-丁酮酸乙酯产率是
| A.10% | B.22% | C.19% | D.40% |
您最近一年使用:0次
2016-12-09更新
|
524次组卷
|
2卷引用:2015届湖北省襄阳市普通高中高三1月调研理综化学试卷



