名校
解题方法
1 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

(1)反应I:
反应Ⅲ:
反应Ⅱ的热化学方程式:_______
(2)对反应Ⅱ,在某一投料比时,两种压强下, 在平衡体系中物质的量分数随温度的变化关系如图所示
在平衡体系中物质的量分数随温度的变化关系如图所示


_______  (填“>”或“<”)。
(填“>”或“<”)。
(3) 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
i. ⅱ.
ⅱ. _______
_______ _______+_______
_______+_______
______
(4)探究i、ⅱ反应速率与 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将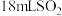 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)
①B是A的对比实验,则
_______
②比较A、B、C,可得出的结论是_______

(1)反应I:

反应Ⅲ:

反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,
 在平衡体系中物质的量分数随温度的变化关系如图所示
在平衡体系中物质的量分数随温度的变化关系如图所示

 (填“>”或“<”)。
(填“>”或“<”)。(3)
 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。i.
 ⅱ.
ⅱ. _______
_______ _______+_______
_______+_______
(4)探究i、ⅱ反应速率与
 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将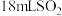 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)| A | B | C | D | |
| 试剂组成 | 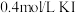 | 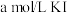 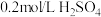 | 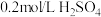 | 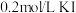 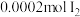 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则

②比较A、B、C,可得出的结论是
您最近一年使用:0次
2021-09-29更新
|
296次组卷
|
3卷引用:广东省广州市真光中学2020-2021学年高二上学期期中化学试题
解题方法
2 . 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
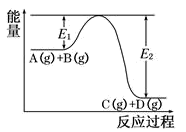
(1)该反应是________ 反应(填“吸热”“放热”)。
(2)反应体系中加入催化剂对反应热是否有影响?__________ 。
(3)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1_________ (填“增大”“减小”“不变”)。
(4)由氢气和氧气反应生成1mol水蒸气放热241.8kJ·mol-1,写出其热化学方程式:____________ 。
(5)反应3Fe(s)+4H2O(g) Fe3O4+4H2(g),在一可变的容积的密闭容器中进行。
Fe3O4+4H2(g),在一可变的容积的密闭容器中进行。
①增加Fe的量, 其正反应速率的变化是_______ (填“增大”、“不变”或“减小”,以下相同)。
②保持体积不变,充入N2使体系压强增大,其正反应速率_______ 。
③保持压强不变,充入N2使容器的体积增大,逆反应速率_______ 。
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
(1)该反应是
(2)反应体系中加入催化剂对反应热是否有影响?
(3)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1
(4)由氢气和氧气反应生成1mol水蒸气放热241.8kJ·mol-1,写出其热化学方程式:
(5)反应3Fe(s)+4H2O(g)
 Fe3O4+4H2(g),在一可变的容积的密闭容器中进行。
Fe3O4+4H2(g),在一可变的容积的密闭容器中进行。①增加Fe的量, 其正反应速率的变化是
②保持体积不变,充入N2使体系压强增大,其正反应速率
③保持压强不变,充入N2使容器的体积增大,逆反应速率
您最近一年使用:0次
名校
解题方法
3 . 《化学反应原理》对于深入了解化学反应的本质及其规律是极为重要的,它们不仅具有理论意义,而且具有实际价值;它们不仅是核心的基础化学知识,而且对学生今后从事科学研究与技术创新具有重要的指导作用。 有甲、乙两个研究性学习小组分别设计了以下实验
I.甲组同学,为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图A、B所示的实验。请回答下列问题:
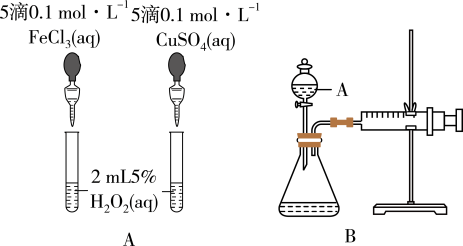
(1)定性比较:图A可通过观察_________ ,定性比较得出结论。有同学提出将CuSO4改为CuCl2更合理,其理由是_________ 。
(2)定量比较:如图B所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是________ ,实验中需要测量的数据是___________ 。
(3)将0.1 mol MnO2粉末加入到50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。计算H2O2的初始物质的量浓度________________ 。(请保留两位有效数字)

Ⅱ.乙组同学按照如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
(1)实验原理:硫代硫酸钠溶液与稀硫酸反应,其化学方程式为:___ 。
(2)实验目的:
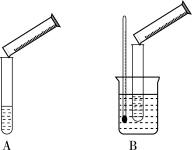
装置A,探究浓度对化学反应速率的影响;装置B,探究__________ 对化学反应速率的影响。
(3)通过A、B装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
结论1:由Ⅰ和Ⅱ两组数据可知,_______ ;
结论2:由Ⅱ和Ⅲ两组数据可知,________ 。
I.甲组同学,为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图A、B所示的实验。请回答下列问题:

(1)定性比较:图A可通过观察
(2)定量比较:如图B所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是
(3)将0.1 mol MnO2粉末加入到50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。计算H2O2的初始物质的量浓度

Ⅱ.乙组同学按照如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
(1)实验原理:硫代硫酸钠溶液与稀硫酸反应,其化学方程式为:
(2)实验目的:

装置A,探究浓度对化学反应速率的影响;装置B,探究
(3)通过A、B装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
| 实验组号 | 温度/℃ | Na2S2O3溶液 | H2SO4 | 加入H2O 的体积/mL | 出现沉淀所需时间/s | ||
| 体积 /mL | 浓度/ (mol • L−1) | 体积/mL | 浓度/(mol • L−1) | ||||
| I | 0 | 5 | 0.1 | 10 | 0.1 | 5 | 8 |
| Ⅱ | 0 | 5 | 0.1 | 5 | 0.1 | 10 | 12 |
| Ⅲ | 30 | 5 | 0.1 | 5 | 0.1 | 10 | 4 |
结论2:由Ⅱ和Ⅲ两组数据可知,
您最近一年使用:0次
2020-08-23更新
|
138次组卷
|
2卷引用:江西省上饶市横峰中学2020-2021学年高二上学期开学考试化学(统招班)试题
4 . 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=__________ 。当反应达到平衡时,若增大压强,则n(C2H4)___________ (填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
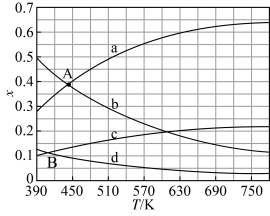
图中,表示C2H4、CO2变化的曲线分别是______ 、______ 。CO2催化加氢合成C2H4反应的ΔH______ 0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_________ (MPa)−3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________________ 。
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

图中,表示C2H4、CO2变化的曲线分别是
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当
您最近一年使用:0次
2020-07-09更新
|
16366次组卷
|
23卷引用:2020年全国统一考试化学试题(新课标Ⅲ)
2020年全国统一考试化学试题(新课标Ⅲ)(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题2020年全国卷Ⅲ化学真题变式题(已下线)专题15 化学反应原理大题不丢分-2021年高考化学必做热点专题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)押全国卷理综第28题 化学反应原理-备战2021年高考化学临考题号押题选择性必修1 专题2 素养检测吉林省白山市抚松县第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第28题 化学反应原理-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题15化学反应原理综合-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)第20讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(新教材新高考)吉林省洮南市第一中学2022-2023学年高二上学期第一次(10月)月考化学试题陕西省富平县蓝光中学2021-2022学年高三上学期期末教学检测化学试题(已下线)专题十二化学反应速率与平衡(已下线)专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第七章 化学反应速率与化学平衡 第45讲 实际工业生产中图像问题分类突破(已下线)专题05 反应原理专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题17 原理综合题
2018·江西南昌·模拟预测
解题方法
5 . 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。该反应的离子方程式为2MnO4- + 5 H2C2O4 + 6H+ ═ 2Mn2+ + 10CO2 + 8H2O
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
某同学进行实验,实验装置如下图。其中A、B的成分见下表
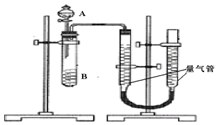
(1)实验开始前需要检查气密性。分液漏斗中A溶液应该__________ 加入(填“一次性”或“逐滴滴加”)
(2)完成该实验还需要_________ (填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
(3)X=____ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是_____________ 。
(4)2号反应中,H2C2O4的反应速率为_____________ 。
(5)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
结合实验目的与表中数据,从影响化学反应速率的因素看,你的猜想还可能是_________ 的影响。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
某同学进行实验,实验装置如下图。其中A、B的成分见下表
序号 | A溶液 | B溶液 |
① | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
② | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |

(1)实验开始前需要检查气密性。分液漏斗中A溶液应该
(2)完成该实验还需要
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/mL | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | —— |
(3)X=
(4)2号反应中,H2C2O4的反应速率为
(5)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
结合实验目的与表中数据,从影响化学反应速率的因素看,你的猜想还可能是
您最近一年使用:0次
6 . 亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
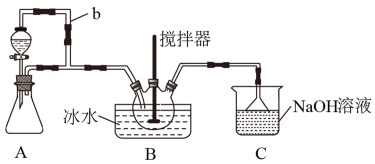
(1)装置A制取SO2
①A中反应的化学方程式为___ 。
②导管b的作用是___ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___ (只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___ 。
(3)装置C的主要作用是___ (用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___ 。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__ MnO4-+__ C2O42-+__ =__ Mn2++__ +__ H2O
②滴定终点时的现象为___ 。
③亚硝酰硫酸的纯度=___ 。(精确到0.1%)[M(NOSO4H)=127g·mol-1]

(1)装置A制取SO2
①A中反应的化学方程式为
②导管b的作用是
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是
(3)装置C的主要作用是
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:
②滴定终点时的现象为
③亚硝酰硫酸的纯度=
您最近一年使用:0次
2020-03-10更新
|
390次组卷
|
3卷引用:江西省南昌三中2020届高三考前第二次适应性检测理综化学试题
名校
解题方法
7 . 酸性 溶液与
溶液与 溶液反应的离子方程式为:
溶液反应的离子方程式为: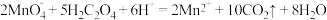 ,某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。
,某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。
(1)实验中a的最小值为____________ ,探究温度变化对反应速率影响情况的两组实验是________ 。
(2)
____________ ,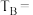
____________ ,利用实验B中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为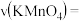
________ 。
(3)他们发现,A组实验中收集的 体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。
体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。
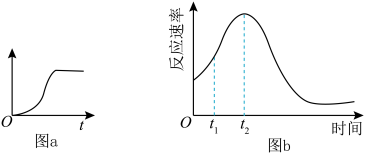
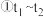 时间内速率变快的主要原因可能是:一是产物中
时间内速率变快的主要原因可能是:一是产物中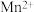 是反应的催化剂;二是
是反应的催化剂;二是______________________________ 。
 由图b信息知,催化剂的催化效果与其用量
由图b信息知,催化剂的催化效果与其用量________  填“有关”“无关”或“无法确定”
填“有关”“无关”或“无法确定” 。
。
 溶液与
溶液与 溶液反应的离子方程式为:
溶液反应的离子方程式为: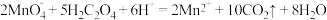 ,某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。
,某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。| 实验序号 | 实验温度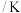 | 参加反应的物质 | 溶液颜色褪至无色所需时间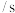 | ||||
 溶液 溶液 含硫酸 含硫酸 |  溶液 溶液 |  | |||||
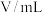 | 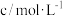 | 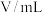 | 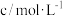 | 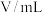 | |||
| A | 298 | 2 |  | 4 | a | 0 | 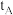 |
| B | 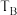 | 2 |  | 3 | a | 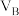 | 10 |
| C | 318 | 2 |  | 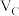 | a | 1 | 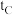 |
(2)
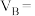
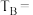
 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为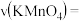
(3)他们发现,A组实验中收集的
 体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。
体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。
 时间内速率变快的主要原因可能是:一是产物中
时间内速率变快的主要原因可能是:一是产物中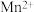 是反应的催化剂;二是
是反应的催化剂;二是 由图b信息知,催化剂的催化效果与其用量
由图b信息知,催化剂的催化效果与其用量 填“有关”“无关”或“无法确定”
填“有关”“无关”或“无法确定” 。
。
您最近一年使用:0次
19-20高二上·江西南昌·期中
名校
解题方法
8 .  (主要指
(主要指 和
和 )是大气主要污染物之一。有效去除
)是大气主要污染物之一。有效去除 是环境保护的重要课题。催化剂能催化
是环境保护的重要课题。催化剂能催化 与
与 反应生成
反应生成 .
.
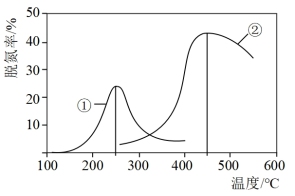
(1)在有氧条件下,将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应,反应相同时间NOx的去除率随反应温度的变化曲线如图所示.
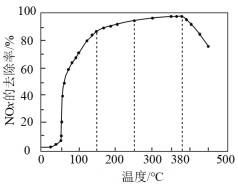
在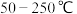 内随着温度的升高
内随着温度的升高 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是______ ;当反应温度高于 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是_______ .
(2)在无氧条件下,将一定比例的 和
和 的混合气体通过两种不同催化剂,测量逸出气体中氮氧化物含量如图,从而确定脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
的混合气体通过两种不同催化剂,测量逸出气体中氮氧化物含量如图,从而确定脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: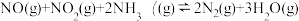 。以下说法正确的是
。以下说法正确的是( )
A.适当增加 的量有利于提高烟气脱氮率
的量有利于提高烟气脱氮率
B.使用第②种催化剂更有利于提高 的平衡转化率
的平衡转化率
C.相同条件下,改变压强对脱氮率没有影响
D.催化剂①、②分别适合于 和
和 左右脱氮
左右脱氮
(3)对于反应: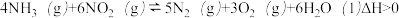
一定温度下,容积可变的密闭容器中达到平衡,此时容积为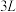 ,
,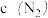 与反应时间t变化曲线X如图所示。
与反应时间t变化曲线X如图所示。
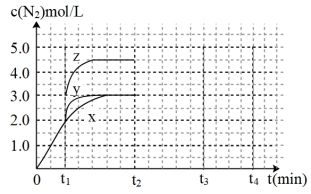
①若在时 刻改变一个条件,曲线X变为曲线Y或曲线Z。变为曲线Y改变的条件是
刻改变一个条件,曲线X变为曲线Y或曲线Z。变为曲线Y改变的条件是______ 。变为曲线Z改变的条件是______ 。
②若降低 温度,
温度, 达到平衡,请在上图中画由曲线X在
达到平衡,请在上图中画由曲线X在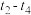 内
内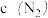 的变化曲线
的变化曲线_________________ .
 (主要指
(主要指 和
和 )是大气主要污染物之一。有效去除
)是大气主要污染物之一。有效去除 是环境保护的重要课题。催化剂能催化
是环境保护的重要课题。催化剂能催化 与
与 反应生成
反应生成 .
.(1)在有氧条件下,将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应,反应相同时间NOx的去除率随反应温度的变化曲线如图所示.

在
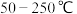 内随着温度的升高
内随着温度的升高 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是(2)在无氧条件下,将一定比例的
 和
和 的混合气体通过两种不同催化剂,测量逸出气体中氮氧化物含量如图,从而确定脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
的混合气体通过两种不同催化剂,测量逸出气体中氮氧化物含量如图,从而确定脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: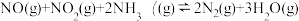 。以下说法正确的是
。以下说法正确的是
A.适当增加
 的量有利于提高烟气脱氮率
的量有利于提高烟气脱氮率B.使用第②种催化剂更有利于提高
 的平衡转化率
的平衡转化率C.相同条件下,改变压强对脱氮率没有影响
D.催化剂①、②分别适合于
 和
和 左右脱氮
左右脱氮(3)对于反应:
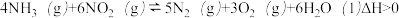
一定温度下,容积可变的密闭容器中达到平衡,此时容积为
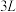 ,
,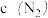 与反应时间t变化曲线X如图所示。
与反应时间t变化曲线X如图所示。
①若在时
 刻改变一个条件,曲线X变为曲线Y或曲线Z。变为曲线Y改变的条件是
刻改变一个条件,曲线X变为曲线Y或曲线Z。变为曲线Y改变的条件是②若降低
 温度,
温度, 达到平衡,请在上图中画由曲线X在
达到平衡,请在上图中画由曲线X在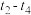 内
内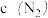 的变化曲线
的变化曲线
您最近一年使用:0次
9 . 某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为_______________ 。
(2)请完成以下实验设计表。
①表中a=________ 、b=________ ;
②甲组实验KMnO4的平均反应速率是:____________ (用含t1的式子表示)。
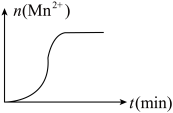
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:___________________ 。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为
(2)请完成以下实验设计表。
| 实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色时间/s | ||
| c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| 甲 | 0.01 | 4 | 0.1 | 2 | t1 |
| 乙 | a | 4 | b | 2 | t2 |
②甲组实验KMnO4的平均反应速率是:
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:

您最近一年使用:0次
名校
解题方法
10 . 研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
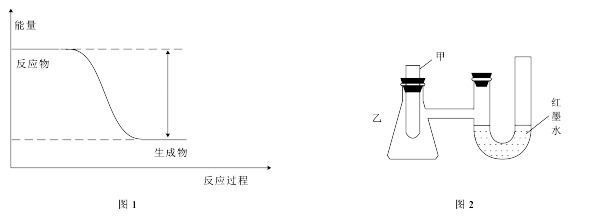
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为__________ (填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________ 。
③若要使该反应的反应速率加快,下列措施可行的是__________ (填字母)。
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
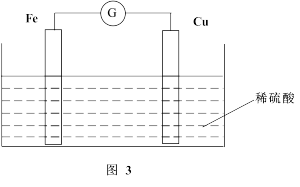
①铜为__________ (填“正”或“负”)极;负极的电极反应式为______ 。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________ L。

(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是
③若要使该反应的反应速率加快,下列措施可行的是
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。

①铜为
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是
您最近一年使用:0次
2019-10-12更新
|
197次组卷
|
5卷引用:福建省永安市第三中学2019-2020学年高二10月月考化学试题



