名校
解题方法
1 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

(1)反应I:
反应Ⅲ:
反应Ⅱ的热化学方程式:_______
(2)对反应Ⅱ,在某一投料比时,两种压强下, 在平衡体系中物质的量分数随温度的变化关系如图所示
在平衡体系中物质的量分数随温度的变化关系如图所示


_______  (填“>”或“<”)。
(填“>”或“<”)。
(3) 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
i. ⅱ.
ⅱ. _______
_______ _______+_______
_______+_______
______
(4)探究i、ⅱ反应速率与 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将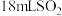 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)
①B是A的对比实验,则
_______
②比较A、B、C,可得出的结论是_______

(1)反应I:

反应Ⅲ:

反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,
 在平衡体系中物质的量分数随温度的变化关系如图所示
在平衡体系中物质的量分数随温度的变化关系如图所示

 (填“>”或“<”)。
(填“>”或“<”)。(3)
 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。i.
 ⅱ.
ⅱ. _______
_______ _______+_______
_______+_______
(4)探究i、ⅱ反应速率与
 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将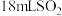 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)| A | B | C | D | |
| 试剂组成 | 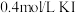 | 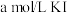 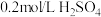 | 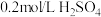 | 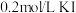 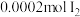 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则

②比较A、B、C,可得出的结论是
您最近一年使用:0次
2021-09-29更新
|
296次组卷
|
3卷引用:广东省广州市真光中学2020-2021学年高二上学期期中化学试题
名校
解题方法
2 . 根据下列实验设计,回答问题:
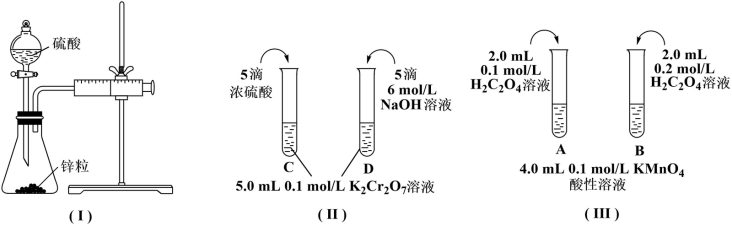
(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+推测D试管中实验现象为
(黄色)+2H+推测D试管中实验现象为___ ,用平衡移动原理解释原因:___ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___ ,推测该实验设计___ (填“能”或“不能”)达到实验目的,判断理由是___ 。
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
①由实验ⅰ、实验ⅱ可得出的结论是___ 。
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,___ ,最后加入5mL0.1mol/L草酸溶液。

(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+推测D试管中实验现象为
(黄色)+2H+推测D试管中实验现象为(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| ⅰ | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ⅱ | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,
您最近一年使用:0次
3 . 请回答下列问题
(1)可逆反应2Cl2(g)+2H2O(g)⇌4HCl(g)+O2(g)ΔH>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率_____ ;v正_____ ;
②保持容器体积不变,加入He,则HCl的物质的量_____ ;
③保持容器压强不变,加入He,则O2的体积分数_____ ;
④若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度_____ ,相对分子质量_____ 。
(2)在容器体积可变的密闭容器中,反应N2(g)+3H2(g)⇌2NH3(g)在一定条件下达到平衡。完成下列填空:
①若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.6mol/L,在此期间,正反应速率v(H2)的值为_____
A.0.6mol/(L∙s) B.0.45mol/(L∙s)
C.0.3mol/(L∙s) D.0.2mol/(L∙s)
②在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正_____ (选填“增大”、“减小”,下同),v逆_____ ,平衡向_____ 方向移动(选填“正反应”、“逆反应”)。
③在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为_____ 反应(选填“吸热”、“放热”)。
④如图为反应速率(v)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是_____ (填写编号)。

a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量_____ (选填“增大”、“减小”、“不变”)。
(1)可逆反应2Cl2(g)+2H2O(g)⇌4HCl(g)+O2(g)ΔH>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率
②保持容器体积不变,加入He,则HCl的物质的量
③保持容器压强不变,加入He,则O2的体积分数
④若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度
(2)在容器体积可变的密闭容器中,反应N2(g)+3H2(g)⇌2NH3(g)在一定条件下达到平衡。完成下列填空:
①若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.6mol/L,在此期间,正反应速率v(H2)的值为
A.0.6mol/(L∙s) B.0.45mol/(L∙s)
C.0.3mol/(L∙s) D.0.2mol/(L∙s)
②在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正
③在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为
④如图为反应速率(v)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是

a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量
您最近一年使用:0次
名校
解题方法
4 . H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2(2%和5%两种浓度)分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察_______ 定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______ 。

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为______ ,检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看______ ,实验中需要测量的数据是______ 。
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如丙图所示。由D到A过程中,随着反应的进行反应速率逐渐______ (填“加快”或“减慢”),其变化的原因是______ 。(选填字母编号)

A.改变了反应的活化能
B.改变活化分子百分比
C.改变了反应途径
D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
可得到的结论是浓度越大,H2O2分解速率越快。
(1)定性分析:图甲可通过观察

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如丙图所示。由D到A过程中,随着反应的进行反应速率逐渐

A.改变了反应的活化能
B.改变活化分子百分比
C.改变了反应途径
D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
| 实验编号 | T/K | 催化剂 | 浓度 |
| 实验1 | 298 | 3滴FeCl3溶液 | 10mL2%H2O2 |
| 实验2 | 298 |
您最近一年使用:0次
5 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)①通过实验A、B,可探究出_________ (填外部因素)的改变对化学反应速率的影响,其中V1=______ 、T1=________ ;
②通过实验__________ (填实验序号),可探究出_______ (填外部因素)的变化对化学反应速率的影响,其中V2=______ 。
(2)若t1<8,则由此实验可以得出的结论是__________ ;忽略溶液体积的变化,利用实验B中数据计算,0~8 s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=________ (保留2位有效数字)。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_____________ ,相应的粒子最可能是________ (填粒子符号)。

| 实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
| 酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
②通过实验
(2)若t1<8,则由此实验可以得出的结论是
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是

您最近一年使用:0次
名校
解题方法
6 . 某实验小组利用酸性KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
(1)上表中V=____________ ,若②③组为对比试验,则T____________ 25℃(填“>”、“<”或“=”)。
(2)上述反应的化学方程式为____________ 。
(3)t1_____ t2(填“>”、“<”、“=”),其理由是____________ 。
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:____________ (请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______ 。
A.硫酸钾B.硫酸锰C.水D.氯化锰
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | V | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | T | t3 |
(2)上述反应的化学方程式为
(3)t1
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是
A.硫酸钾B.硫酸锰C.水D.氯化锰
您最近一年使用:0次
2020-10-15更新
|
225次组卷
|
3卷引用:广东省广州市中山大学附属中学2019-2020学年高二10月月考化学试题
解题方法
7 . 探究化学反应快慢的影响因素在生产生活中具有重要的意义.
Ⅰ.探究温度对速率的影响(可选用试剂: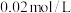 酸性
酸性 溶液、
溶液、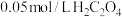 弱酸溶液).
弱酸溶液).
Ⅱ.为了验证“反应生成的 对反应具有催化的作用”,某研究小组用井穴板设计了以下实验:
对反应具有催化的作用”,某研究小组用井穴板设计了以下实验:
①向一个井穴中滴入10滴 溶液,逐滴加入酸性
溶液,逐滴加入酸性 溶液并记录各滴加入后褪色时间.
溶液并记录各滴加入后褪色时间.
②向三个井穴中分别滴加10滴 溶液再分别滴加1、2、3滴
溶液再分别滴加1、2、3滴 溶液,最后,各滴入1滴酸性
溶液,最后,各滴入1滴酸性 溶液,记录褪色时间.
溶液,记录褪色时间.
已知: 为难溶于水的褐色固体,
为难溶于水的褐色固体,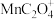 溶液为红色,不稳定,会缓慢分解为
溶液为红色,不稳定,会缓慢分解为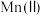 和
和 ;
;
(1)实验①中第6滴出现褐色沉淀的原因是________________ (用离子反应方程式表示).
(2)实验①②的现象说明上述推测正确,催化过程如下:

实验②中催化剂用量增加,褪色时间却略有延长,说明催化剂过量易催化到“催化过程”的第_____ 步,反应过程出现红色的原因是_______________ .
(3)简述微型实验中滴管均套上相同的塑料针头的优点:____________ .
Ⅰ.探究温度对速率的影响(可选用试剂:
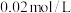 酸性
酸性 溶液、
溶液、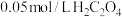 弱酸溶液).
弱酸溶液).| 实验原理: | ||
| 操作 | 现象 | 结论 |
取两支试管,分别加入 酸性 酸性 溶液与 溶液与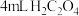 溶液,置于冷水浴中;另取两支试管, 溶液,置于冷水浴中;另取两支试管, | ||
 对反应具有催化的作用”,某研究小组用井穴板设计了以下实验:
对反应具有催化的作用”,某研究小组用井穴板设计了以下实验:①向一个井穴中滴入10滴
 溶液,逐滴加入酸性
溶液,逐滴加入酸性 溶液并记录各滴加入后褪色时间.
溶液并记录各滴加入后褪色时间.②向三个井穴中分别滴加10滴
 溶液再分别滴加1、2、3滴
溶液再分别滴加1、2、3滴 溶液,最后,各滴入1滴酸性
溶液,最后,各滴入1滴酸性 溶液,记录褪色时间.
溶液,记录褪色时间.
| 实验① (  溶液滴数) 溶液滴数) | 褪色用时 | 实验② (  溶液滴数) 溶液滴数) | 褪色用时 |
| 第1滴 | 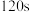 | 1滴 | 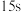 |
| 第2滴 |  | 2滴 |  |
| 第3滴 |  | 3滴 |  |
| 第4滴 |  | 实验②体系颜色变化:红色-浅红色-浅褐色-无色 | |
| 第5滴 |  | ||
| 第6滴 | 褐色沉淀 | ||
 为难溶于水的褐色固体,
为难溶于水的褐色固体,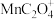 溶液为红色,不稳定,会缓慢分解为
溶液为红色,不稳定,会缓慢分解为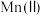 和
和 ;
;(1)实验①中第6滴出现褐色沉淀的原因是
(2)实验①②的现象说明上述推测正确,催化过程如下:

实验②中催化剂用量增加,褪色时间却略有延长,说明催化剂过量易催化到“催化过程”的第
(3)简述微型实验中滴管均套上相同的塑料针头的优点:
您最近一年使用:0次
解题方法
8 . 某实验小组以 H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
(1)催化剂能加快化学反应速率的原因是_____ 。
(2)实验①和②的目的是_________ 。
(3)写出实验③的化学反应方程式:_____ 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____ 。

| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量 HCl 溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量 NaOH溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |
(2)实验①和②的目的是
(3)写出实验③的化学反应方程式:
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是

您最近一年使用:0次
名校
9 .  歧化反应的方程式为
歧化反应的方程式为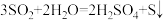 ,
, 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
(1)i.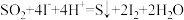
ii.
__________ =__________ +__________ 
(2)探究i、ii反应速率与 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
①B是A的对比实验,则
__________ 。
②比较A、B、C,可得出的结论是_________________________ 。
③实验表明, 的歧化反应速率
的歧化反应速率 。结合i、ii反应速率解释原因:
。结合i、ii反应速率解释原因:_____________________ 。
 歧化反应的方程式为
歧化反应的方程式为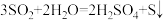 ,
, 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。(1)i.
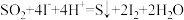
ii.


(2)探究i、ii反应速率与
 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 序号 | A | B | C | D |
| 试剂组成 | 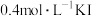 |  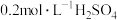 | 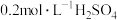 | 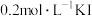 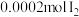 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则

②比较A、B、C,可得出的结论是
③实验表明,
 的歧化反应速率
的歧化反应速率 。结合i、ii反应速率解释原因:
。结合i、ii反应速率解释原因:
您最近一年使用:0次
2020-10-04更新
|
273次组卷
|
3卷引用:人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮
人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮广东省梅州市蕉岭县蕉岭中学2022-2023学年高三上学期高二第二次质检化学试题(已下线)考向21 化学反应速率及影响因素-备战2022年高考化学一轮复习考点微专题
名校
10 . 汽车尾气中含有CO、NO等有害气体。
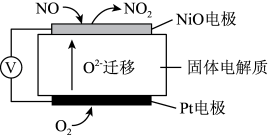
(1)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
(提示:O2-可在此固体电解质中自由移动)___________ 反应(填“氧化”或“还原”)。
②外电路中,电子是从_________ 电极流出(填“NiO”或“Pt”)。
③Pt电极上的电极反应式为_______________________________ 。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
①请将表中数据补充完整:a___________ 。
②能验证温度对化学反应速率规律的是实验____________________ (填实验序号)。
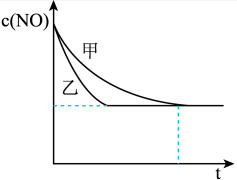
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________ (填“甲”或“乙”)。 2CO2+N2,
2CO2+N2,不能 说明已达到平衡状态的是________ (不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(1)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
(提示:O2-可在此固体电解质中自由移动)
②外电路中,电子是从
③Pt电极上的电极反应式为
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO
 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。| 实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
| Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线
 2CO2+N2,
2CO2+N2,A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
您最近一年使用:0次
2020-09-18更新
|
292次组卷
|
3卷引用:广东省佛山市第一中学2019-2020学年高一下学期期中考试化学试题



