1 . CO2是一种廉价的碳资源,其综合利用对于“碳中和”具有重要意义。
(1)CH4—CO催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。化学键键能数据如下:
该催化重整反应的△H=___ kJ•mol-1。
(2)对于反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得不同温度下CH3OH生成量随时间变化关系如图1。曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ
CH3OH(g)+H2O(g),测得不同温度下CH3OH生成量随时间变化关系如图1。曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ___ KⅡ(填“>”、“=”或“<”)。

(3)TiO2/Cu2Al2O4催化CO2和CH4可生成乙酸。在不同温度下催化效率与乙酸生成速率关系如图2。250℃~300℃时,升高温度反应速率降低的原因是___ 。


(4)最新报道中国科学家首次用CO2高效合成乙酸,其反应路径如图3所示,该反应路径中第1步反应方程式为___ ,总反应化学方程式为___ 。
(1)CH4—CO催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C≡O |
| 键能/kJ•mol-1 | 413 | 745 | 436 | 1075 |
(2)对于反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得不同温度下CH3OH生成量随时间变化关系如图1。曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ
CH3OH(g)+H2O(g),测得不同温度下CH3OH生成量随时间变化关系如图1。曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ
(3)TiO2/Cu2Al2O4催化CO2和CH4可生成乙酸。在不同温度下催化效率与乙酸生成速率关系如图2。250℃~300℃时,升高温度反应速率降低的原因是


(4)最新报道中国科学家首次用CO2高效合成乙酸,其反应路径如图3所示,该反应路径中第1步反应方程式为
您最近一年使用:0次
2021-06-29更新
|
252次组卷
|
4卷引用:2020年山东卷化学高考真题变式题16-20
(已下线)2020年山东卷化学高考真题变式题16-20江苏省宿迁市2020-2021学年高二下学期期末考试化学试题江苏省宿迁市沭阳县2020-2021学年高二下学期期末调研测试化学试题江苏省高邮市2021-2022学年高二上学期期中学情调研化学试题
2 . 某化学兴趣小组的同学探究 溶液是否能做催化剂以加速
溶液是否能做催化剂以加速 溶液的分解,做了以下探究。
溶液的分解,做了以下探究。
(1)请你帮助他们完成实验报告:
(2)已知 在水中可电离出
在水中可电离出 和
和 ,同学们提出以下猜想。
,同学们提出以下猜想。
甲同学的猜想: 溶液中的
溶液中的 起催化作用:
起催化作用:
乙同学的猜想: 溶液中的
溶液中的 起催化作用。
起催化作用。
对这两个猜想用实验进行了探究。请你仔细分析后完成下表中的空格:
(3)实验室利用如图装置进行中和热的测定,请回答下列问题:

①该图中缺少的玻璃仪器有___________ 。
②如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”绝对值将___________ (填“偏大”“偏小”或“不变”),原因是___________ 。
 溶液是否能做催化剂以加速
溶液是否能做催化剂以加速 溶液的分解,做了以下探究。
溶液的分解,做了以下探究。(1)请你帮助他们完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
实验1:在一支试管中加入5mL5%的 溶液,然后滴入适量的 溶液,然后滴入适量的 溶液,把带火星的木条伸入试管 溶液,把带火星的木条伸入试管 | ① |  溶液可以催化 溶液可以催化 分解 分解 |
 在水中可电离出
在水中可电离出 和
和 ,同学们提出以下猜想。
,同学们提出以下猜想。甲同学的猜想:
 溶液中的
溶液中的 起催化作用:
起催化作用:乙同学的猜想:
 溶液中的
溶液中的 起催化作用。
起催化作用。对这两个猜想用实验进行了探究。请你仔细分析后完成下表中的空格:
| 实验过程 | 实验现象 | 实验结论 |
实验2:向盛有5mL5%的 溶液的试管中加入少量的② 溶液的试管中加入少量的② | 无明显现象 | ③ |
实验3:向盛有5mL5%的 溶液的试管中加入少量的④ 溶液的试管中加入少量的④ | 同实验1 | ⑤ |

①该图中缺少的玻璃仪器有
②如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”绝对值将
您最近一年使用:0次
名校
3 . 亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。SO2和浓硝酸在浓硫酸存在时可制备 NOSO4H,反应原理为:
SO2+HNO3=SO3+HNO2;SO3+HNO2=NOSO4H。
实验室用如图装置(夹持装置略)制备少量 NOSO4H。

(1)导管 a 的作用是_____ 。仪器 b 的名称是_____ 。
(2)A 中反应的化学方程式为_____ 。
(3)B 中反应必须维持体系温度不得高于 20℃,可能的原因为_____ 。
(4)反应开始时缓慢,待生成少量 NOSO4H 后,温度变化不大,但反应速度明显加快,其原因是_____ 。
(5)装置 C 的主要作用是_____ (用离子方程式表示)。
(6)该实验装置存在明显缺陷,可能导致 NOSO4H 产量降低,请补充合理的改进方案_____ 。
SO2+HNO3=SO3+HNO2;SO3+HNO2=NOSO4H。
实验室用如图装置(夹持装置略)制备少量 NOSO4H。

(1)导管 a 的作用是
(2)A 中反应的化学方程式为
(3)B 中反应必须维持体系温度不得高于 20℃,可能的原因为
(4)反应开始时缓慢,待生成少量 NOSO4H 后,温度变化不大,但反应速度明显加快,其原因是
(5)装置 C 的主要作用是
(6)该实验装置存在明显缺陷,可能导致 NOSO4H 产量降低,请补充合理的改进方案
您最近一年使用:0次
2020-11-26更新
|
242次组卷
|
2卷引用:山东省济南历城第二中学2021届高三上学期期中考试化学试题
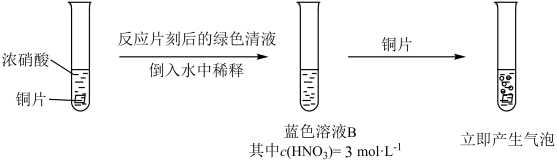
4 . 某小组探究Cu与 反应,发现有趣的现象。室温下,
反应,发现有趣的现象。室温下, 的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
回答下列问题:
(1)探究溶液B遇铜片立即发生反应的原因。
①假设1:_____________ 对该反应有催化作用。
实验验证:向溶液A中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2: 对该反应有催化作用。
对该反应有催化作用。
方案Ⅰ:向盛有铜片的溶液A中通入少量 ,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴
,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴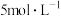 的硝酸,没有明显变化。补充该实验的目的是
的硝酸,没有明显变化。补充该实验的目的是_____________ 。
方案Ⅱ:向溶液B中通入氮气数分钟得溶液C。相同条件下,铜片与A、B、C三份溶液的反应速率: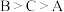 ,该实验能够证明假设2成立的理由是
,该实验能够证明假设2成立的理由是_________________ 。
③查阅资料: 溶于水可以生成
溶于水可以生成 和
和___________________ 。
向盛有铜片的溶液A中加入,铜片上立即产生气泡,实验证明 对该反应也有催化作用。
对该反应也有催化作用。
结论: 和
和 均对Cu与
均对Cu与 的反应有催化作用。
的反应有催化作用。
(2)试从结构角度解释 在金属表面得电子的能力强于
在金属表面得电子的能力强于 的原因
的原因________________ 。
(3)Cu与稀硝酸反应中 参与的可能催化过程如下。将ii补充完整。
参与的可能催化过程如下。将ii补充完整。
i.
ii.______________________
iii.
(4)探究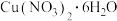 的性质。
的性质。
将一定质量的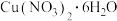 放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至
放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至 时,剩余固体质量变为原来的
时,剩余固体质量变为原来的 ,则剩余固体的化学式可能为
,则剩余固体的化学式可能为______________ 。
 反应,发现有趣的现象。室温下,
反应,发现有趣的现象。室温下, 的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
回答下列问题:
(1)探究溶液B遇铜片立即发生反应的原因。
①假设1:
实验验证:向溶液A中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2:
 对该反应有催化作用。
对该反应有催化作用。方案Ⅰ:向盛有铜片的溶液A中通入少量
 ,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴
,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴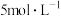 的硝酸,没有明显变化。补充该实验的目的是
的硝酸,没有明显变化。补充该实验的目的是方案Ⅱ:向溶液B中通入氮气数分钟得溶液C。相同条件下,铜片与A、B、C三份溶液的反应速率:
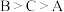 ,该实验能够证明假设2成立的理由是
,该实验能够证明假设2成立的理由是③查阅资料:
 溶于水可以生成
溶于水可以生成 和
和向盛有铜片的溶液A中加入,铜片上立即产生气泡,实验证明
 对该反应也有催化作用。
对该反应也有催化作用。结论:
 和
和 均对Cu与
均对Cu与 的反应有催化作用。
的反应有催化作用。(2)试从结构角度解释
 在金属表面得电子的能力强于
在金属表面得电子的能力强于 的原因
的原因(3)Cu与稀硝酸反应中
 参与的可能催化过程如下。将ii补充完整。
参与的可能催化过程如下。将ii补充完整。i.

ii.
iii.

(4)探究
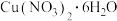 的性质。
的性质。将一定质量的
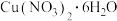 放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至
放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至 时,剩余固体质量变为原来的
时,剩余固体质量变为原来的 ,则剩余固体的化学式可能为
,则剩余固体的化学式可能为
您最近一年使用:0次
2020-11-24更新
|
675次组卷
|
2卷引用:山东省临沂市2021届高三上学期期中考试化学试题
名校
5 . 控制变量思想在探究实验中有重要应用,下列实验对影响化学反应速率的因素进行探究。
Ⅰ.催化剂对速率的影响
探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2 mL 5%的H2O2溶液,再向其中分别滴入1 mL浓度均为0.1 mol·L-1 的FeCl3溶液和CuSO4溶液。
(1)H2O2分解的化学方程式是_____ 。
(2)有同学建议将CuSO4改为CuCl2溶液,理由是______ ;还有同学认为即使改用了 CuCl2溶液,仍不严谨,建议补做对比实验:向2 mL 5%的H2O2溶液中滴入的试剂及其用量是____ 。
Ⅱ.浓度对速率的影响
实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
(3)配平下列化学方程式:
____ KMnO4+____ H2C2O4+____ =____ K2SO4+____ MnSO4+____ CO2↑+____ H2O
(4)实验1中t min 时溶液褪色,用草酸表示的反应速率v(H2C2O4)=___ mol·L-1· min-1。
联系实验1、2,预期结论是_________ 。
(5)n(CO2)随时间的变化如下图1所示,其变化的原因是________ 。

(6)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是_______ 。
Ⅰ.催化剂对速率的影响
探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2 mL 5%的H2O2溶液,再向其中分别滴入1 mL浓度均为0.1 mol·L-1 的FeCl3溶液和CuSO4溶液。
(1)H2O2分解的化学方程式是
(2)有同学建议将CuSO4改为CuCl2溶液,理由是
Ⅱ.浓度对速率的影响
实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
| 实验1 | 实验2 | |
| 试剂1 | 2 mL 0.1mol·L-1的草酸溶液 | 2 mL 0.2mol·L-1的草酸溶液 |
| 试剂2 | 4 mL 0.01 mol·L-1的高锰酸钾酸性溶液 | 4 mL 0.01 mol·L-1的高锰酸钾酸性溶液 |
(3)配平下列化学方程式:
(4)实验1中t min 时溶液褪色,用草酸表示的反应速率v(H2C2O4)=
联系实验1、2,预期结论是
(5)n(CO2)随时间的变化如下图1所示,其变化的原因是

(6)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是
您最近一年使用:0次
2020-11-16更新
|
374次组卷
|
3卷引用:四川省成都七中2020-2021学年度高二上学期期中考试化学试题
11-12高二·安徽安庆·阶段练习
名校
解题方法
6 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________ 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_____________________ 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。______________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_____________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液 颜色褪至无色 所需时间/min | |||
| 0.6 mol · L-1 H2C2O4溶液 | H2O | 0.2 mol · L-1 KMnO4溶液 | 3 mol · L-1 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
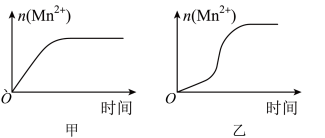
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2020-10-12更新
|
155次组卷
|
11卷引用:【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题
【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题(已下线)2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时1 化学反应的速率安徽省黄山市屯溪第一中学、中科大附中2020-2021学年高一下学期期中联考化学试题黑龙江省哈尔滨市宾县一中2020-2021学年高一下学期第二次月考化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)福建省福州重点中学2022-2023学年高一下学期期中考试化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一下学期第一次月考化学试题B卷
解题方法
7 . 为探究影响化学反应速率的因素,某研究小组设计了如下五个实验。按要求回答下列问题 (已知:Cu2+、Fe3+对H2O2的分解起催化作用) 。
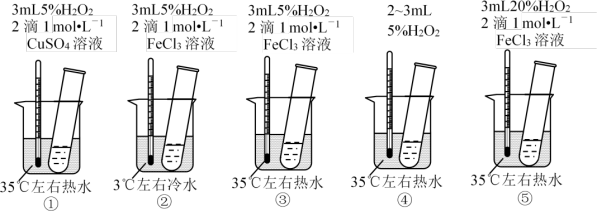
(1)为探究温度对化学反应速率的影响,应选择实验___________ (填序号,下同) ,选择的依据是_______________________ 。
(2)为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验___________ 。
(3)通过观察发现实验⑤比实验③现象明显,其原因是____________________ 。
(4)根据上述实验,用H2O2快速制取少量O2,可采取的三条措施为___________ 。

(1)为探究温度对化学反应速率的影响,应选择实验
(2)为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验
(3)通过观察发现实验⑤比实验③现象明显,其原因是
(4)根据上述实验,用H2O2快速制取少量O2,可采取的三条措施为
您最近一年使用:0次
8 . 过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。回答下列问题:
(1)室温下,过氧化氢的Ka1=2.24×10-12,则H2O2的酸性________ H2O(填“>”“<”或“=”),H2O2的一级电离方程式为________ 。
(2)研究表明,过氧化氢溶液中c(HO )越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是
)越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是________ 。

(3)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见表:
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是________ ;储运过氧化氢时,可选用的容器材质为________ (填序号)。
A.不锈钢 B.黄铜 C.纯铝 D.铸铁
(1)室温下,过氧化氢的Ka1=2.24×10-12,则H2O2的酸性
(2)研究表明,过氧化氢溶液中c(HO
 )越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是
)越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是
(3)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见表:
| 离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% |
| 无 | — | 2 | Fe3+ | 1.0 | 15 |
| Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
| Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是
A.不锈钢 B.黄铜 C.纯铝 D.铸铁
您最近一年使用:0次
9 . 某小组同学查到一份研究过氧化氢溶液与氢碘酸(HI)反应的实验资料,具体如下:
资料1:室温下,过氧化氢溶液可与氢碘酸(HI)反应,溶液为棕黄色。
资料2:实验数据如下表所示。
(1)过氧化氢溶液与氢碘酸(HI)反应的化学方程式为__________ 。
(2)实验1、2、3研究__________ 对反应速率的影响,结论是__________ 。
(3)该组同学对编号4、5的实验分别升高不同温度,发现升高温度较小的一组,棕黄色出现加快,升高温度较大的一组,棕黄色出现反而变慢,可能的原因__________ 。
(4)该小组同学用碘化钾替代氢碘酸验证上述实验。在实验过程中,未观察到溶液变为棕黄色,却观察到产生无色气体。于是,该小组同学提出假设:KI可能是过氧化氢分解反应的催化剂(实验室提供KI溶液),并设计如下实验验证其假设。
实验步骤:
I.取2支试管,向试管1中加入2mL 0.1mol·L-1 H2O2溶液、lmLKI溶液,向试管2中加入……
II.分别将2支试管置于40℃水浴中。
①试管2中应加入的试剂是__________ 。
②实验现象证明该小组同学假设成立,该实验现象是__________ 。
资料1:室温下,过氧化氢溶液可与氢碘酸(HI)反应,溶液为棕黄色。
资料2:实验数据如下表所示。
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| 实验条件 | 保持298K,101kPa条件下,取相同体积的H2O2和HI溶液 | ||||
| c(H2O2)/mol/L | 0.1 | 0.1 | 0.1 | 0.3 | 0.3 |
| c(HI)/mol/L | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 出现棕黄色时间/s | 13.1 | 6.5 | 4.3 | 4.4 | 4.4 |
(2)实验1、2、3研究
(3)该组同学对编号4、5的实验分别升高不同温度,发现升高温度较小的一组,棕黄色出现加快,升高温度较大的一组,棕黄色出现反而变慢,可能的原因
(4)该小组同学用碘化钾替代氢碘酸验证上述实验。在实验过程中,未观察到溶液变为棕黄色,却观察到产生无色气体。于是,该小组同学提出假设:KI可能是过氧化氢分解反应的催化剂(实验室提供KI溶液),并设计如下实验验证其假设。
实验步骤:
I.取2支试管,向试管1中加入2mL 0.1mol·L-1 H2O2溶液、lmLKI溶液,向试管2中加入……
II.分别将2支试管置于40℃水浴中。
①试管2中应加入的试剂是
②实验现象证明该小组同学假设成立,该实验现象是
您最近一年使用:0次
2020-08-04更新
|
211次组卷
|
2卷引用:山东省菏泽市2019-2020学年高一下学期期中考试 化学试题(B)
解题方法
10 . I、下图为汽车尾气处理系统中“三元催化”的工作原理,NO和CO在催化剂作用下生成无污染性物质的方程式2NO+2CO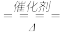 N2+2CO2。
N2+2CO2。
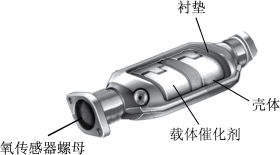
某课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)实验编号②的实验目的为_______ 。
(2)课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是________ 。
II、某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
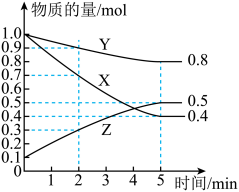
(1)该反应的化学方程式是______ 。
(2)该反应达到平衡状态的标志是______ (填字母)。
A. Y的体积分数在混合气体中保持不变
B. X、Y的反应速率比为3:1
C. 容器内气体压强保持不变
D. 容器内气体的总质量保持不变
E. 生成1 mol Y的同时消耗2 mol Z
(3)2~5min内用X表示的化学反应速率为_____ 。
 N2+2CO2。
N2+2CO2。
某课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 同种催化剂的比表面积/m2·g-1 | c(CO)不变时所用的时间/min |
① | 参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
② | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
③ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(2)课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是
II、某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

(1)该反应的化学方程式是
(2)该反应达到平衡状态的标志是
A. Y的体积分数在混合气体中保持不变
B. X、Y的反应速率比为3:1
C. 容器内气体压强保持不变
D. 容器内气体的总质量保持不变
E. 生成1 mol Y的同时消耗2 mol Z
(3)2~5min内用X表示的化学反应速率为
您最近一年使用:0次



