(1)某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。按照如表方案完成实验。
| 实验编号 | 反应物 | 操作 |
| ① | 10mL2%H2O2溶液和10mL5%H2O2溶液 | 同时放入80℃的热水浴中 |
| ② | 10mL5%H2O2溶液+1mLH2O | 加1mL0.1mol·L-1FeCl3溶液 |
| ③ | 10mL5%H2O2溶液+1mLHCl溶液 | 加1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+1mLNaOH溶液 | 加1mL0.1mol·L-1FeCl3溶液 |
②实验②、③、④中,测得生成氧气的体积随时间变化如图所示。分析该图能够得出的实验结论是

(2) MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。将状态不同的MnO2分别加入盛有等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如表所示:
| MnO2状态 | 触摸试管情况 | 观察结果 | 反应完成所需时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 4min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与
③实验过程中在粉末状催作用下放出气体的体积(标准状况)和时间的关系如图所示,反应速率逐渐变慢的原因是

(1)反应Ⅱ:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1;对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2
(2)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+=S↓+2I2+2H2O
ⅱ.I2+2H2O+
(3)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如表:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI,0.2mol·L-1 H2SO4 | 0.2mol·L-1H2SO4 | 0.2 mol·L-1 KI,0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
(1)工业上合成氨的反应为N2(g)+3H2(g)⇌2NH3(g) ∆H= -92.2 kJ/mol,反应过程中能量变化如图所示。

①反应2NH3(g)⇌N2(g)+3H2(g)的活化能为
②合成氨时加入铁粉可以加快生成NH3的速率,在图中画出加入铁粉后的能量变化曲线
(2)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
①CH4- CO2催化重整反应为CH4(g)+CO2(g)=2CO(g) +2H2(g) ∆H=+247 kJ·mol-1
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,5 min达到平衡时CO2的转化率是50%。0-5 min平均反应速率v(CO)=
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ∆H/(kJ ·mol-1) | 75 | 172 | |
| 活化能/ (kJ· mol-1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
| 实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c(mol/L) | V/mL | c(mol/L) | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | 293 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(2)若t1<8,则由此实验可以得出的结论是
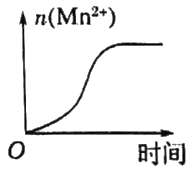
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊的作用,则该作用是
5 . 对H2O2的分解速率影响因素进行研究。
(1) A组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| A | B | C |
10%H2O2/mL | 20.0 | V1 | V2 |
2 mol/LFeCl3/mL | 0 | 5.0 | 10.0 |
H2O/mL | V3 | V4 | 0 |
按要求回答下列问题:
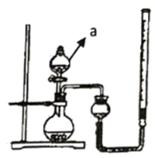
①a装置的名称为
②若读数时发现,量气装置左端液面低于右端液面,则测得的气体体积
(2) B组在相同的温度下,利用下图甲装置对H2O2在不同条件下的分解速率进行了探究,得到乙曲线:
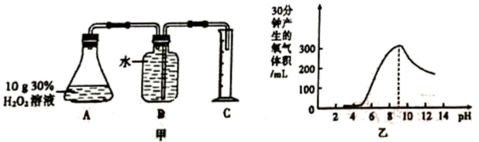
则B小组探究的是
(3)C小组利用如下装置探究100℃,H2O2在不同离子催化作用下反应24h的分解率,

实验编号 | 离子 | 加入量/(mg/L) | 分解率/% |
① | 无 | — | 2 |
② | Al3+ | 1.0 | 2 |
③ | Fe3+ | 1.0 | 15 |
④ | Cu2+ | 0.1 | 86 |
⑤ | Cr3+ | 0.1 | 96 |
则该小组实验时记录的数据应该是
(1)工业上合成氨气的反应为N2(g)+3H2(g)
 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。①合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是

②合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步(慢反应)N2(g)→2N*;H2(g)→2H*
第二步(快反应)N*+H*
 NH*;NH*+H*
NH*;NH*+H*
 ;
; +H*
+H*
第三步(快反应)
 NH3(g)
NH3(g)比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1
(2)工业上合成尿素的反应为2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(l) ΔH<0,在恒定温度下,将NH3(g)和CO2(g)按物质的量之比2:1充入一体积为10L的密闭容器中(假设反应过程中容器体积不变,生成物的体积忽略不计),经20min达到平衡,NH3和CO2的浓度变化曲线如图所示。
CO(NH2)2(1)+H2O(l) ΔH<0,在恒定温度下,将NH3(g)和CO2(g)按物质的量之比2:1充入一体积为10L的密闭容器中(假设反应过程中容器体积不变,生成物的体积忽略不计),经20min达到平衡,NH3和CO2的浓度变化曲线如图所示。
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2,则此时v正
②若保持平衡时的温度和体积不变,25min时再向容器中充入2molNH3和1molCO2在40min时重新达到平衡,请在上图中画出25~50nin内NH3的浓度变化曲线
(3)已知液氨中存在平衡2NH3

 +
+ 。以金属氨基化合物(如KNH2)作为电解质电解液氨制氢的工作原理如图所示。
。以金属氨基化合物(如KNH2)作为电解质电解液氨制氢的工作原理如图所示。
①电极X是
②图中阳极的电极反应式为
③若图中电解质改用NH4Cl,则阴极的电极反应式为
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液 颜色褪至无色 所需时间/min | |||
| 0.6 mol · L-1 H2C2O4溶液 | H2O | 0.2 mol · L-1 KMnO4溶液 | 3 mol · L-1 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
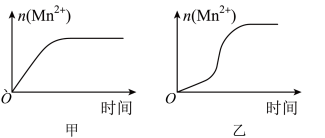
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是
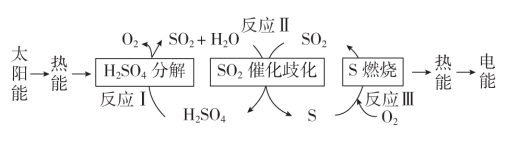
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
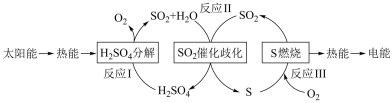
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为
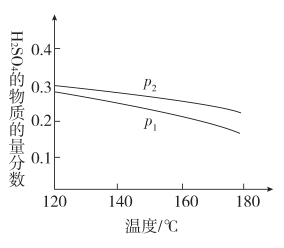
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是

A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
| 达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
| n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2的次数对 HI 转化率的影响
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌
 (aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中 的物质的量 n( I3- )随反应时间 t 变化的曲线图
的物质的量 n( I3- )随反应时间 t 变化的曲线图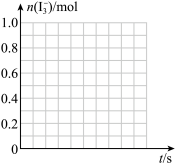
(1)KI溶液可作为H2O2分解反应的催化剂,催化过程按以下两步反应进行:
Ⅰ.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) ΔH1=+bkJ·mol-1(b>0)
Ⅱ.
①请将上述过程补充完整(提示:反应Ⅱ不是分解反应)。
②已知:相同条件下,反应Ⅰ的反应速率小于反应Ⅱ的反应速率。如图为未加催化剂时H2O2分解反应的能量-反应历程示意图,请在图中画出加入KI溶液后该反应的能量-反应历程示意图

(2)H2O2的水溶液呈弱酸性,其电离过程如下:H2O2⇌H++HO2-;HO2-⇌H++O22-
某温度下,其电离平衡常数K1=1.1×10-11,则质量分数为30%(物质的量浓度为10mol·L-1)的H2O2水溶液的pH≈
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度
 ,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是
,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是A.
 B.
B.
C.
 D.
D.
(一)天然气与氮气为原料,以固态质子交换膜为电解质,在低温常压下通过电解原理制备氨气如图所示:
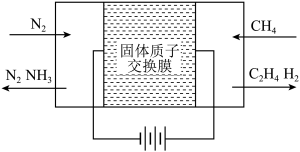
写出在阴极表面发生的电极反应式:
(二)天然气为原料合成氨技术简易流程如下:
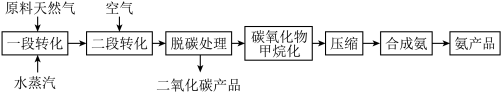
一段转化主要发生的反应如下:
①CH4(g) +H2O(g)
 CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1②CO(g) + H2O(g)
 CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1二段转化主要发生的反应如下:
③2CH4(g)+ O2(g)
 2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1④2CO(g) + O2(g)
 2CO2(g) ΔH4 = -282 kJ·molˉ1
2CO2(g) ΔH4 = -282 kJ·molˉ1(1)已知CO中不含C=O,H-H的键能为436 kJ·molˉ1,H-O的键能为463 kJ·molˉ1,C-H的键能为414 kJ·molˉ1,试计算C=O的键能
(2)实验室模拟一段转化过程,在800oC下,向体积为1L的恒容密闭反应器中,充入1mol的CH4与1mol的H2O,达到平衡时CH4的转化率为40%,n(H2)为1.4mol,请计算反应②的平衡常数
(3)下列说法正确的是
A.合成氨过程实际选择的温度约为700℃,温度过高或过低都会降低氨气平衡产率
B.上述工业流程中压缩既能提高反应速率又能提高合成氨的产率
C.二段转化释放的热量可为一段转化提供热源,实现能量充分利用
D.二段转化过程中,需严格控制空气的进气量,否则会破坏合成气中的氢氮比
(4)已知催化合成氨中催化剂的活性与催化剂的负载量、催化剂的比表面积和催化反应温度等因素有关,如图所示:
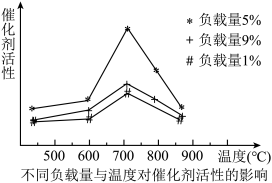
①实验表明相同温度下,负载量5%催化剂活性最好,分析负载量9%与负载量1%时,催化剂活性均下降的可能原因是
②在上图中用虚线作出负载量为3%的催化剂活性变化曲线




