1 . 已知2H2O(l)=2H2(g)+O2(g) ∆H=+571.0 kJ·mol-1,两步热循环制H2的过程如图。下列说法正确的是
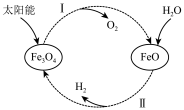
过程I:2Fe3O4(s)=6FeO(s)+O2(g) ∆HⅠ =+604.8 kJ·mol-1
过程II:H2O(l)+3FeO(s)=Fe3O4(s)+H2(g) ∆H II

过程I:2Fe3O4(s)=6FeO(s)+O2(g) ∆HⅠ =+604.8 kJ·mol-1
过程II:H2O(l)+3FeO(s)=Fe3O4(s)+H2(g) ∆H II
| A.该制氢过程中FeO为催化剂 |
| B.整个过程中能量转化形式只存在太阳能转化为化学能 |
| C.过程II在任何温度下均为自发反应 |
| D.根据盖斯定律∆H I+∆H II=0 |
您最近一年使用:0次
2023-11-12更新
|
369次组卷
|
2卷引用:四川省成都市第七中学2023-2024学年高二上学期期中考试化学试题
名校
2 . 下列关于有效碰撞理论的说法一定正确的是
| A.活化分子之间发生的碰撞一定是有效碰撞 |
| B.增大压强,反应的有效碰撞次数增多,反应速率加快 |
| C.升高温度,反应的活化能降低,反应速率加快 |
| D.使用催化剂,单位体积内活化分子数增多,反应速率加快 |
您最近一年使用:0次
2023-11-10更新
|
59次组卷
|
2卷引用:四川省南充市嘉陵第一中学2023-2024学年高二上学第三次月考化学试题
3 . 目前,常用三元催化将汽车尾气中NO和CO转化为CO2和N2。在密闭容器中模拟进行如下反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
(1)增加CO的浓度,平衡向_______ 移动,该反应的平衡常数K_______ 。
(2)保持反应容器压强和温度不变,通入He,平衡向_______ 移动,该化学反应速率_______ ,该反应的△H_______ 。
(3)在一定温度下,缩小反应容器体积,平衡向_______ 移动,NO(g)的转化率_______ 。
(4)使用相同质量的同种催化剂,增大催化剂的比表面积,平衡_______ 移动,该化学反应速率将_______ 。
 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。(1)增加CO的浓度,平衡向
(2)保持反应容器压强和温度不变,通入He,平衡向
(3)在一定温度下,缩小反应容器体积,平衡向
(4)使用相同质量的同种催化剂,增大催化剂的比表面积,平衡
您最近一年使用:0次
2023-11-05更新
|
262次组卷
|
2卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
4 . NO2、NO是大气污染物的主要成分,NH3催化还原氨氧化物(SCR)技术可有效降低柴油发动机的氯氧化物排放,其原理为(均省略加热条件):

4NH3+2NO+O2 3N2+6H2O
3N2+6H2O
4NH3+4NO+O2 4N2+6H2O
4N2+6H2O
氨气由尿素提供,其反应如下:
CO(NH2)2+H2O=2NH3↑+CO2↑
已知:①氨气在高温下能够和氧气反应生成N2及氧化合物(NOx);
②NH3催化还原氢氧化物的反应均是放热反应;
③催化剂对灰尘、杂质气体较敏感。
下列有关尾气治理的说法,错误的是

4NH3+2NO+O2
 3N2+6H2O
3N2+6H2O4NH3+4NO+O2
 4N2+6H2O
4N2+6H2O氨气由尿素提供,其反应如下:
CO(NH2)2+H2O=2NH3↑+CO2↑
已知:①氨气在高温下能够和氧气反应生成N2及氧化合物(NOx);
②NH3催化还原氢氧化物的反应均是放热反应;
③催化剂对灰尘、杂质气体较敏感。
下列有关尾气治理的说法,错误的是
| A.进行柴油除硫,既可减少SOx排放,又可避免催化剂失效 |
| B.为了提高尾气治理的效率,可以研制更加高效的催化剂 |
| C.为了提高尾气治理的反应速率和除杀效果,应尽量在高温下进行除氨反应 |
| D.氧气(空气)适当过量,除NOx更经济 |
您最近一年使用:0次
2023-11-03更新
|
98次组卷
|
2卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
解题方法
5 . 下列装置能达到对应实验目的的是


| A.可根据最终气球的大小判断反应速率的大小 |
B.探究温度对[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O平衡的影响 [CuCl4]2-+4H2O平衡的影响 |
| C.探究KMnO4浓度对化学反应速率的影响 |
D.探究浓度对Fe3++3SCN- Fe(SCN)3平衡的影响 Fe(SCN)3平衡的影响 |
您最近一年使用:0次
2023-11-03更新
|
274次组卷
|
2卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
名校
6 . 下列说法不能用勒夏特列原理解释的是
| A.实验室用排饱和食盐水法收集氯气 | B.振摇后打开可乐瓶盖,观察到大量气泡产生 |
| C.工业合成SO3选用V2O5作催化剂 | D.棕红色NO2加压后颜色先变深后变浅 |
您最近一年使用:0次
2023-11-03更新
|
209次组卷
|
3卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
名校
7 . 2022年3月4日,中国科学院大连化学物理研究所开发的全球首套1000吨/年二氧化碳加氢制汽油中试装置,在山东邹城工业园区开车成功,生产出符合国VI标准的清洁汽油,这有助于我国在2030年前实现碳达峰。回答下列问题:
(1)CO2催化加氢制取汽油时,CO2的转化过程如图1:
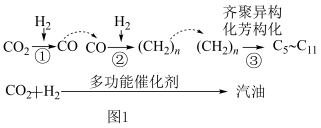
下列对该反应过程的说法正确的是________ (填标号)。
(2)写出反应①的化学方程式_______ 。
(3)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃可能是______ (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在恒温恒容的密闭容器中,充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下列能说明反应达到平衡状态的是
CH3OH(g)+H2O(g),下列能说明反应达到平衡状态的是______ (填字母)
A.混合气体密度保持不变
B.混合气体的平均相对分子质量不变
C.CO2和H2的体积比保持不变
D.断裂2mol碳氧双键的同时生成3molH-H键
(4)催化剂通过参与反应,改变反应的途径,降低反应活化能,加快化学反应速率,反应的热效应△H______ (填“减小”、“增大”或“不变”)。
(5)已知CO2甲烷化技术的反应原理为CO2(g)+4H2(g) CH4(g)+2H2O(g) △H<0,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和CH4选择性(选择性是指产生这个物质所消耗的反应物的量占总的反应物的量的比例大小)随温度变化的曲线如图2所示。
CH4(g)+2H2O(g) △H<0,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和CH4选择性(选择性是指产生这个物质所消耗的反应物的量占总的反应物的量的比例大小)随温度变化的曲线如图2所示。
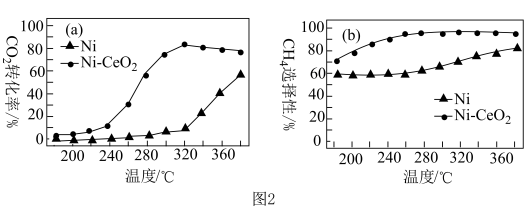
以Ni为催化剂,高于320℃后,单位时间内CO2转化率上升的原因是______ ,工业上应选择的催化剂是______ 。
(1)CO2催化加氢制取汽油时,CO2的转化过程如图1:

下列对该反应过程的说法正确的是
| A.整个反应过程中,有非极性键和极性键的断裂和形成 |
B.CO2的电子式为 ,为非极性分子 ,为非极性分子 |
| C.汽油为纯净物 |
| D.①②反应一定有水生成 |
(2)写出反应①的化学方程式
(3)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃可能是
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在恒温恒容的密闭容器中,充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),下列能说明反应达到平衡状态的是
CH3OH(g)+H2O(g),下列能说明反应达到平衡状态的是A.混合气体密度保持不变
B.混合气体的平均相对分子质量不变
C.CO2和H2的体积比保持不变
D.断裂2mol碳氧双键的同时生成3molH-H键
(4)催化剂通过参与反应,改变反应的途径,降低反应活化能,加快化学反应速率,反应的热效应△H
(5)已知CO2甲烷化技术的反应原理为CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H<0,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和CH4选择性(选择性是指产生这个物质所消耗的反应物的量占总的反应物的量的比例大小)随温度变化的曲线如图2所示。
CH4(g)+2H2O(g) △H<0,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和CH4选择性(选择性是指产生这个物质所消耗的反应物的量占总的反应物的量的比例大小)随温度变化的曲线如图2所示。
以Ni为催化剂,高于320℃后,单位时间内CO2转化率上升的原因是
您最近一年使用:0次
名校
8 . 甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成CO和H2O无、有催化剂条件下的能量与反应历程的关系分别如图1、图2所示。下列说法错误的是
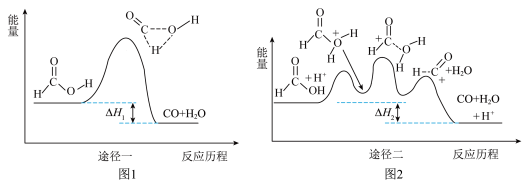

| A.途径一和途径二中甲酸的平衡转化率相等 |
| B.ΔH1<ΔH2<0 |
| C.途径二使用了H+作为催化剂 |
D.途径二反应的快慢由生成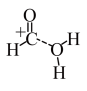 的速率决定 的速率决定 |
您最近一年使用:0次
2023-11-01更新
|
403次组卷
|
5卷引用:四川省德阳市第五中学2023-2024学年高三上学期期中考试化学试题
名校
9 . NO的治理是当前生态环境保护中的重要课题之一,某含CeO₂的催化剂(含 Ce化合物的比例系数均未标定)的作用机理如图所示。下列说法错误的是
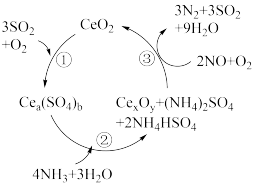

| A.NO可以造成臭氧空洞 |
| B.在反应机理②中,Ce元素的化合价升高 |
| C.加入催化剂能降低反应的活化能,加快反应速率 |
| D.整个反应中被氧化的非金属元素为S和 N |
您最近一年使用:0次
2023-10-31更新
|
208次组卷
|
4卷引用:四川省德阳市第五中学2023-2024学年高三上学期12月月考化学试题
名校
10 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,回答下列问题:
(1)通过实验A、B,可探究___________ 的改变对反应速率的影响,其中
___________ ,T1=___________ ;通过实验___________ (填序号)可探究出温度变化对化学反应速率的影响。
(2)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。(保留2位有效数字)
(3)写出该反应的离子方程式___________ 。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
①结合实验目的与表中数据,你得出的结论是___________ 。
②从影响化学反应速率的因素看,你认为还可能是___________ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是___________ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
| 实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol/L | V/mL | c/mol/L | V/mL | |||
| A | 293 | 20 | 0.2 | 40 | 1 | 0 | t1 |
| B | T1 | 20 | 0.2 | 30 | 1 | V1 | 8 |
| C | 313 | 20 | 0.2 | V2 | 1 | 0 | t2 |

(2)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)写出该反应的离子方程式
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| 温度/℃ | 20 | 21 | 21 | 21.5 | 22 | 22 |
②从影响化学反应速率的因素看,你认为还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
您最近一年使用:0次
2023-10-30更新
|
243次组卷
|
2卷引用:四川省内江市第二中学2023-2024学年高二上学期第一次月考化学试题



