解题方法
1 . 合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
常温下,大气固氮的倾向______ 工业固氮(填“大于”或“小于”)。
(2)N2(g)与H2(g)反应的能量变化如图所示。
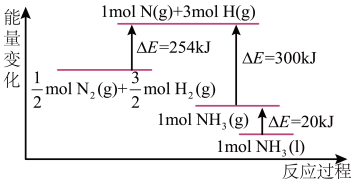
则N2(g)与H2(g)制备NH3(l)的热化学方程式为__________________ 。
(3)T ℃时,在 2 L恒容密闭容器中加入 1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)⇌2NH3(g)],体系中n(NH3)随时间的变化如图。
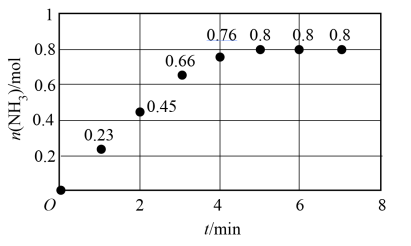
①前2分钟内的平均反应速率v(NH3)=______ mol·L-1·min-1。
②下列情况能说明该反应已达到平衡状态的是______ (选填序号)。
A.混合气体的密度不变
B.单位时间内断裂n mol N—H键的同时形成n mol H—H键
C.容器内的总压强不再变化
D.3v 正(H2)=2v 逆(NH3)
③有关工业固氮的说法正确的是______ (选填序号)。
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
④T ℃时,该反应的平衡常数为______ 。
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol·min-1)与催化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是______ (填化学式)。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)⇌2NO(g) | 工业固氮N2(g)+3H2(g)⇌2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数(K) | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g)反应的能量变化如图所示。

则N2(g)与H2(g)制备NH3(l)的热化学方程式为
(3)T ℃时,在 2 L恒容密闭容器中加入 1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)⇌2NH3(g)],体系中n(NH3)随时间的变化如图。

①前2分钟内的平均反应速率v(NH3)=
②下列情况能说明该反应已达到平衡状态的是
A.混合气体的密度不变
B.单位时间内断裂n mol N—H键的同时形成n mol H—H键
C.容器内的总压强不再变化
D.3v 正(H2)=2v 逆(NH3)
③有关工业固氮的说法正确的是
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
④T ℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol·min-1)与催化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近一年使用:0次
2020-09-28更新
|
174次组卷
|
2卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
解题方法
2 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1) 转化为
转化为 有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
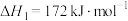 ,
,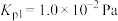
(ⅱ)碳氯化:
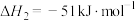 ,
,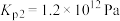
①反应 的
的 为
为________  。
。
②运用以上数据分析,你认为以上两种方法更优越的是__________ ,理由_________________ 。
(2)在压强为170kPa恒压作用下,将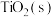 、
、 、
、 以物质的量之比为
以物质的量之比为 进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数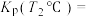
________  (分压
(分压 物质的量分数
物质的量分数 总压)。
总压)。
②图中显示,在T1℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是___________ 。
(1)
 转化为
转化为 有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
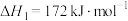 ,
,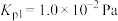
(ⅱ)碳氯化:

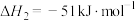 ,
,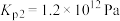
①反应
 的
的 为
为 。
。②运用以上数据分析,你认为以上两种方法更优越的是
(2)在压强为170kPa恒压作用下,将
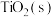 、
、 、
、 以物质的量之比为
以物质的量之比为 进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。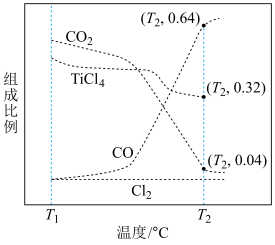
 的平衡常数
的平衡常数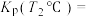
 (分压
(分压 物质的量分数
物质的量分数 总压)。
总压)。②图中显示,在T1℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
您最近一年使用:0次
名校
解题方法
3 . 金属钪可用作宇航材料、火箭和飞机的制造材料;氧化钪可提高计算机记忆元件性能。铝土矿(主要成分 )经碱初步溶解后得到的赤泥含有丰富的钪元素,另含少量CaO、
)经碱初步溶解后得到的赤泥含有丰富的钪元素,另含少量CaO、 、
、 、
、 等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示,已知:P2O4(磷酸酯浸取剂)是一种酸性萃取剂。
等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示,已知:P2O4(磷酸酯浸取剂)是一种酸性萃取剂。
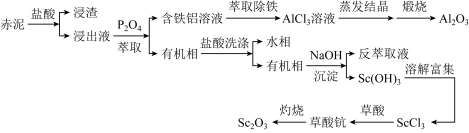
回答下列问题:
(1)写出铝土矿经碱初步溶解时所发生的主要离子方程式:_____ 。
(2)写出赤泥经盐酸处理后所得“浸渣”的一种用途:_____ 。
(3)反萃取时, 完全沉淀(浓度为
完全沉淀(浓度为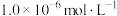 )时,反萃取液的pH为
)时,反萃取液的pH为_____ 。(已知: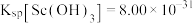 ,
, ,结果保留小数点后2位)。
,结果保留小数点后2位)。
(4)草酸钪灼烧分解在无氧环境下进行,其反应的化学方程式为_____ 。
(5)在流程中可循环使用的物质有_____ 。
 )经碱初步溶解后得到的赤泥含有丰富的钪元素,另含少量CaO、
)经碱初步溶解后得到的赤泥含有丰富的钪元素,另含少量CaO、 、
、 、
、 等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示,已知:P2O4(磷酸酯浸取剂)是一种酸性萃取剂。
等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示,已知:P2O4(磷酸酯浸取剂)是一种酸性萃取剂。
回答下列问题:
(1)写出铝土矿经碱初步溶解时所发生的主要离子方程式:
(2)写出赤泥经盐酸处理后所得“浸渣”的一种用途:
(3)反萃取时,
 完全沉淀(浓度为
完全沉淀(浓度为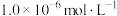 )时,反萃取液的pH为
)时,反萃取液的pH为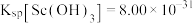 ,
, ,结果保留小数点后2位)。
,结果保留小数点后2位)。(4)草酸钪灼烧分解在无氧环境下进行,其反应的化学方程式为
(5)在流程中可循环使用的物质有
您最近一年使用:0次
名校
解题方法
4 . 铬元素及其化合物在生产、生活中具有广泛的用途。醋酸亚铬水合物{[Cr(CH3COO)2]2⋅2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价络(二价铬不稳定,极易被氧气氧化)
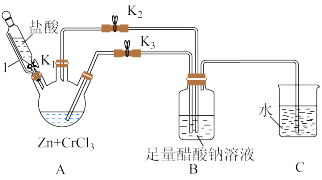
(1)仪器1的名称是___________ ,该装置的优点是 ___________ 。
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,同时还要与C装置相连___________ 。
(3)本实验中锌粒要过量,其原因除了锌与CrCl3充分反应得到CrCl2外,另一个作用是___________ 。
(4)实验中,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应___________ 阀门K2、___________ 阀门K3(填“打开”或“关闭”)。
(5)为洗涤[Cr(CH3COO)2]2⋅2H2O产品,下列方法中最适合的是 ___________。
(6)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34g,实验后得干燥纯净的[Cr(CH3COO)2]2⋅2H2O5.64g,请计算该实验所得产品的产率___________ 。

(1)仪器1的名称是
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,同时还要与C装置相连
(3)本实验中锌粒要过量,其原因除了锌与CrCl3充分反应得到CrCl2外,另一个作用是
(4)实验中,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应
(5)为洗涤[Cr(CH3COO)2]2⋅2H2O产品,下列方法中最适合的是 ___________。
| A.先用盐酸洗,后用冷水洗 |
| B.先用冷水洗,后用乙醇洗 |
| C.先用冷水洗,后用乙醚洗 |
| D.先用乙醇洗涤,后用乙醚洗 |
(6)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34g,实验后得干燥纯净的[Cr(CH3COO)2]2⋅2H2O5.64g,请计算该实验所得产品的产率
您最近一年使用:0次
名校
解题方法
5 . 钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为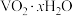 、
、 及少量的
及少量的 ,一种初步分离钒铬还原渣中的钒铬并获得
,一种初步分离钒铬还原渣中的钒铬并获得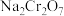 的工艺流程如图:
的工艺流程如图:
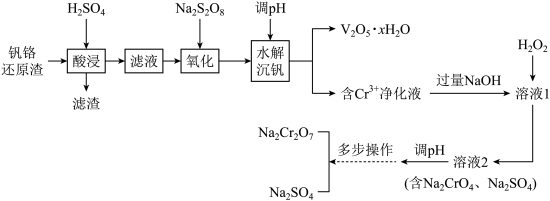
已知:①“酸浸”后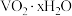 转化为
转化为 ;
;
② ;
;
③ 的
的 近似为
近似为 ;
;
④有关物质的溶解度(g/100 g )如表所示:
)如表所示:
回答下列问题:
(1)写出“滤渣”的一种用途:___________ ,“氧化”操作单元中,消耗的氧化剂与还原剂的物质的量之比为___________ 。
(2)若“含 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5
,则“水解沉钒”调pH的范围是2.5___________ 。
(3)“溶液1”中含 ,加入
,加入 后发生的化学反应方程式为
后发生的化学反应方程式为___________ 。
(4)“溶液2”调pH所发生反应的离子方程式为___________ 。
(5)“多步操作”包括蒸发结晶、趁热过滤、所得滤液冷却结晶、过滤、洗涤等步骤,其中蒸发结晶时,过度蒸发将导致___________ 。
(6)研究温度对 与
与 的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用
的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是___________ 、___________ 。
 、
、 及少量的
及少量的 ,一种初步分离钒铬还原渣中的钒铬并获得
,一种初步分离钒铬还原渣中的钒铬并获得 的工艺流程如图:
的工艺流程如图:
已知:①“酸浸”后
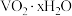 转化为
转化为 ;
;②
 ;
;③
 的
的 近似为
近似为 ;
;④有关物质的溶解度(g/100 g
 )如表所示:
)如表所示:| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
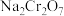 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
(1)写出“滤渣”的一种用途:
(2)若“含
 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5
,则“水解沉钒”调pH的范围是2.5(3)“溶液1”中含
 ,加入
,加入 后发生的化学反应方程式为
后发生的化学反应方程式为(4)“溶液2”调pH所发生反应的离子方程式为
(5)“多步操作”包括蒸发结晶、趁热过滤、所得滤液冷却结晶、过滤、洗涤等步骤,其中蒸发结晶时,过度蒸发将导致
(6)研究温度对
 与
与 的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用
的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是
您最近一年使用:0次
6 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
2023-06-10更新
|
18942次组卷
|
18卷引用:四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题
四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题2023年高考新课标理综化学真题(已下线)T26-工业流程题(已下线)2023年高考化学真题完全解读(新课标卷:适用安徽、云南、山西、吉林、黑龙江五省)(PPT+Word)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省滨州市2023-2024学年高三上学期11月期中考试化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建
名校
解题方法
7 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中
,其中 为+2价、
为+2价、 为+2价)制取铜和三氧化二铁的工艺流程如图所示:
为+2价)制取铜和三氧化二铁的工艺流程如图所示:
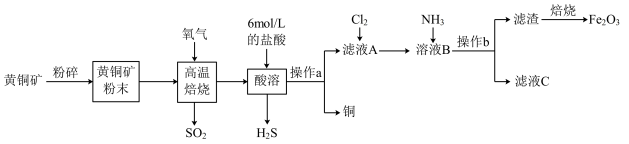
(1)将黄铜矿粉碎的目的是_______ 。
(2)高温熔烧时发生的反应是 ,当1
,当1
 参加反应时,反应中转移电子
参加反应时,反应中转移电子_______  。
。
(3)向滤液A中通入 的目的是
的目的是_______ 。
(4)向溶液B中通入 后发生反应的离子方程式为
后发生反应的离子方程式为_______ 。
(5)工业上用生物法处理 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂):

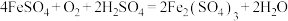
由图甲和图乙可知,使用硫杆菌的最佳条件为_______ ,若反应温度过高,反应速率下降,其原因是_______ 。

 ,其中
,其中 为+2价、
为+2价、 为+2价)制取铜和三氧化二铁的工艺流程如图所示:
为+2价)制取铜和三氧化二铁的工艺流程如图所示:
(1)将黄铜矿粉碎的目的是
(2)高温熔烧时发生的反应是
 ,当1
,当1
 参加反应时,反应中转移电子
参加反应时,反应中转移电子 。
。(3)向滤液A中通入
 的目的是
的目的是(4)向溶液B中通入
 后发生反应的离子方程式为
后发生反应的离子方程式为(5)工业上用生物法处理
 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂):
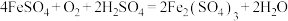
由图甲和图乙可知,使用硫杆菌的最佳条件为

您最近一年使用:0次
2022-11-22更新
|
176次组卷
|
4卷引用:四川省绵阳市南山中学实验学校2022-2023学年高二下学期2月月考化学试题
四川省绵阳市南山中学实验学校2022-2023学年高二下学期2月月考化学试题四川省德阳市第五中学校2022-2023学年高二上学期期中考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)四川省宾市叙州区第二中学校2023-2024学年高二上学期11月期中化学试题
名校
解题方法
8 . 硫酸锆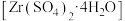 是锆化合物中用途非常广的重要产品之一,是制取原子能级锆及其它化合物的中间原料,并大量用作皮革鞣剂、羊毛处理剂、催化剂等。下面是以锆英砂(主要成分为
是锆化合物中用途非常广的重要产品之一,是制取原子能级锆及其它化合物的中间原料,并大量用作皮革鞣剂、羊毛处理剂、催化剂等。下面是以锆英砂(主要成分为 )伴有杂质(
)伴有杂质( )为原料,利用碱熔法再进行酸浸制备硫酸的工艺过程。已知
)为原料,利用碱熔法再进行酸浸制备硫酸的工艺过程。已知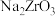 ,
,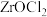 ,
, 均易溶于水,难溶于酒精,难溶于有机溶剂。
均易溶于水,难溶于酒精,难溶于有机溶剂。

(1)副产物1的化学式为______ ,在整个流程中,有一种副产物可以循环利用,该物质的化学式为______ 。
(2)步骤4中采用向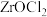 的浓溶液中加入浓硫酸很快析出白色的硫酸锆沉淀,该反应放热明显,并且浓硫酸过量可促进产品析出,请根据下图回答问题。
的浓溶液中加入浓硫酸很快析出白色的硫酸锆沉淀,该反应放热明显,并且浓硫酸过量可促进产品析出,请根据下图回答问题。


①浓硫酸过量率应该控制在80%,超过该值之后,导致浸出率下降的原因是______ 。
②反应温度低于50℃,硫酸锆的沉降率下降的原因是(请从化学平衡的角度说明)______ 。
(3)碱熔过程也可以采用纯碱和 共熔,写出此反应的化学方程式
共熔,写出此反应的化学方程式______ 。
(4)操作2的名称为______ ,步骤4所得的 最后用无水乙醇洗涤的作用是
最后用无水乙醇洗涤的作用是______ 。
(5)对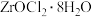 洗涤后,在800℃下灼烧可得一种用于制备压电陶瓷的原料
洗涤后,在800℃下灼烧可得一种用于制备压电陶瓷的原料 ,写出该灼烧过程的方程式
,写出该灼烧过程的方程式______ 。
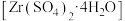 是锆化合物中用途非常广的重要产品之一,是制取原子能级锆及其它化合物的中间原料,并大量用作皮革鞣剂、羊毛处理剂、催化剂等。下面是以锆英砂(主要成分为
是锆化合物中用途非常广的重要产品之一,是制取原子能级锆及其它化合物的中间原料,并大量用作皮革鞣剂、羊毛处理剂、催化剂等。下面是以锆英砂(主要成分为 )伴有杂质(
)伴有杂质( )为原料,利用碱熔法再进行酸浸制备硫酸的工艺过程。已知
)为原料,利用碱熔法再进行酸浸制备硫酸的工艺过程。已知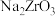 ,
,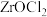 ,
, 均易溶于水,难溶于酒精,难溶于有机溶剂。
均易溶于水,难溶于酒精,难溶于有机溶剂。
(1)副产物1的化学式为
(2)步骤4中采用向
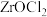 的浓溶液中加入浓硫酸很快析出白色的硫酸锆沉淀,该反应放热明显,并且浓硫酸过量可促进产品析出,请根据下图回答问题。
的浓溶液中加入浓硫酸很快析出白色的硫酸锆沉淀,该反应放热明显,并且浓硫酸过量可促进产品析出,请根据下图回答问题。

①浓硫酸过量率应该控制在80%,超过该值之后,导致浸出率下降的原因是
②反应温度低于50℃,硫酸锆的沉降率下降的原因是(请从化学平衡的角度说明)
(3)碱熔过程也可以采用纯碱和
 共熔,写出此反应的化学方程式
共熔,写出此反应的化学方程式(4)操作2的名称为
 最后用无水乙醇洗涤的作用是
最后用无水乙醇洗涤的作用是(5)对
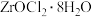 洗涤后,在800℃下灼烧可得一种用于制备压电陶瓷的原料
洗涤后,在800℃下灼烧可得一种用于制备压电陶瓷的原料 ,写出该灼烧过程的方程式
,写出该灼烧过程的方程式
您最近一年使用:0次
9 . 绿矾是含有一定量结晶水的硫酸亚铁[FeSO4·xH2O],在工农业生产中具有重要的用途。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备绿矾,具体流程如图:

(1)步骤①需要加热,温度保持80~95℃,采用的合适加热方式是___ 。
(2)铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为___ (填标号)。
(3)为检验步骤②是否反应完成,可选用的化学试剂是____ 。
(4)为测定绿矾中结晶水含量、将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置A称重,记为bg。按如图连接好装置进行实验。
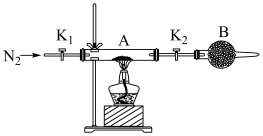
①仪器B的作用是___ 。
②打开K1和K2,缓缓通入N2,加热,直至A恒重,记为cg。根据实验记录,计算绿矾化学式中结晶水数目x=___ (列计算式)。
(5)为探究硫酸亚铁的分解产物,将(4)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入,加热,产生两种酸性气体。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为____ 、___ (填标号)。
a.浓H2SO4 b.品红 c.NaOH d.BaCl2 e.Ba(NO3)2
②写出FeSO4·xH2O高温分解反应的化学方程式___ 。

(1)步骤①需要加热,温度保持80~95℃,采用的合适加热方式是
(2)铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为
A. | B. | C. | D. |
(4)为测定绿矾中结晶水含量、将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置A称重,记为bg。按如图连接好装置进行实验。

①仪器B的作用是
②打开K1和K2,缓缓通入N2,加热,直至A恒重,记为cg。根据实验记录,计算绿矾化学式中结晶水数目x=
(5)为探究硫酸亚铁的分解产物,将(4)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入,加热,产生两种酸性气体。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.浓H2SO4 b.品红 c.NaOH d.BaCl2 e.Ba(NO3)2
②写出FeSO4·xH2O高温分解反应的化学方程式
您最近一年使用:0次
名校
10 . 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述错误的是
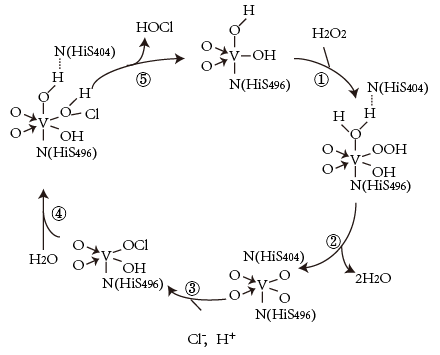

| A.H2O参与了该催化反应 |
| B.过程①中反应的原子利用率为100% |
| C.该催化循环过程中有氢氧键的断裂和形成 |
| D.每次循环的净反应为H2O2+2C1-=2HOCl+2e- |
您最近一年使用:0次
2021-04-24更新
|
1619次组卷
|
16卷引用:新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题
新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题江西省宜春市上高二中2021-2022学年高三下学期第十次月考(5月)理综化学试题江西省南昌十九中2023-2024学年高三上学期第一次月考化学试卷 安徽省皖南八校2021届高三4月第三次联考理综化学试题(已下线)押山东卷第13题 陌生反应机理选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)2021年高考化学押题预测卷(山东卷)03(含考试版、答题卡、参考答案、全解全析)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2022年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷B(已下线)考点01 物质的组成、分类及转化-备战2022年高考化学学霸纠错(全国通用)(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年辽宁省高考真题变式题(16-19)(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题6-10)(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)



