1 . 加热 溶液,发生反应:
溶液,发生反应: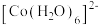 (粉红色)
(粉红色)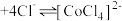 (蓝色)
(蓝色)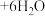 ,溶液颜色由粉红色变为蓝色。下列说法错误的是
,溶液颜色由粉红色变为蓝色。下列说法错误的是
 溶液,发生反应:
溶液,发生反应: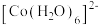 (粉红色)
(粉红色)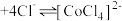 (蓝色)
(蓝色)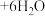 ,溶液颜色由粉红色变为蓝色。下列说法错误的是
,溶液颜色由粉红色变为蓝色。下列说法错误的是A.基态 原子的价电子排布式为 原子的价电子排布式为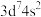 |
| B.该反应为吸热反应 |
C.向冷 溶液中加入 溶液中加入 固体,溶液变蓝 固体,溶液变蓝 |
| D.加水稀释,平衡正移 |
您最近一年使用:0次
名校
2 . 下列事实能用勒夏特列原理来解释的是
A. 被氧化为 被氧化为 ,往往需要使用催化剂: ,往往需要使用催化剂: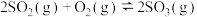 |
B.500℃温度比室温更有利于合成氨反应:  |
C. 、 、 、 、 平衡混合气体加压后颜色加深: 平衡混合气体加压后颜色加深: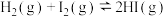 |
D.实验室采用排饱和食盐水的方法收集氯气: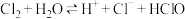 |
您最近一年使用:0次
名校
解题方法
3 . 氟碳铈矿(主要成分为 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:

(1) 中
中 的化合价为
的化合价为___________ ;氧化焙烧时不能使用陶瓷容器的原因是产物 会腐蚀
会腐蚀 生成
生成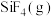 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)氧化焙烧后的产物之一为 ,则酸浸时发生反应的离子方程式为
,则酸浸时发生反应的离子方程式为___________ 。
(3)操作I的名称为___________ ;有机物 能将
能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 。向
。向 中加入稀硫酸能获得较纯的含
中加入稀硫酸能获得较纯的含 水溶液,从平衡移动角度解释其原因
水溶液,从平衡移动角度解释其原因___________ 。
(4)写出向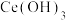 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式
的化学方程式___________ 。
 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
(1)
 中
中 的化合价为
的化合价为 会腐蚀
会腐蚀 生成
生成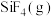 ,该反应的化学方程式为
,该反应的化学方程式为(2)氧化焙烧后的产物之一为
 ,则酸浸时发生反应的离子方程式为
,则酸浸时发生反应的离子方程式为(3)操作I的名称为
 能将
能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 。向
。向 中加入稀硫酸能获得较纯的含
中加入稀硫酸能获得较纯的含 水溶液,从平衡移动角度解释其原因
水溶液,从平衡移动角度解释其原因(4)写出向
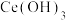 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式
的化学方程式
您最近一年使用:0次
名校
解题方法
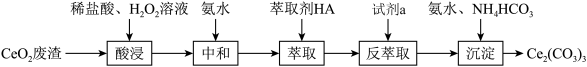
4 . 实验室以二氧化铺铈 废渣为原料制备
废渣为原料制备 ,其部分实验过程如下:
,其部分实验过程如下:
已知: 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为: (水层)
(水层) (有机层)
(有机层) (有机层)+
(有机层)+ (水层)。下列说法正确的是
(水层)。下列说法正确的是
 废渣为原料制备
废渣为原料制备 ,其部分实验过程如下:
,其部分实验过程如下:
已知:
 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为: (水层)
(水层) (有机层)
(有机层) (有机层)+
(有机层)+ (水层)。下列说法正确的是
(水层)。下列说法正确的是A.“酸浸”过程中 做氧化剂 做氧化剂 |
B.加氨水“中和”除去过量盐酸,主要目的是提高 的萃取率 的萃取率 |
| C.试剂a一定是盐酸 |
D.“沉淀”时反应的离子方程式为 |
您最近一年使用:0次
2023-03-29更新
|
625次组卷
|
4卷引用:福建省厦门第一中学2023届高三下学期第三次模拟测试化学试题
福建省厦门第一中学2023届高三下学期第三次模拟测试化学试题湖南省岳阳市2023届高三下学期教学质量监测(二模)化学试题(已下线)化学-2023年高考押题预测卷01(山东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)化学-2023年高考押题预测卷03(辽宁卷)(含考试版、全解全析、参考答案、答题卡)
名校
5 . 某小组同学用乙醛进行银镜反应实验时,补充做了以下实验。已知: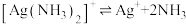
实验①: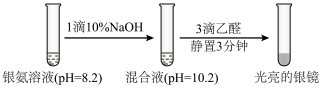
实验②: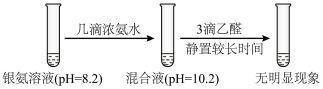
下列关于该实验的分析不正确的是
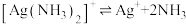
实验①:

实验②:

下列关于该实验的分析不正确的是
| A.实验①无需加热,说明碱性条件有利于银氨溶液与乙醛的反应 |
| B.实验①中加入NaOH后,溶液中c(NH3)增大 |
| C.实验表明,相同pH条件下,不同存在形式的Ag(I)的氧化性不一样 |
| D.对比实验①和②知,形成[Ag(NH3)2]+后Ag(I)氧化性降低 |
您最近一年使用:0次
名校
解题方法
6 . 实验室模拟工业处理含铬废水,操作及现象如图1所示,反应过程中铬元素的化合价变化如图2,已知:深蓝色溶液中生成了CrO5。下列说法不正确 的是


A.0-5 s过程中,发生的氧化还原反应为: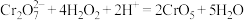 |
B.实验开始至30 s溶液中发生的总反应离子方程式为: |
| C.30-80 s过程中,Cr元素被氧化,可能是溶液中剩余的H2O2所致 |
D.80 s时,在碱性条件下,溶液中含铬微粒主要为 |
您最近一年使用:0次
2022-11-28更新
|
509次组卷
|
8卷引用:福建省厦门市湖滨中学2023-2024学年高三上学期期中考试化学试题
7 . 已知:重铬酸钾( )具有强氧化性,其还原产物
)具有强氧化性,其还原产物 在水溶液中呈绿色。在
在水溶液中呈绿色。在 溶液中存在下列平衡:
溶液中存在下列平衡: (橙色)
(橙色)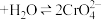 (黄色)
(黄色)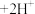 。用
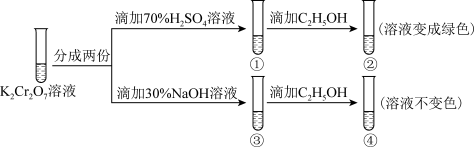
。用 溶液进行如图所示实验,下列说法不正确的是
溶液进行如图所示实验,下列说法不正确的是
 )具有强氧化性,其还原产物
)具有强氧化性,其还原产物 在水溶液中呈绿色。在
在水溶液中呈绿色。在 溶液中存在下列平衡:
溶液中存在下列平衡: (橙色)
(橙色)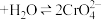 (黄色)
(黄色)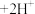 。用
。用 溶液进行如图所示实验,下列说法不正确的是
溶液进行如图所示实验,下列说法不正确的是
| A.①中溶液橙色加深,③中溶液变为黄色 |
B.②中 被 被 还原 还原 |
C.对比②和④可知, 酸性溶液氧化性强 酸性溶液氧化性强 |
D.若向④中加入70% 溶液至过量,溶液变为橙色 溶液至过量,溶液变为橙色 |
您最近一年使用:0次
2022-09-04更新
|
837次组卷
|
91卷引用:福建省厦门市湖滨中学2019届高三上学期第一次阶段检测化学试题
福建省厦门市湖滨中学2019届高三上学期第一次阶段检测化学试题2016年全国普通高等学校招生统一考试化学(北京卷精编版)2017届河北省沧州市第一中学高三上周测化学试卷2017届河南省开封市高三上学期10月定位考试化学试卷2017届江西省鹰潭市第一中学高三上学期第四次月考化学试卷2017届宁夏固原一中高三上适应性训练四化学卷2017届河北省冀州中学高三(高复班)上学期一轮检测(二)化学试卷辽宁省葫芦岛市2017届高三第二次模拟考试(5月)化学试题2018版化学(苏教版)高考总复习对接高考精练--氧化还原反应基础黑龙江省哈尔滨市第六中学2018届高三9月阶段检测化学试题辽宁省大连育明高级中学2018届高三人教版选修四同步测试化学试题吉林省实验中学2018届高三上学期第二次月考化学试题吉林省长春市2018届高三上学期第二次月考化学试题内蒙古巴彦淖尔市第一中学2018届高三12月月考理科综合化学试题(已下线)学科网2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 练陕西省渭南市尚德中学2019届高三上学期第一次教学质量检测化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)2016年全国普通高等学校招生统一考试化学(北京卷参考版)夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用夯基提能2020届高三化学选择题对题专练——氧化还原反应(强化练习)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡移动及其影响因素(强化练习)专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升山西省临汾市2020届高三上学期第二次月考化学试题(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省衡水中学2020届高三四月份质量监测理综化学试题湖南长沙长郡中学2020届高三2月份网络教学质量监测卷理综化学试题湖北省武汉市华中师范大学第一附属中学2020届高三2月份网络教学质量监测理综化学试题吉林省长春市东北师大附中2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分山西省运城市新绛中学2021届高三上学期8月月考化学试题河北省衡水市桃城区第十四中学2021届高三上学期一调考试化学试题重庆市第一中学校2020-2021高三上学期第一次月考化学试题北京首都师范大学第二附属中学2021届高三9月月考化学试题上海市嘉定区2021届高三一模化学试题广东省韶关市2021届高三综合测试化学试题(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)上海市徐汇中学2021-2022学年高三上学期期中考试化学试题(已下线)专题05 氧化还原反应-2022年高考化学二轮复习重点专题常考点突破练湖南省株洲市九方中学2022届高三下学期4月月考化学试题新疆维吾尔自治区喀什市喀什第二中学2022-2023学年高三上学期网上11月月考化学试题广东省中山市小榄中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题四 氧化还原反应-实战高考·二轮复习核心突破(已下线)化学预测卷(六)-预测卷(浙江专版)(已下线)T13-实验方案的设计与评价(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题2016-2017学年辽宁东北育才学校高二上阶段考二化学卷安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题福建省福州市第八中学2016-2017学年高二下学期期中考试化学试题山东省泰安市第一中学2016-2017学年高一下学期学情检测化学试题黑龙江省哈尔滨市第六中学2016-2017学年高二6月月考化学试题辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第一次月考化学试题北京市八一中学2016-2017学年高二上学期期中考试化学试题湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题(实验班)江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题山西省运城市河津二中2018-2019学年高二上学期9月月考化学试题【全国百强校】四川省彭州中学2018-2019学年高二上学期10月月考化学试题浙江省诸暨中学2018-2019学年高二上学期10月(期中)阶段性考试实验班化学试题【全国百强校】湖南省衡阳市第一中学2018-2019学年高二上学期期中考试化学试题云南省腾冲市第八中学2018-2019学年高二下学期期中考试化学试题河北省迁西县第一中学2019-2020学年高二10月月考化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题浙江省宁波市北仑中学2019-2020学年高二上学期期中考试化学(2-10班)试题湖北省沙市中学2019-2020学年高二上学期期中考试化学(选考)试题河北省张家口市第一中学2019-2020学年高二12月月考化学试题福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期末考试化学试题河北省保定市2019-2020学年高二上学期期末调研考试化学试题四川省宜宾翠屏棠湖学校2020-2021学年高二上学期10月月考化学试题山西省太原市第五中学2020-2021学年高二上学期10月月考试题湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题广东实验中学附属天河学校2020--2021学年高二上学期期中考试化学试题四川省成都市金堂县竹篙中学2020-2021学年高二10月月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研化学试题安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题广东省汕尾市2020-2021学年高二上学期期末学业质量监测化学试题河北省衡水市第十四中学2020-2021学年高二上学期期末考试化学试题广东省深圳市西乡中学2021-2022学年高二上学期期中考试化学试题第二节 化学平衡 第3课时 影响化学平衡的因素内蒙古包头市第四中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨市第二十四中学2022-2023学年高二10月月考化学试题(已下线)化学反应速率与化学平衡——课时5影响化学平衡的因素四川省资阳中学2022-2023学年高二上学期期末考试化学试题四川省绵阳市南山中学实验学校2022-2023学年高二下学期3月月考化学试题广东省肇庆市封开县广信中学、四会中学2023-2024学年高二上学期第一次联考化学试题北京市第一○一中学2023-2024学年高二上学期统练一化学试题云南省大理市下关第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
8 . 硫氰酸钾(KSCN),是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
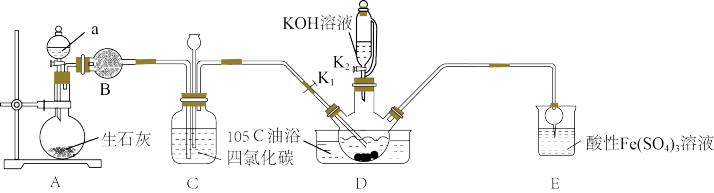
已知:① 不溶于
不溶于 和
和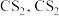 不溶于水且密度比水大;
不溶于水且密度比水大;
②D中三颈烧瓶内盛放 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且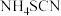 在高于170℃时易分解,
在高于170℃时易分解,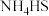 在高于25℃时即分解。
在高于25℃时即分解。
回答下列问题:
(1)试剂a是____ ,装置D中盛装KOH溶液的仪器名称是_______ 。
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是___ 。
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是___ 。
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经___ (填操作名称)、减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰酸钾晶体。
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因___ 。
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:____ 。

已知:①
 不溶于
不溶于 和
和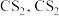 不溶于水且密度比水大;
不溶于水且密度比水大;②D中三颈烧瓶内盛放
 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且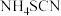 在高于170℃时易分解,
在高于170℃时易分解,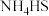 在高于25℃时即分解。
在高于25℃时即分解。回答下列问题:
(1)试剂a是
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:
您最近一年使用:0次
2021-03-11更新
|
1366次组卷
|
7卷引用:福建省厦门外国语学校2021届高三5月高考适应性考试化学试题
福建省厦门外国语学校2021届高三5月高考适应性考试化学试题山东省潍坊市2021届高三第一次模拟考试化学试题辽宁省葫芦岛市2021届高三第二次模拟考试化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
9 . 如图所示为接触法制硫酸的设备和工艺流程,其中关键步骤是SO2的催化氧化:2SO2+O2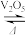 2SO3 △H<0。下列说法正确的是
2SO3 △H<0。下列说法正确的是
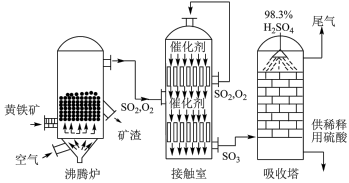
 2SO3 △H<0。下列说法正确的是
2SO3 △H<0。下列说法正确的是
| A.反应后气体分子数减少,增大反应容器内压强一定有利于提高生产效益 |
| B.反应放热,为提高SO2转化率,应尽可能在较低温度下反应 |
| C.工业生产要求高效,为加快反应速率,应使用催化剂并尽可能提高体系温度 |
| D.沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室 |
您最近一年使用:0次
2020-09-08更新
|
553次组卷
|
9卷引用:福建省厦门第一中学2021届高三上学期第一次质量检测化学试题
福建省厦门第一中学2021届高三上学期第一次质量检测化学试题浙江省2021届高考选考科目9月联考化学试题(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)福建省厦门市国祺中学2021-2022学年高二上学期期中考试化学试题(已下线)专题2.4 化学反应的调控(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)2.4 化学反应的调控-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)第四节 化学反应的调控(已下线)化学反应速率与化学平衡——课时7化学反应的调控作业(十一) 化学反应的调控
解题方法
10 . 化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺如下:

(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=____ kJ/mol
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题
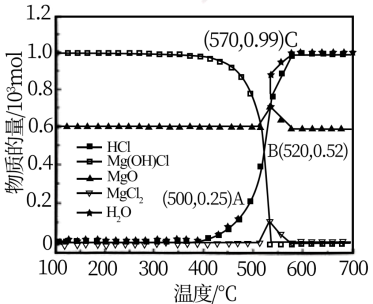
①应选择的最佳反应温度是___________
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=___________ (Kp为以分压表示的平衡常数)
③结合平衡移动原理,原料气增加水蒸气的目的是___________
(3)“氯乙烯反应”中, (g)+HCl(g)
(g)+HCl(g)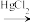 CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
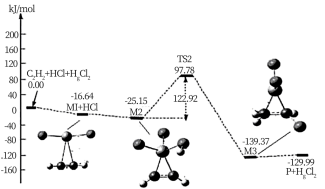
①碳碳叁键的键能:M1_____  (填“>”或“<”)
(填“>”或“<”)
②“M2→M3”的化学方程式为__________
③该反应的决速步骤为__________
(4)下列有关该工艺的说法不正确的是______ (填标号)
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗

(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题

①应选择的最佳反应温度是
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=
③结合平衡移动原理,原料气增加水蒸气的目的是
(3)“氯乙烯反应”中,
 (g)+HCl(g)
(g)+HCl(g)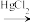 CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
①碳碳叁键的键能:M1
 (填“>”或“<”)
(填“>”或“<”)②“M2→M3”的化学方程式为
③该反应的决速步骤为
(4)下列有关该工艺的说法不正确的是
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗
您最近一年使用:0次



