名校
1 . 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:
 。下列说法
。下列说法
| A.饮食中摄入过多食盐,会加重痛风病病情 | B.大量饮水会增大痛风病发作的可能性 |
| C.寒冷季节更易诱发关节疼痛 | D.患痛风病的人应少吃能代谢产生更多尿酸的食物 |
您最近一年使用:0次
2024-02-21更新
|
148次组卷
|
41卷引用:广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题
广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题北京市西城区2019-2020学年度高二上学期期末考试化学试题上海市奉贤区2020届高三5月教学质量调研(二模)化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题北京市第四十三中学2020-2021学年高二上学期12月月考化学试题辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题北京市房山区2020-2021学年高二上学期期末考试化学试题河南省焦作市县级重点中学2021-2022学年高二上学期期中考试化学试题吉林省长白山第二高级中学校2021-2022学年高三上学期第二次月考化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2021-2022学年高二上学期期中考试化学试题 北京市房山区2022-2023学年高二上学期期中质量检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题北京市顺义区2023届高三第一次统练化学试题广东省汕头市聿怀中学2022-2023学年高二上学期期末线上考试化学试题安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题(已下线)专题15 化学反应速率和化学平衡新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期11月期中检测化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第六十六中学2023-2024学年高二上学期期中质量检测化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高二上学期11月期中考试化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题河南省信阳市淮滨县2022-2023学年高二上学期11月期中考试化学试题甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题四川省内江市2025届第三中学高二上学期化学试卷北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题北京市顺义区2022-2023学年高三上学期第一次统练化学试卷
名校
2 . 当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
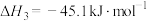
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。( 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:

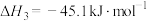
(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。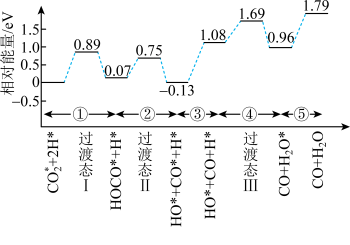

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。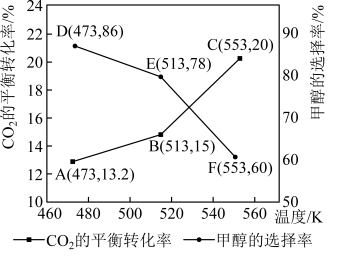
②553K时,若反应后体系的总压为p,反应Ⅰ的

 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近一年使用:0次
2023-09-30更新
|
254次组卷
|
5卷引用:广东省河源中学2023-2024学年上学期高三年级一调考试化学试题
3 . 为了研究 的性质,某兴趣小组进行了如下实验。
的性质,某兴趣小组进行了如下实验。
Ⅰ.制备: 易潮解,
易潮解, 能升华。
能升华。
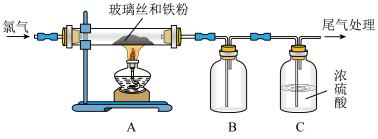
(1)实验开始前先通氯气的目的是_____ 。
(2)若用NaOH溶液处理尾气,发生反应的化学方程式为_____ 。
(3)该装置存在的主要缺点是_____ 。
Ⅱ.溶液的配制:
(4)取 固体溶于浓盐酸,再稀释至指定浓度。配制
固体溶于浓盐酸,再稀释至指定浓度。配制 溶液,需
溶液,需 溶液的体积为
溶液的体积为_____ mL,不需要使用的实验仪器有_____ (填字母)。
Ⅲ. 溶液的性质:
溶液的性质:
(5)向 溶液中通入
溶液中通入 至饱和,充分静置。观察到
至饱和,充分静置。观察到 溶液颜色由黄色变成血红色。静置5分钟后溶液颜色由血红色慢慢变回黄色,静置9小时后溶液慢慢由黄色变成浅绿色。
溶液颜色由黄色变成血红色。静置5分钟后溶液颜色由血红色慢慢变回黄色,静置9小时后溶液慢慢由黄色变成浅绿色。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为_____ 。某同学想检验反应5分钟后的溶液中有 生成,应选用的试剂是
生成,应选用的试剂是_____ 。
(6)为探究实验过程中血红色物质产生的原因,该同学查阅资料发现红色物质可能是 与溶液中某种+4价含硫微粒形成的配离子(可逆反应),于是提出以下假设:
与溶液中某种+4价含硫微粒形成的配离子(可逆反应),于是提出以下假设:
假设一:血红色物质的产生与 或
或 有关
有关
假设二:血红色物质的产生与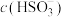 或
或 有关
有关
该同学为验证假设进行以下实验:
①实验一:向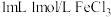 溶液中滴加
溶液中滴加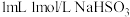 溶液,溶液变成血红色,且颜色比(1)实验深,再加入
溶液,溶液变成血红色,且颜色比(1)实验深,再加入
_____ ,溶液颜色由红色褪成黄色。
②实验二:将 的
的 溶液、
溶液、 溶液、
溶液、 溶液以一定体积混合,利用分光光度仪对红色物质的浓度进行检测,测得实验数据如下,吸光度越大,溶液颜色越深。
溶液以一定体积混合,利用分光光度仪对红色物质的浓度进行检测,测得实验数据如下,吸光度越大,溶液颜色越深。
表中x=_____ 。
③实验结论:血红色物质是 与
与_____ 形成的配离子。
(7)结合化学平衡解释(1)实验中出现“5分钟后溶液颜色由血红色慢慢变回黄色”现象的原因:_____ 。
 的性质,某兴趣小组进行了如下实验。
的性质,某兴趣小组进行了如下实验。Ⅰ.制备:
 易潮解,
易潮解, 能升华。
能升华。
(1)实验开始前先通氯气的目的是
(2)若用NaOH溶液处理尾气,发生反应的化学方程式为
(3)该装置存在的主要缺点是
Ⅱ.溶液的配制:
(4)取
 固体溶于浓盐酸,再稀释至指定浓度。配制
固体溶于浓盐酸,再稀释至指定浓度。配制 溶液,需
溶液,需 溶液的体积为
溶液的体积为
Ⅲ.
 溶液的性质:
溶液的性质:(5)向
 溶液中通入
溶液中通入 至饱和,充分静置。观察到
至饱和,充分静置。观察到 溶液颜色由黄色变成血红色。静置5分钟后溶液颜色由血红色慢慢变回黄色,静置9小时后溶液慢慢由黄色变成浅绿色。
溶液颜色由黄色变成血红色。静置5分钟后溶液颜色由血红色慢慢变回黄色,静置9小时后溶液慢慢由黄色变成浅绿色。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为 生成,应选用的试剂是
生成,应选用的试剂是(6)为探究实验过程中血红色物质产生的原因,该同学查阅资料发现红色物质可能是
 与溶液中某种+4价含硫微粒形成的配离子(可逆反应),于是提出以下假设:
与溶液中某种+4价含硫微粒形成的配离子(可逆反应),于是提出以下假设:假设一:血红色物质的产生与
 或
或 有关
有关假设二:血红色物质的产生与
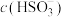 或
或 有关
有关该同学为验证假设进行以下实验:
①实验一:向
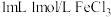 溶液中滴加
溶液中滴加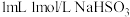 溶液,溶液变成血红色,且颜色比(1)实验深,再加入
溶液,溶液变成血红色,且颜色比(1)实验深,再加入
②实验二:将
 的
的 溶液、
溶液、 溶液、
溶液、 溶液以一定体积混合,利用分光光度仪对红色物质的浓度进行检测,测得实验数据如下,吸光度越大,溶液颜色越深。
溶液以一定体积混合,利用分光光度仪对红色物质的浓度进行检测,测得实验数据如下,吸光度越大,溶液颜色越深。| 序号 | V/mL | 吸光度 | ||
 |  |  | ||
| 1 | 0.5 | 4.0 | 0.0 | 0.412 |
| 2 | 0.5 | 3.2 | 0.8 | 0.331 |
| 3 | 0.5 | 2.0 | 2.0 | 0.182 |
| 4 | 0.5 | 1.2 | x | 0.085 |
| 5 | 0.5 | 0.0 | 4.0 | 0.018 |
③实验结论:血红色物质是
 与
与(7)结合化学平衡解释(1)实验中出现“5分钟后溶液颜色由血红色慢慢变回黄色”现象的原因:
您最近一年使用:0次
名校
解题方法
4 . 用下列装置不能达到实验目的的是
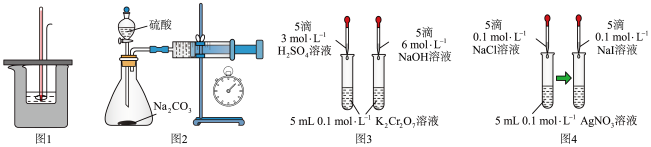

| A.图1:测量强酸强碱中和反应的反应热 |
B.图2:测定 和稀硫酸反应的速率 和稀硫酸反应的速率 |
| C.图3:验证浓度对化学平衡的影响 |
D.图4:证明 |
您最近一年使用:0次
2023-01-14更新
|
353次组卷
|
3卷引用:广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题
解题方法
5 . 根据下列实验设计,回答问题:
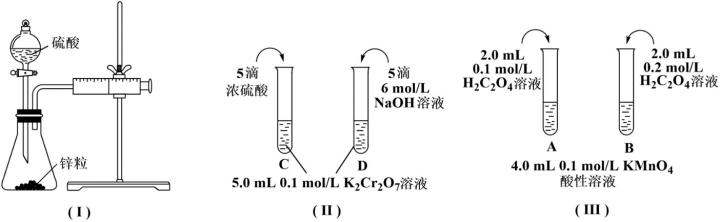
(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___________ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+
(黄色)+2H+
推测D试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___________ ,推测该实验设计___________ (填“能”或“不能”)达到实验目的,判断理由是___________ 。
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
由实验ⅰ、实验ⅱ可得出的结论是___________ 。

(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+
(黄色)+2H+推测D试管中实验现象为
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| ⅰ | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ⅱ | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
由实验ⅰ、实验ⅱ可得出的结论是
您最近一年使用:0次



