名校
解题方法
1 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,原子核外有_______ 种不同能量的电子,写出其最外层电子的轨道表示式_______ ;碘元素在元素周期表中的位置是_______ ;液溴的保存通常采取的方法是_______ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
(3) 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是_______ 。
(4)已知: 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_______
(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_______
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是_______ (填字母)。
a.海盐提纯:

b.海水提镁:
c.海带提碘: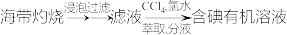

d.海水提溴:
(1)与氯元素同族的短周期元素的原子,原子核外有
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的氧化性 的氧化性 | B. 、 、 、 、 的熔点 的熔点 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是(4)已知:
 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a.海盐提纯:


b.海水提镁:

c.海带提碘:
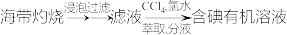

d.海水提溴:

您最近一年使用:0次
2022-11-11更新
|
173次组卷
|
2卷引用:湖北省黄冈市黄梅县育才高级中学2023-2024学年高二下学期3月月考化学试题
2 . 甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气( 与
与 的混合气体)转化成甲醇,反应为
的混合气体)转化成甲醇,反应为 。
。
(1) 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。
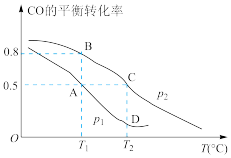
①A、B、C三点的平衡常数 、
、 、
、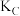 的大小关系是
的大小关系是____ 。
②下列叙述不能说明上述反应达到化学平衡状态的是____ (填字母)。
a.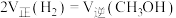
b. 的体积分数不再改变
的体积分数不再改变
c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗 ,生成
,生成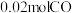
(2)在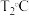 、
、 压强时,往一容积为
压强时,往一容积为 的密闭容器内,充入
的密闭容器内,充入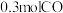 与
与 发生反应。
发生反应。
①该条件下,若达到C点时所用时间为 ,则该时间段的平均速率
,则该时间段的平均速率
____ ;
②在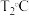 、
、 压强时,反应体系处于D点时,
压强时,反应体系处于D点时,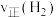
____  (填“=”、“>”、“<”)
(填“=”、“>”、“<”)
③平衡后再加入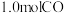 后重新到达平衡,则
后重新到达平衡,则 与
与 的浓度比
的浓度比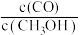
___________ (填“增大”“不变"或“减小”)。
④D点平衡常数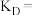
___________
 与
与 的混合气体)转化成甲醇,反应为
的混合气体)转化成甲醇,反应为 。
。(1)
 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。
①A、B、C三点的平衡常数
 、
、 、
、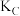 的大小关系是
的大小关系是②下列叙述不能说明上述反应达到化学平衡状态的是
a.
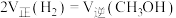
b.
 的体积分数不再改变
的体积分数不再改变c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗
 ,生成
,生成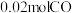
(2)在
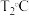 、
、 压强时,往一容积为
压强时,往一容积为 的密闭容器内,充入
的密闭容器内,充入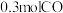 与
与 发生反应。
发生反应。①该条件下,若达到C点时所用时间为
 ,则该时间段的平均速率
,则该时间段的平均速率
②在
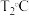 、
、 压强时,反应体系处于D点时,
压强时,反应体系处于D点时,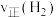
 (填“=”、“>”、“<”)
(填“=”、“>”、“<”)③平衡后再加入
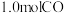 后重新到达平衡,则
后重新到达平衡,则 与
与 的浓度比
的浓度比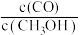
④D点平衡常数
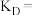
您最近一年使用:0次
名校
3 . 氢氰酸(HCN)有剧毒,易挥发。金矿提金时,用NaCN溶液浸取金生成[Au(CN)2]-,再用锌置换出金,产生的含氰废水需处理后排放。
(1)①写出基态锌离子的电子排布式____ ,基态氮原子的轨道表示式____ 。
②NaCN可用于制备CuCN,CuCN浊液中加入Na2S溶液可发生反应:2CuCN(S)+S2-(aq) Cu2S(s)+2CN-(aq),该反应的平衡常数K=
Cu2S(s)+2CN-(aq),该反应的平衡常数K=____ 。[已知Ksp(CuCN)=3.5×10-20,Ksp(Cu2S)=1.0×10-48]。
(2)Cu2+可催化H2O2氧化废水中的CN-。其他条件相同时,总氰化物(CN-、HCN等)去除率随溶液初始pH变化如图所示。
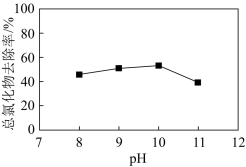
①在酸性条件下,H2O2也能氧化CN-,但实际处理废水时却不在酸性条件下进行的原因是____ 。
②当溶液初始pH>10时,总氰化物去除率下降的原因可能是____ 。
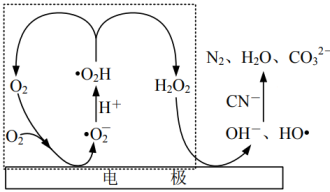
(3)通过电激发产生HO•和OH-处理废水中的CN-,可能的反应机理如图所示。虚线方框内历程可用方程式描述为____ 。
(1)①写出基态锌离子的电子排布式
②NaCN可用于制备CuCN,CuCN浊液中加入Na2S溶液可发生反应:2CuCN(S)+S2-(aq)
 Cu2S(s)+2CN-(aq),该反应的平衡常数K=
Cu2S(s)+2CN-(aq),该反应的平衡常数K=(2)Cu2+可催化H2O2氧化废水中的CN-。其他条件相同时,总氰化物(CN-、HCN等)去除率随溶液初始pH变化如图所示。

①在酸性条件下,H2O2也能氧化CN-,但实际处理废水时却不在酸性条件下进行的原因是
②当溶液初始pH>10时,总氰化物去除率下降的原因可能是
(3)通过电激发产生HO•和OH-处理废水中的CN-,可能的反应机理如图所示。虚线方框内历程可用方程式描述为

您最近一年使用:0次
4 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)

b)

c)

d)

e)

(1)已知相关物质的燃烧热(25℃、101 kPa):
则△H1=___________ 。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a)


b)


c)


d)


e)


(1)已知相关物质的燃烧热(25℃、101 kPa):
| 物质 | CH4(g) | CO(g) | H2(g) |
燃烧热(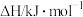 ) ) |  |  |  |
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.移去部分C(s),反应c、d、e的平衡均向右移动 |
| B.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
名校
5 . (NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及含氮量进行探究。已知: (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+,回答下列问题:
(黄色)+2H+,回答下列问题:
(1)在试管中加入少量固体(NH4)2Cr2O7,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、有刺激性气味气体放出、___________ 。
(2)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++ +H2O=2BaCrO4↓+2H+;4
+H2O=2BaCrO4↓+2H+;4 +6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+
+6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+ (CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸和酸性物质。
(CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸和酸性物质。
实验步骤:
ⅰ.称取样品mg,配成250mL溶液。
ⅱ.量取25.00mL样品溶液,用氯化钡溶液使 完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
ⅲ.以酚酞作指示剂,用cmol·L-1标准NaOH溶液滴定,记录数据。
ⅳ.重复步骤ⅱ、ⅲ 2-3次,处理数据。
①滴定终点的现象是___________ 。
②滴定操作使用的玻璃仪器主要有___________ 。
③滴定时边滴边摇动锥形瓶,眼睛应观察___________ 。
④步骤ⅲ发生反应的离子方程式是H++OH-= H2O和___________ 。
⑤若实验平均消耗NaOH溶液的体积为vmL,该样品中氮的质量分数的计算式为___________ 。(用含m、c、v式子表示,需要化简)
⑥下列情况会导致测定结果偏低的是___________ 。(填序号)
a. 若步骤ⅰ中定容时俯视溶液液面
b. 若实验中使用的甲醛常混有微量甲酸
c. 若步骤ⅱ没有静置5min
d. 若实验时装NaOH标准液的滴定管只用蒸馏水洗涤而未用标准液润洗
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+,回答下列问题:
(黄色)+2H+,回答下列问题:(1)在试管中加入少量固体(NH4)2Cr2O7,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、有刺激性气味气体放出、
(2)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++
 +H2O=2BaCrO4↓+2H+;4
+H2O=2BaCrO4↓+2H+;4 +6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+
+6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+ (CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸和酸性物质。
(CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸和酸性物质。实验步骤:
ⅰ.称取样品mg,配成250mL溶液。
ⅱ.量取25.00mL样品溶液,用氯化钡溶液使
 完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。ⅲ.以酚酞作指示剂,用cmol·L-1标准NaOH溶液滴定,记录数据。
ⅳ.重复步骤ⅱ、ⅲ 2-3次,处理数据。
①滴定终点的现象是
②滴定操作使用的玻璃仪器主要有
③滴定时边滴边摇动锥形瓶,眼睛应观察
④步骤ⅲ发生反应的离子方程式是H++OH-= H2O和
⑤若实验平均消耗NaOH溶液的体积为vmL,该样品中氮的质量分数的计算式为
⑥下列情况会导致测定结果偏低的是
a. 若步骤ⅰ中定容时俯视溶液液面
b. 若实验中使用的甲醛常混有微量甲酸
c. 若步骤ⅱ没有静置5min
d. 若实验时装NaOH标准液的滴定管只用蒸馏水洗涤而未用标准液润洗
您最近一年使用:0次
名校
解题方法
6 . 高纯硅被誉为“信息革命的催化剂”。某小组模拟工业上用 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
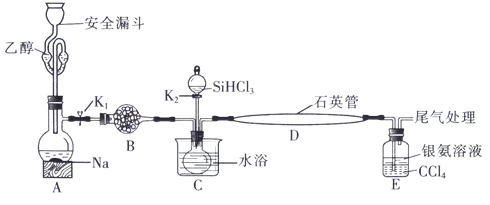
已知:① 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为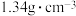 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
② ;
;
③银氨溶液中存在: 。
。
回答下列问题:
(1)装置B中试剂宜选择___________ (填字母,单选)。
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加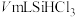 ;
;
④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为___________ (填序号)。
(3)E中CCl4的作用是防倒吸和___________ 。“防倒吸”原理是___________ 。用化学平衡原理解释银氨溶液中有白色沉淀生成:___________ 。
(4)石英管中发生反应的化学方程式为___________ 。
(5)本实验制得高纯硅ag,则SiHCl3的利用率为___________ (只列计算式)。实验结束后,有同学认为根据高纯硅与消耗钠或乙醇的量也可以计算SiHCl3的利用率,这种观点___________ (填“是”或“否”)正确。
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为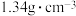 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
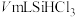 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
您最近一年使用:0次
2021-07-04更新
|
522次组卷
|
2卷引用:湖北省2020-2021学年高二下学期7月统一调研测试化学试题
7 . 含碳物质的价值型转化,有利于“减碳”和可持续发展。回答下列问题:
(1)科学家用 做催化剂,可将
做催化剂,可将 和
和 转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为
转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为___________ 。

(2)用惰性电极电解 溶液,可将空气中的
溶液,可将空气中的 转化为甲酸根(
转化为甲酸根( ),然后进一步可制得化工原料甲酸。
),然后进一步可制得化工原料甲酸。 发生反应的电极反应式为
发生反应的电极反应式为___________ ,若电解过程中转移1mol电子,阳极生成氧气的体积(标准状况)为___________ L。
(3)乙苯催化脱氢制取苯乙烯的反应为: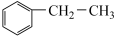 (g)+CO2(g)
(g)+CO2(g)
 (g)+H2O(g)+CO(g),其反应历程如下:
(g)+H2O(g)+CO(g),其反应历程如下:
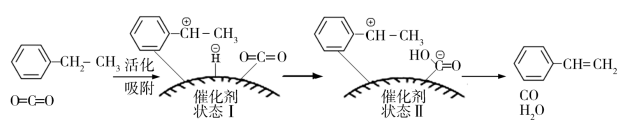
①由原料到“状态Ⅰ”___________ (填“放出”或“吸收”)能量。
②一定温度下,向恒容密闭容器中充入2mol乙苯和 ,起始压强为
,起始压强为 ,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,平衡时容器内气体总物质的量为5mol,乙苯的转化率为___________ ,用平衡分压代替平衡浓度表示的化学平衡常数
___________ 。
③乙苯平衡转化率与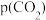 的关系如图所示,乙苯平衡转化率随着
的关系如图所示,乙苯平衡转化率随着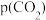 变化的原因是
变化的原因是___________ 。

(1)科学家用
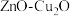 做催化剂,可将
做催化剂,可将 和
和 转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为
转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为
(2)用惰性电极电解
 溶液,可将空气中的
溶液,可将空气中的 转化为甲酸根(
转化为甲酸根( ),然后进一步可制得化工原料甲酸。
),然后进一步可制得化工原料甲酸。 发生反应的电极反应式为
发生反应的电极反应式为(3)乙苯催化脱氢制取苯乙烯的反应为:
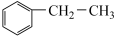 (g)+CO2(g)
(g)+CO2(g)
 (g)+H2O(g)+CO(g),其反应历程如下:
(g)+H2O(g)+CO(g),其反应历程如下:
①由原料到“状态Ⅰ”
②一定温度下,向恒容密闭容器中充入2mol乙苯和
 ,起始压强为
,起始压强为 ,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
③乙苯平衡转化率与
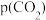 的关系如图所示,乙苯平衡转化率随着
的关系如图所示,乙苯平衡转化率随着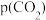 变化的原因是
变化的原因是
您最近一年使用:0次
名校
8 . (1)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ的热量。写出该反应的热化学方程式_______ 。
(2)若25℃,101 kPa下,1 g CH4完全燃烧生成液态水和CO2气体,放出55.6 kJ的热量,则甲烷的燃烧热为_______ 。
(3)对于下列反应:2SO2(g)+ O2(g)⇌2SO3(g),如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为_______ 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ 。
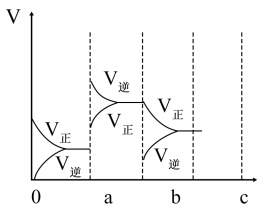
(4)下图表示在密闭容器中反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是____ ;bc过程中改变的条件可能是_____ 。
(2)若25℃,101 kPa下,1 g CH4完全燃烧生成液态水和CO2气体,放出55.6 kJ的热量,则甲烷的燃烧热为
(3)对于下列反应:2SO2(g)+ O2(g)⇌2SO3(g),如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
(4)下图表示在密闭容器中反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是

您最近一年使用:0次
9 . 氨是最基本的化工原料之一,工业合成氨是人类科学技术的一项重大突破,其反应如下:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol。
2NH3(g) ΔH=-92.4 kJ/mol。
(1) 目前,工业上通常采用铁触媒、在400~500 ℃和10 MPa~30 MPa的条件下合成氨。
①有关合成氨反应条件选择的下列说法中正确的是________ 。
A.使用铁触媒能改变合成氨反应的焓变
B.选择400~500 ℃的原因之一是铁触媒在该温度下活性最大
C.其他条件相同时,升高温度可使合成氨反应的反应速率加快、反应物转化率增大
D.合成氨工业中,还常将氨及时液化分离出去以加快正反应速率,提高N2、H2的转化率
②工业上合成氨时没有选择更大压强的原因是______________________________________ 。
(2) 在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为:[Cu(NH3)2]++CO+NH3 [Cu(NH3)3CO]+ ΔH<0。
[Cu(NH3)3CO]+ ΔH<0。
①必须除去CO的原因是_______________________________________ 。
②铜氨液吸收CO适宜的生成条件是_________________________________ 。
(3)利用生物燃料电池原理在室温下合成氨,比现有工业合成氨方法条件温和,同时还可提供电能。电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下图所示。

①上图中左边的电极为生物燃料电池的_________________ (填电极名称)。
②在固氮酶作用下发生反应的方程式为:___________________________________ 。
 2NH3(g) ΔH=-92.4 kJ/mol。
2NH3(g) ΔH=-92.4 kJ/mol。(1) 目前,工业上通常采用铁触媒、在400~500 ℃和10 MPa~30 MPa的条件下合成氨。
①有关合成氨反应条件选择的下列说法中正确的是
A.使用铁触媒能改变合成氨反应的焓变
B.选择400~500 ℃的原因之一是铁触媒在该温度下活性最大
C.其他条件相同时,升高温度可使合成氨反应的反应速率加快、反应物转化率增大
D.合成氨工业中,还常将氨及时液化分离出去以加快正反应速率,提高N2、H2的转化率
②工业上合成氨时没有选择更大压强的原因是
(2) 在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为:[Cu(NH3)2]++CO+NH3
 [Cu(NH3)3CO]+ ΔH<0。
[Cu(NH3)3CO]+ ΔH<0。①必须除去CO的原因是
②铜氨液吸收CO适宜的生成条件是
(3)利用生物燃料电池原理在室温下合成氨,比现有工业合成氨方法条件温和,同时还可提供电能。电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下图所示。

①上图中左边的电极为生物燃料电池的
②在固氮酶作用下发生反应的方程式为:
您最近一年使用:0次
名校
10 . 某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__ 。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
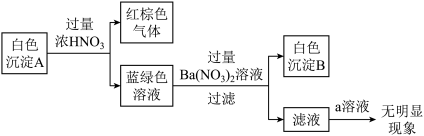
请回答:
①根据白色沉淀B是__ (填化学式),判断沉淀A中一定存在CuSCN。
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__ 。
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__ (填化学式)。
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_ Cu2++_ SCN-=_ CuSCN↓+_ (SCN)2
⑤结合上述过程以及Fe(SCN)3 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__ 。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__ 或__ 。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
①根据白色沉淀B是
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
⑤结合上述过程以及Fe(SCN)3
 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是
您最近一年使用:0次
2020-04-27更新
|
321次组卷
|
5卷引用:湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练



