1 . 研究CO还原NOx对环境的治理有重要意义,相关的主要化学反应有:
Ⅰ.NO2(g)+CO(g) CO2(g)+NO(g) ΔH1
CO2(g)+NO(g) ΔH1
Ⅱ.2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH2<0
N2(g)+4CO2(g) ΔH2<0
已知:1mol下列物质分解为气态基态原子吸收的能量分别为
下列描述正确的是
Ⅰ.NO2(g)+CO(g)
 CO2(g)+NO(g) ΔH1
CO2(g)+NO(g) ΔH1Ⅱ.2NO2(g)+4CO(g)
 N2(g)+4CO2(g) ΔH2<0
N2(g)+4CO2(g) ΔH2<0已知:1mol下列物质分解为气态基态原子吸收的能量分别为
| NO2 | CO | CO2 | NO |
| 819kJ | 1076kJ | 1490kJ | 632kJ |
| A.ΔH1=+227kJ·mol-1 |
| B.若在绝热恒容密闭容器中只进行反应Ⅰ,压强不变时能说明反应Ⅰ达到了平衡 |
| C.恒温条件下,增大CO的浓度能使反应Ⅱ正向移动,且提高了CO的平衡转化率 |
| D.上述两个反应达到平衡后,再升高温度,逆反应速率均一直增大直至达到新的平衡 |
您最近一年使用:0次
名校
2 . 油气田卤水中含有大量碘元素(主要以 形式存在)。工业上以净化后的卤水为原料通过离子交换法提取碘。
形式存在)。工业上以净化后的卤水为原料通过离子交换法提取碘。
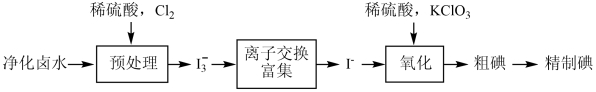
已知:ⅰ.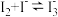 ,反应进行的程度很大;
,反应进行的程度很大; 的氧化性与
的氧化性与 相近,其水溶液呈棕黄色;
相近,其水溶液呈棕黄色;
ⅱ.酸性条件下 的氧化性强于
的氧化性强于 或
或 ,且酸性越强,其氧化性越强;
,且酸性越强,其氧化性越强;
ⅲ. 不能被阴离子交换树脂吸附。
不能被阴离子交换树脂吸附。
(1)预处理:将卤水中的 转化为
转化为 。
。
①写出 与
与 反应生成
反应生成 的离子方程式
的离子方程式_______ 。
②该步可能会有少量 生成。流程中,抑制
生成。流程中,抑制 生成的措施有:ⅰ.控制
生成的措施有:ⅰ.控制 的用量;ⅱ.
的用量;ⅱ._______ 。
(2)富集过程使用的阴离子交换树脂是一种高分子材料,其链节可表示为 。离子交换的原理:
。离子交换的原理: 。在阴离子交换树脂上的循环操作如图1所示。
。在阴离子交换树脂上的循环操作如图1所示。
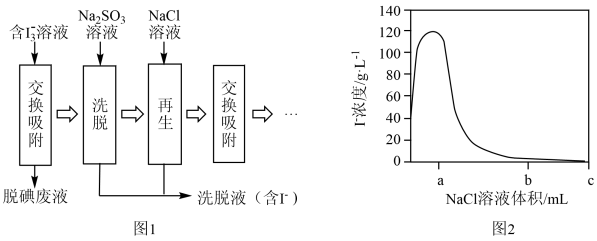
①交换吸附:当观察到脱碘废液_______ 时,说明离子交换树脂已吸附饱和。
②洗脱:用 溶液充分浸泡吸附饱和的离子交换树脂。补全该过程中反应的离子方程式
溶液充分浸泡吸附饱和的离子交换树脂。补全该过程中反应的离子方程式_______ 。

③再生:用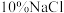 溶液缓慢冲洗离子交换树脂,收集含
溶液缓慢冲洗离子交换树脂,收集含 的洗脱液并使离子交换树脂再生。实时监测从离子交换树脂中流出的洗脱液中
的洗脱液并使离子交换树脂再生。实时监测从离子交换树脂中流出的洗脱液中 浓度,如图2所示。
浓度,如图2所示。 溶液最佳体积为b,理由是
溶液最佳体积为b,理由是_______ 。
④已知离子交换树脂对 的结合能力强于对
的结合能力强于对 的结合能力,再生过程能够发生的原因是
的结合能力,再生过程能够发生的原因是_______ 。
(3)氧化步骤得到泥状粗碘, 元素被还原到最低价。该反应的离子方程式是
元素被还原到最低价。该反应的离子方程式是_______ 。
 形式存在)。工业上以净化后的卤水为原料通过离子交换法提取碘。
形式存在)。工业上以净化后的卤水为原料通过离子交换法提取碘。
已知:ⅰ.
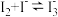 ,反应进行的程度很大;
,反应进行的程度很大; 的氧化性与
的氧化性与 相近,其水溶液呈棕黄色;
相近,其水溶液呈棕黄色;ⅱ.酸性条件下
 的氧化性强于
的氧化性强于 或
或 ,且酸性越强,其氧化性越强;
,且酸性越强,其氧化性越强;ⅲ.
 不能被阴离子交换树脂吸附。
不能被阴离子交换树脂吸附。(1)预处理:将卤水中的
 转化为
转化为 。
。①写出
 与
与 反应生成
反应生成 的离子方程式
的离子方程式②该步可能会有少量
 生成。流程中,抑制
生成。流程中,抑制 生成的措施有:ⅰ.控制
生成的措施有:ⅰ.控制 的用量;ⅱ.
的用量;ⅱ.(2)富集过程使用的阴离子交换树脂是一种高分子材料,其链节可表示为
 。离子交换的原理:
。离子交换的原理: 。在阴离子交换树脂上的循环操作如图1所示。
。在阴离子交换树脂上的循环操作如图1所示。
①交换吸附:当观察到脱碘废液
②洗脱:用
 溶液充分浸泡吸附饱和的离子交换树脂。补全该过程中反应的离子方程式
溶液充分浸泡吸附饱和的离子交换树脂。补全该过程中反应的离子方程式
③再生:用
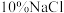 溶液缓慢冲洗离子交换树脂,收集含
溶液缓慢冲洗离子交换树脂,收集含 的洗脱液并使离子交换树脂再生。实时监测从离子交换树脂中流出的洗脱液中
的洗脱液并使离子交换树脂再生。实时监测从离子交换树脂中流出的洗脱液中 浓度,如图2所示。
浓度,如图2所示。 溶液最佳体积为b,理由是
溶液最佳体积为b,理由是④已知离子交换树脂对
 的结合能力强于对
的结合能力强于对 的结合能力,再生过程能够发生的原因是
的结合能力,再生过程能够发生的原因是(3)氧化步骤得到泥状粗碘,
 元素被还原到最低价。该反应的离子方程式是
元素被还原到最低价。该反应的离子方程式是
您最近一年使用:0次
2022-03-20更新
|
246次组卷
|
2卷引用:河北省廊坊市第十五中学2021-2022学年高三下学期第一次模拟测试化学试题
2022·江苏·模拟预测
3 . 下列关于2SO2(g)+O2(g)⇌2SO3(g)  kJ/mol,说法正确的是
kJ/mol,说法正确的是
 kJ/mol,说法正确的是
kJ/mol,说法正确的是| A.生产过程中将SO3分离出去,逆反应速率减慢 |
| B.该反应中,反应物的总能量小于生成物的总能量 |
C.该反应的 >0 >0 |
| D.其他条件不变,增大压强,平衡右移,平衡常数增大 |
您最近一年使用:0次
名校
4 .  可生产
可生产 并进而制得硫酸等,其反应原理为:
并进而制得硫酸等,其反应原理为: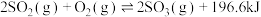 。下列说法正确的是
。下列说法正确的是
 可生产
可生产 并进而制得硫酸等,其反应原理为:
并进而制得硫酸等,其反应原理为: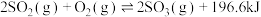 。下列说法正确的是
。下列说法正确的是| A.该反应在工业上需要在高温高压下进行 |
B.反应速率平衡后再通入 、 、 的体积分数一定增加 的体积分数一定增加 |
C.反应在高温、催化剂条件下进行可提高 的平衡转化率 的平衡转化率 |
D. 和 和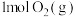 充分反应放出的热量小于196.6kJ 充分反应放出的热量小于196.6kJ |
您最近一年使用:0次
21-22高三下·江苏·阶段练习
名校
5 . 对于反应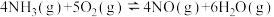
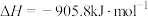 ,下列说法正确的是
,下列说法正确的是
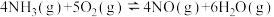
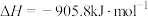 ,下列说法正确的是
,下列说法正确的是A.适当降温加压可提高 的平衡转化率 的平衡转化率 |
B.该反应的平衡常数可表达为 |
| C.分离出NO(g),v(正)增大,平衡向正反应方向移动 |
| D.1mol N-H断裂的同时有1mol O-H断裂,说明反应到达该条件下的平衡状态 |
您最近一年使用:0次
2022-03-09更新
|
481次组卷
|
5卷引用:化学(江苏A卷)-学易金卷:2023年高考第一次模拟考试卷
解题方法
6 . CH4—CO2干重整技术(简称“DRM技术”)在转化利用CH4的同时可以大量利用CO2,从而成为一项“绿色”的化工技术而受到科研人员的广泛关注。该过程中涉及的反应如下:
主反应:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0kJ/mol
CO(g)+H2O(g) △H2=+41.0kJ/mol
回答下列问题:
(1)已知CH4、CO和H2的燃烧热分别为890.3kJ/mol、283.0kJ/mol和285.8kJ/mol,DRM技术主反应的△H1=___ k/mol。主反应在高温下能自发进行的原因是____ 。
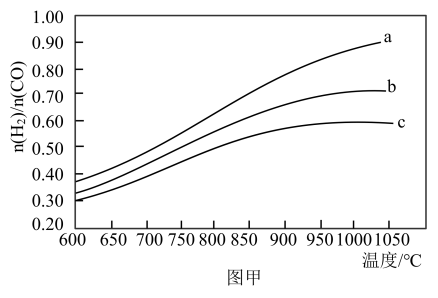
(2)在恒容密闭容器中发生上述主反应和副反应,a、b、c三条曲线分别代表不同进料比 反应达到平衡状态时
反应达到平衡状态时 随温度变化的关系如图甲所示,则a、b、c进料比
随温度变化的关系如图甲所示,则a、b、c进料比 由大到小顺序为
由大到小顺序为____ 。
(3)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α—AlO3催化剂并加热至1123K使其只发生主反应CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2p(CH4)p(CO2)mol g-1
g-1 s-1,某时刻测得p(CO)=20kPa,则此时p(CO2)=
s-1,某时刻测得p(CO)=20kPa,则此时p(CO2)=____ kPa,v(CO)=____ mol g-l
g-l s-1。
s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的分压平衡常数Kp=____ (kPa)2。(用各物质的分压代替物质的量浓度计算,列出计算式即可)
(4)主反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arthenius经验公式Rlnk=-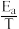 +C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=___ kJmol-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是____ 。

主反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.0kJ/mol
CO(g)+H2O(g) △H2=+41.0kJ/mol回答下列问题:
(1)已知CH4、CO和H2的燃烧热分别为890.3kJ/mol、283.0kJ/mol和285.8kJ/mol,DRM技术主反应的△H1=
(2)在恒容密闭容器中发生上述主反应和副反应,a、b、c三条曲线分别代表不同进料比
 反应达到平衡状态时
反应达到平衡状态时 随温度变化的关系如图甲所示,则a、b、c进料比
随温度变化的关系如图甲所示,则a、b、c进料比 由大到小顺序为
由大到小顺序为
(3)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α—AlO3催化剂并加热至1123K使其只发生主反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。①研究表明CO的生成速率v(CO)=1.3×10-2p(CH4)p(CO2)mol
 g-1
g-1 s-1,某时刻测得p(CO)=20kPa,则此时p(CO2)=
s-1,某时刻测得p(CO)=20kPa,则此时p(CO2)= g-l
g-l s-1。
s-1。②达到平衡后测得体系压强是起始时的1.8倍,则该反应的分压平衡常数Kp=
(4)主反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arthenius经验公式Rlnk=-
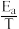 +C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
您最近一年使用:0次
21-22高二下·江苏镇江·开学考试
名校
7 . 实验室通过如下步骤可从铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)制备铬酸钠溶液。下列说法不正确的是


A.高温灼烧时发生的主要反应为4[FeO·Cr2O3]+8Na2CO3+7O2 2Fe2O3+8Na2CrO4+8CO2 2Fe2O3+8Na2CrO4+8CO2 |
| B.加入适量稀硫酸时,发生的反应为氧化还原反应 |
| C.操作1、操作2均需使用的玻璃仪器有漏斗、烧杯、玻璃棒 |
| D.向Na2CrO4溶液加入硫酸酸化,溶液将由黄色变为橙色 |
您最近一年使用:0次
2022-03-01更新
|
148次组卷
|
3卷引用:押江苏卷第9题 化学工艺流程选择题 -备战2022年高考化学临考题号押题(江苏卷)
(已下线)押江苏卷第9题 化学工艺流程选择题 -备战2022年高考化学临考题号押题(江苏卷)江苏省镇江市2021-2022学年高二下学期开学考试化学试题江苏省四校2023-2024学年高二上学期开学联考化学试题
名校
8 . 已知:A(g)+2B(g)⇌3C(g) △H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t2时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是


| A.容器内压强不变,表明反应达到平衡 |
| B.t2时改变的条件:降温 |
| C.平衡常数K:K(II)<K(I) |
| D.平衡时A的体积分数φ:φ(II)>φ(I) |
您最近一年使用:0次
2022-02-28更新
|
182次组卷
|
3卷引用:湖南省常德市桃源县第一中学2022届高三下学期第二次模拟化学试题
解题方法
9 . 重铬酸钾( )俗称红矾,是一种重要的化工产品。将铬铁矿[主要成分为亚铬酸亚铁
)俗称红矾,是一种重要的化工产品。将铬铁矿[主要成分为亚铬酸亚铁 ]和纯碱置于坩埚中,在空气中加热,发生反应:
]和纯碱置于坩埚中,在空气中加热,发生反应: ,将生成物加水溶解,过滤掉
,将生成物加水溶解,过滤掉 ,得
,得 溶液,酸化后,加KCl溶液,经过一系列操作可制得
溶液,酸化后,加KCl溶液,经过一系列操作可制得 。已知相关物质溶解度曲线如图所示。对于以上操作过程,下列说法正确的是
。已知相关物质溶解度曲线如图所示。对于以上操作过程,下列说法正确的是

 )俗称红矾,是一种重要的化工产品。将铬铁矿[主要成分为亚铬酸亚铁
)俗称红矾,是一种重要的化工产品。将铬铁矿[主要成分为亚铬酸亚铁 ]和纯碱置于坩埚中,在空气中加热,发生反应:
]和纯碱置于坩埚中,在空气中加热,发生反应: ,将生成物加水溶解,过滤掉
,将生成物加水溶解,过滤掉 ,得
,得 溶液,酸化后,加KCl溶液,经过一系列操作可制得
溶液,酸化后,加KCl溶液,经过一系列操作可制得 。已知相关物质溶解度曲线如图所示。对于以上操作过程,下列说法正确的是
。已知相关物质溶解度曲线如图所示。对于以上操作过程,下列说法正确的是
A.制备 的反应中,氧化剂与还原剂的物质的量之比为4∶7 的反应中,氧化剂与还原剂的物质的量之比为4∶7 |
| B.过滤需要用到的玻璃仪器有:漏斗、烧杯 |
| C.“一系列操作”是指蒸发结晶、过滤、洗涤、干燥 |
D.“酸化”步骤可用硫酸酸化,发生的离子反应为: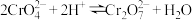 |
您最近一年使用:0次
2021·重庆·一模
名校
解题方法
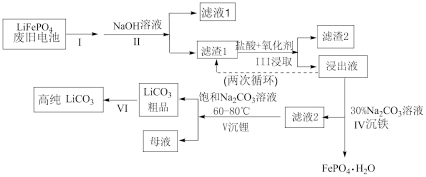
10 . 磷酸亚铁锂电池是新能源汽车的动力电池之一、采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
(1)I步操作是粉碎废旧电极,其主要目的是___________ 。
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是___________ 。
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
(4)浸出液中存在大量 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入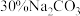 溶液沉铁的主要原理是
溶液沉铁的主要原理是___________ 。
(5)滤液2中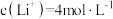 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中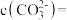
___________ 。[溶液混合后体积变化忽略不计,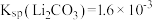 ]
]
(6)为将粗品 提纯,VI步使用
提纯,VI步使用___________ (填“热”或“冰”)水进行洗涤操作,理由是___________ 。
(7)工业上将回收的 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:___________ 。
 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
A. | B.酸性 | C. | D. |
 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入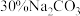 溶液沉铁的主要原理是
溶液沉铁的主要原理是(5)滤液2中
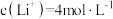 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中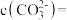
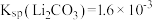 ]
](6)为将粗品
 提纯,VI步使用
提纯,VI步使用(7)工业上将回收的
 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:
您最近一年使用:0次
2022-02-05更新
|
610次组卷
|
7卷引用:押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)
(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)北京市通州区2022届高三查缺补漏化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(三)化学试题重庆市2021-2022学年高三上学期学业质量调研抽测(第一次)化学试卷(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题



