名校
解题方法
1 . Ⅰ.完成下列问题
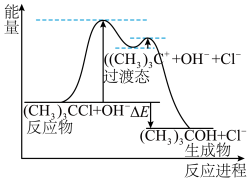
(1)叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是______
(2)下列有关热化学方程式的叙述正确的是_______
(3)已知反应:2NO(g)+2CO(g)=N₂(g)+2CO₂(g),在298K、100kPa的条件下,其中ΔH=-113.0kJ·mol-1,ΔS=-145.3J·mol-1·K-1,该反应___________ (填“能”或“不能”)用于消除汽车尾气中的NO,理由为___________ 。实际上,如果不采取一定措施,汽车尾气并不会自动消除,原因是___________ ;
Ⅱ.CH4和CO2在催化剂作用下可以转化为合成气(主要含H2、CO和少量H2O的混合气体)。
主反应为:I.CH4(g)+CO2(g) 2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
主要副反应有:Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
Ⅲ.CH4(g) C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
Ⅳ.CO(g)+H2(g) C(s)+H2O(g),ΔH4=-131kJ·mol-1
C(s)+H2O(g),ΔH4=-131kJ·mol-1
完成下列填空:
(4)写出CH4和水蒸气反应生成CO和H2的热化学方程式___________ 。
(5)对于反应Ⅰ,有利于提高CH4平衡转化率的措施是___________ 、___________ (任写两条)。
(6)反应Ⅰ温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:___________ 。
(7)某温度下,反应Ⅰ的平衡常数K=0.16,该温度下,测得容器中CH4、CO2、CO和H2的浓度分别为0.5mol/L、0.5mol/L、0.25mol/L、0.25mol/L,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。___________ 。
(8)CH4和CO2各1mol充入密闭容器中,发生反应I。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=___________ 。
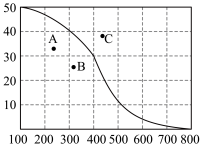
②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数___________ 点对应的平衡常数最小,理由是:___________ ;___________ 点对应压强最大,理由是:___________ 。
(1)叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是______

| A.该反应为吸热反应 |
| B.(CH3)3C+比(CH3)3CCl稳定 |
| C.第一步反应一定比第二步反应快 |
| D.增大碱的浓度和升高温度均可加快反应速率 |
(2)下列有关热化学方程式的叙述正确的是_______
A.已知C(石墨,s) C(金刚石,s)ΔH>0,则金刚石比石墨稳定 C(金刚石,s)ΔH>0,则金刚石比石墨稳定 |
| B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ·mol-1 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
D.N2(g)+3H2(g) 2NH3(g);ΔH=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 2NH3(g);ΔH=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
(3)已知反应:2NO(g)+2CO(g)=N₂(g)+2CO₂(g),在298K、100kPa的条件下,其中ΔH=-113.0kJ·mol-1,ΔS=-145.3J·mol-1·K-1,该反应
Ⅱ.CH4和CO2在催化剂作用下可以转化为合成气(主要含H2、CO和少量H2O的混合气体)。
主反应为:I.CH4(g)+CO2(g)
 2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
2CO(g)+2H2(g),ΔH1=+247kJ·mol-1主要副反应有:Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1Ⅲ.CH4(g)
 C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
C(s)+2H2(g),ΔH3=+74.8kJ·mol-1Ⅳ.CO(g)+H2(g)
 C(s)+H2O(g),ΔH4=-131kJ·mol-1
C(s)+H2O(g),ΔH4=-131kJ·mol-1完成下列填空:
(4)写出CH4和水蒸气反应生成CO和H2的热化学方程式
(5)对于反应Ⅰ,有利于提高CH4平衡转化率的措施是
(6)反应Ⅰ温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:
(7)某温度下,反应Ⅰ的平衡常数K=0.16,该温度下,测得容器中CH4、CO2、CO和H2的浓度分别为0.5mol/L、0.5mol/L、0.25mol/L、0.25mol/L,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。
(8)CH4和CO2各1mol充入密闭容器中,发生反应I。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=

②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数
您最近一年使用:0次
2 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国的新名片.
Ⅰ.已知25℃和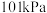 下:
下:
①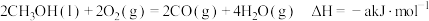
②
③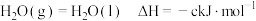
(1)表示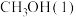 燃烧热的热化学方程式为
燃烧热的热化学方程式为_________________________________ 。
Ⅱ. 和
和 在一定条件下反应可制得合成气,在
在一定条件下反应可制得合成气,在 密闭容器中分别通入
密闭容器中分别通入 和
和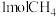 ,发生反应:
,发生反应:
(2)该反应在___________ (填“高温”或“低温”)条件下能自发进行
(3)下列能判断 达到平衡状态的是___________(填序号).
达到平衡状态的是___________(填序号).
Ⅲ.如图所示组成闭合回路,其中甲装置以 和为原料新型电池,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出
和为原料新型电池,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出
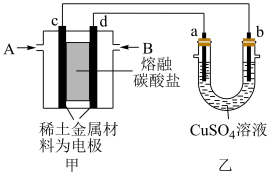
(4)装置中气体A为___________ (填“ ”或“
”或“ 和
和 ”),d极上的电极反应式为
”),d极上的电极反应式为___________ .
(5)乙装置中a极上的电极反应式为_________________________________ .
Ⅳ.工业上可用丙烯加成法制备1,2-二氯丙烷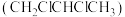 ,主要副产物为3-氯丙烯
,主要副产物为3-氯丙烯 ,反应原理为:
,反应原理为:
①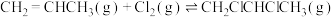
②
一定温度下,向恒容密闭容器中充入等物质的量的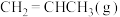 和
和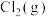 发生反应,容器内气体的压强随时间的变化如表所示:
发生反应,容器内气体的压强随时间的变化如表所示:
(6)用单位时间内气体分压的变化表示反应①的反应速率,即 ;则前
;则前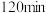 内平均反应速率
内平均反应速率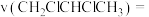
_____________________ .
(7)该温度下,若平衡时 的体积分数为
的体积分数为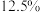 ,反应①的平衡常数
,反应①的平衡常数
___________  (
( 为以分压表示的平衡常数,保留小数点后2位).
为以分压表示的平衡常数,保留小数点后2位).
Ⅰ.已知25℃和
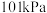 下:
下:①
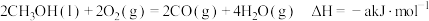
②

③
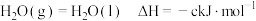
(1)表示
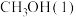 燃烧热的热化学方程式为
燃烧热的热化学方程式为Ⅱ.
 和
和 在一定条件下反应可制得合成气,在
在一定条件下反应可制得合成气,在 密闭容器中分别通入
密闭容器中分别通入 和
和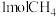 ,发生反应:
,发生反应:
(2)该反应在
(3)下列能判断
 达到平衡状态的是___________(填序号).
达到平衡状态的是___________(填序号).| A.一定温度下,容积固定的容器中,密度保持不变 |
| B.容积固定的绝热容器中,温度保持不变 |
| C.一定温度和容积固定的容器中,平均相对分子质量不变 |
D. 和 和 的物质的量之比不再改变 的物质的量之比不再改变 |
Ⅲ.如图所示组成闭合回路,其中甲装置以
 和为原料新型电池,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出
和为原料新型电池,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出
(4)装置中气体A为
 ”或“
”或“ 和
和 ”),d极上的电极反应式为
”),d极上的电极反应式为(5)乙装置中a极上的电极反应式为
Ⅳ.工业上可用丙烯加成法制备1,2-二氯丙烷
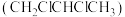 ,主要副产物为3-氯丙烯
,主要副产物为3-氯丙烯 ,反应原理为:
,反应原理为:①
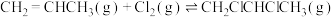
②

一定温度下,向恒容密闭容器中充入等物质的量的
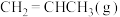 和
和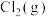 发生反应,容器内气体的压强随时间的变化如表所示:
发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
(6)用单位时间内气体分压的变化表示反应①的反应速率,即
 ;则前
;则前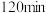 内平均反应速率
内平均反应速率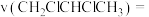
(7)该温度下,若平衡时
 的体积分数为
的体积分数为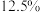 ,反应①的平衡常数
,反应①的平衡常数
 (
( 为以分压表示的平衡常数,保留小数点后2位).
为以分压表示的平衡常数,保留小数点后2位).
您最近一年使用:0次
名校
解题方法
3 . 2023年9月23日晚,杭州亚运会采用了废碳再生的“绿色甲醇”作为燃料,点亮了主火炬。工业上利用二氧化碳加氢制甲醇的总反应可表示为: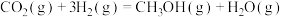
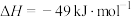 。
。
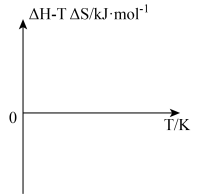
(1)在下图的坐标系中,画出能体现上述反应特点的大致图像:___________ 。
(2)在一体积为2L的密闭容器中投入1mol CO和3mol 模拟反应的过程。可以判断反应达到平衡状态的是___________。
模拟反应的过程。可以判断反应达到平衡状态的是___________。
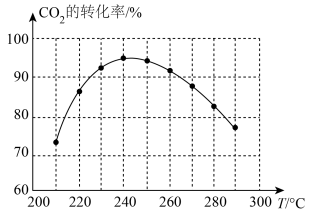
(3)为探究该反应合适的反应温度,某小组进行了一系列测试,保证每次初始的原料气组成及反应时间一致,测得 的转化率如图所示。试解释
的转化率如图所示。试解释 的转化率先增后降的原因
的转化率先增后降的原因___________ 。
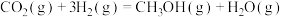
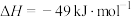 。
。(1)在下图的坐标系中,画出能体现上述反应特点的大致图像:

(2)在一体积为2L的密闭容器中投入1mol CO和3mol
 模拟反应的过程。可以判断反应达到平衡状态的是___________。
模拟反应的过程。可以判断反应达到平衡状态的是___________。A.断裂1.5 个H—H键的同时,有 个H—H键的同时,有 个O—H键生成 个O—H键生成 |
| B.容器内压强不再变化 |
C. 和 和 的体积分数之比保持不变 的体积分数之比保持不变 |
| D.混合气体的平均相对分子质量不再变化 |
(3)为探究该反应合适的反应温度,某小组进行了一系列测试,保证每次初始的原料气组成及反应时间一致,测得
 的转化率如图所示。试解释
的转化率如图所示。试解释 的转化率先增后降的原因
的转化率先增后降的原因
您最近一年使用:0次
解题方法
4 . “碳中和”目标如期实现的关键技术之一是 的再资源化利用。
的再资源化利用。
(1)氨的饱和食盐水捕获 是其利用的方法之一,反应原理为:
是其利用的方法之一,反应原理为: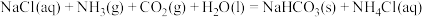 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是___________ 。
(2) 基掺杂
基掺杂 形成
形成 (
(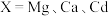 等),能用于捕获
等),能用于捕获 ,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
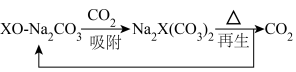
①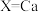 时,再生的化学方程式为
时,再生的化学方程式为___________ 。
②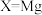 相比
相比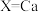 ,其优点有
,其优点有___________ 。
(3)催化电解吸收 的
的 溶液可将
溶液可将 转化为有机物。
转化为有机物。
① 在阴极放电生成
在阴极放电生成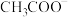 的电极反应式为
的电极反应式为___________ 。
②碱性溶液有利于抑制阴极上副产物的产生,该副产物的化学式为___________ 。
(4)在催化剂作用下,以 和
和 为原料合成
为原料合成 ,主要反应为:
,主要反应为:
反应Ⅰ: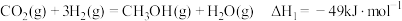
反应Ⅱ:
保持压强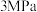 ,将起始
,将起始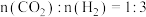 的混合气体匀速通过装有催化剂的反应管,测得出口处
的混合气体匀速通过装有催化剂的反应管,测得出口处 的转化率和甲醇的选择性
的转化率和甲醇的选择性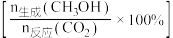 与温度的关系如题图1、题图2所示。
与温度的关系如题图1、题图2所示。
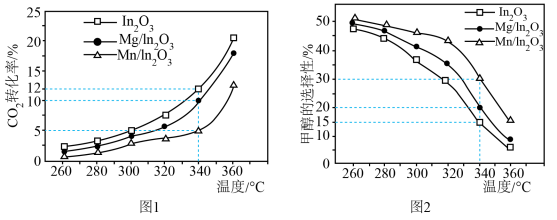
①随着温度的升高, 转化率增大、但甲醇选择性降低的原因是
转化率增大、但甲醇选择性降低的原因是___________ 。
②假设定义催化剂催化效率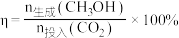 ,计算
,计算 时三种催化剂的催化效率之比
时三种催化剂的催化效率之比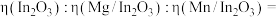
___________ (写出计算过程)。
 的再资源化利用。
的再资源化利用。(1)氨的饱和食盐水捕获
 是其利用的方法之一,反应原理为:
是其利用的方法之一,反应原理为: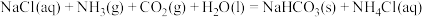 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是(2)
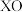 基掺杂
基掺杂 形成
形成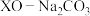 (
(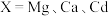 等),能用于捕获
等),能用于捕获 ,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
①
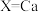 时,再生的化学方程式为
时,再生的化学方程式为②
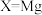 相比
相比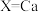 ,其优点有
,其优点有(3)催化电解吸收
 的
的 溶液可将
溶液可将 转化为有机物。
转化为有机物。①
 在阴极放电生成
在阴极放电生成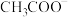 的电极反应式为
的电极反应式为②碱性溶液有利于抑制阴极上副产物的产生,该副产物的化学式为
(4)在催化剂作用下,以
 和
和 为原料合成
为原料合成 ,主要反应为:
,主要反应为:反应Ⅰ:
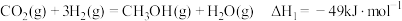
反应Ⅱ:

保持压强
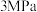 ,将起始
,将起始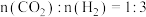 的混合气体匀速通过装有催化剂的反应管,测得出口处
的混合气体匀速通过装有催化剂的反应管,测得出口处 的转化率和甲醇的选择性
的转化率和甲醇的选择性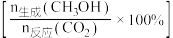 与温度的关系如题图1、题图2所示。
与温度的关系如题图1、题图2所示。
①随着温度的升高,
 转化率增大、但甲醇选择性降低的原因是
转化率增大、但甲醇选择性降低的原因是②假设定义催化剂催化效率
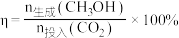 ,计算
,计算 时三种催化剂的催化效率之比
时三种催化剂的催化效率之比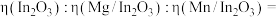
您最近一年使用:0次
2024-02-11更新
|
578次组卷
|
3卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
名校
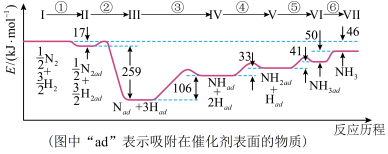
5 . I.铁触媒催化合成氨经历下图所示①~⑥步基元反应(从状态I至状态VII):___________ 步基元反应,“脱附”过程是___________ (填“吸热”或“放热”)过程。
(2)根据上图计算合成氨反应的焓变:

___________ 。
(3)上述反应的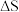 ___________0(填“>”、“<”或“=”)。
___________0(填“>”、“<”或“=”)。
(4)已知: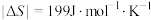 。合成氨反应能自发进行的温度是___________。
。合成氨反应能自发进行的温度是___________。
Ⅱ.为模拟上述工业合成氨的过程,向体积恒为2L的密闭容器(温度恒为T℃)中充入1mol N2和3mol H2发生上述反应,测得N2的体积分数 (N2)随时间(t)的变化如下表所示:
(N2)随时间(t)的变化如下表所示:
(5)40min时,N2的物质的量浓度是___________  (保留三位有效数字)。
(保留三位有效数字)。
(6)0~40min内,用H2表示该反应的平均速率为___________  。
。
(7)用 %表示N2的平衡转化率,则关于上述平衡体系的下列判断正确的是___________。
%表示N2的平衡转化率,则关于上述平衡体系的下列判断正确的是___________。
(8)T℃时,按下表数据向另一2L恒容容器中投料。则该时刻 (N2)
(N2)___________  (N2)(选填“>”、“<”或“=”)。
(N2)(选填“>”、“<”或“=”)。
(2)根据上图计算合成氨反应的焓变:


(3)上述反应的
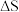 ___________0(填“>”、“<”或“=”)。
___________0(填“>”、“<”或“=”)。| A.> | B.< | C.= | D.无法判断 |
(4)已知:
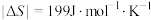 。合成氨反应能自发进行的温度是___________。
。合成氨反应能自发进行的温度是___________。| A.25℃ | B.125℃ | C.225℃ | D.325℃ |
Ⅱ.为模拟上述工业合成氨的过程,向体积恒为2L的密闭容器(温度恒为T℃)中充入1mol N2和3mol H2发生上述反应,测得N2的体积分数
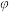 (N2)随时间(t)的变化如下表所示:
(N2)随时间(t)的变化如下表所示:| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
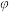 (N2) (N2) | 0.250 | 0.225 | 0.210 | 0.203 | 0.200 | 0.200 |
(5)40min时,N2的物质的量浓度是
 (保留三位有效数字)。
(保留三位有效数字)。(6)0~40min内,用H2表示该反应的平均速率为
 。
。(7)用
 %表示N2的平衡转化率,则关于上述平衡体系的下列判断正确的是___________。
%表示N2的平衡转化率,则关于上述平衡体系的下列判断正确的是___________。A.若向恒温恒容的平衡体系中充入N2,则 %一定增大 %一定增大 |
| B.若向恒温恒压的平衡体系中充入He,则K一定减小 |
| C.若K减小,则温度一定升高 |
D.若 %减小,则K一定减小 %减小,则K一定减小 |
(8)T℃时,按下表数据向另一2L恒容容器中投料。则该时刻
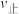 (N2)
(N2) (N2)(选填“>”、“<”或“=”)。
(N2)(选填“>”、“<”或“=”)。| 物质 | 物质的量/mol |
| N2 | 4 |
| H2 | 10 |
| NH3 | 6 |
您最近一年使用:0次
名校
6 . 甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式为:
ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。
回答下列问题:
(1)a=______ (用b、c表示),已知反应ⅱ在一定条件下可自发进行,则b______ (填“>”“<”或“=”)0。
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)___ (填“>”“<”或“=”)v(逆),平衡常数_______ (填“变大”“变小”或“不变”)。
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
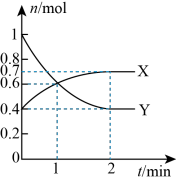
①Y为_____ (填化学式)。
②0~1min时v(CO)为_____ mol/(L·min)。
③该温度下,该反应的平衡常数Kc=______ 。
(4)工业上以 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

______ 。若该反应的 ,
, (
(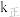 、
、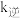 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则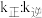
_______ (填“增大”“不变”或“减小”)。
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和 分别取
分别取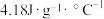 和
和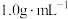 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热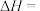
_____  。
。
②下列操作会使所测得的焓变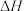 偏小的是
偏小的是______ 。
a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
ⅰ.CO(g)+2H2(g)
 CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。回答下列问题:
(1)a=
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
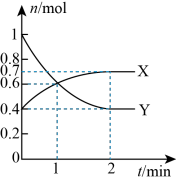
①Y为
②0~1min时v(CO)为
③该温度下,该反应的平衡常数Kc=
(4)工业上以
 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

 ,
, (
(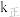 、
、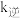 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则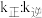
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和
 分别取
分别取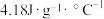 和
和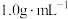 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热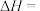
 。
。②下列操作会使所测得的焓变
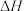 偏小的是
偏小的是a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
您最近一年使用:0次
7 . Ⅰ.铁触媒催化合成氨经历下图所示①至⑥步基元反应(从状态Ⅰ至状态Ⅶ):
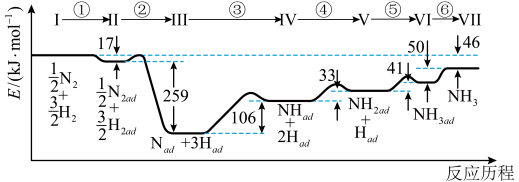
上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=___________ 。
(2)上述反应的ΔS___ 0(填“>”“<”或“=”)。已知:反应N2(g)+3H2(g) 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是____ (填标号)。
A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。
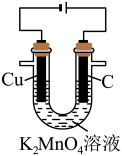
以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH______ (填“升高”“降低”或“不变”)。
(4)铜极、石墨极能否互换并简述理由:___________ 。
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中_______ (填离子符号)向左烧杯迁移。
(6)石墨极的电极反应式为_______ 。实验结论是氧化性:
___  (填>”“<”或“=”)。
(填>”“<”或“=”)。

上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g)
 2NH3(g) ΔH=
2NH3(g) ΔH=(2)上述反应的ΔS
 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。

以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH
(4)铜极、石墨极能否互换并简述理由:
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中
(6)石墨极的电极反应式为

 (填>”“<”或“=”)。
(填>”“<”或“=”)。
您最近一年使用:0次
2024-02-02更新
|
152次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题
名校
8 . Ⅰ.传统的“哈伯法”合成氨原理为: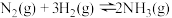
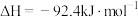
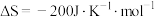
(1)上述反应在常温下___________ (填“能”或“不能”)自发进行。
(2)工业合成氨选择的催化剂是___________ 。
(3)恒温、恒容密闭容器中进行上述反应,一定能说明该反应达到平衡状态的是___________ 。
a. 、
、 、
、 的浓度之比为
的浓度之比为 b.容器内气体压强保持不变
b.容器内气体压强保持不变
c.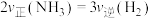 d.混合气体的密度保持不变
d.混合气体的密度保持不变
(4)改变下列条件能加快反应速率,且单位体积内反应物活化分子百分数不变的是___________ 。
a.增大浓度 b.增大压强 c.升高温度 d.使用催化剂
(5)工业合成氨中,下列措施不符合绿色化学理念的是___________ 。
a.将氨气及时液化,分离出反应体系
b.将从反应体系中分离出的 和
和 重新输送到反应器中予以循环利用
重新输送到反应器中予以循环利用
c.氨合成塔中内置热交换器用来预热后续通入的冷的氮气和氢气
d.可采用1000℃的高温使得反应速率更快
Ⅱ.科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入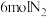 和
和 ,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。

(6) 、
、 、
、 由小到大的顺序为
由小到大的顺序为___________ 。
(7)在 、
、 条件下,若此时容器体积为
条件下,若此时容器体积为 ,
, 后反应达到平衡,则
后反应达到平衡,则 内
内 的平均反应速率为
的平均反应速率为___________ ,平衡常数
___________ (保留两位有效数字)。
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”,在较低的电压下实现氮气的还原合成氨。
已知:第一步: (快)(吸附在催化剂表面的物种用*表示)
(快)(吸附在催化剂表面的物种用*表示)
第二步: (慢)(吸附在催化剂表面)
(慢)(吸附在催化剂表面)
第三步: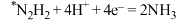 (快)
(快)
(8)较传统工业合成氨法,该方法具有的优点___________ 。
(1)上述反应在常温下
(2)工业合成氨选择的催化剂是
(3)恒温、恒容密闭容器中进行上述反应,一定能说明该反应达到平衡状态的是
a.
 、
、 、
、 的浓度之比为
的浓度之比为 b.容器内气体压强保持不变
b.容器内气体压强保持不变c.
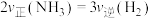 d.混合气体的密度保持不变
d.混合气体的密度保持不变(4)改变下列条件能加快反应速率,且单位体积内反应物活化分子百分数不变的是
a.增大浓度 b.增大压强 c.升高温度 d.使用催化剂
(5)工业合成氨中,下列措施不符合绿色化学理念的是
a.将氨气及时液化,分离出反应体系
b.将从反应体系中分离出的
 和
和 重新输送到反应器中予以循环利用
重新输送到反应器中予以循环利用c.氨合成塔中内置热交换器用来预热后续通入的冷的氮气和氢气
d.可采用1000℃的高温使得反应速率更快
Ⅱ.科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入
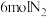 和
和 ,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
(6)
 、
、 、
、 由小到大的顺序为
由小到大的顺序为(7)在
 、
、 条件下,若此时容器体积为
条件下,若此时容器体积为 ,
, 后反应达到平衡,则
后反应达到平衡,则 内
内 的平均反应速率为
的平均反应速率为
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”,在较低的电压下实现氮气的还原合成氨。
已知:第一步:
 (快)(吸附在催化剂表面的物种用*表示)
(快)(吸附在催化剂表面的物种用*表示)第二步:
 (慢)(吸附在催化剂表面)
(慢)(吸附在催化剂表面)第三步:
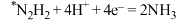 (快)
(快)(8)较传统工业合成氨法,该方法具有的优点
您最近一年使用:0次
解题方法
9 . 氢能源是最具应用前景的能源之一,甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法,其涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: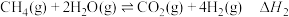
反应Ⅲ:
回答下列问题:
(1)
___________  ,反应Ⅱ能在
,反应Ⅱ能在___________ (填“高温”或“低温”)的条件下自发进行。
(2)某温度下,按照投料比 加入密闭容器中发生反应Ⅰ,平衡时
加入密闭容器中发生反应Ⅰ,平衡时 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为___________ (填分数);实际生产中反应物投料比小于反应的化学计量数之比,目的是___________ 。
(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高 的产率。应用化学平衡移动原理解释原因
的产率。应用化学平衡移动原理解释原因___________ 。
(4)在T℃、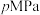 条件下,向恒温恒容密闭容器中充入
条件下,向恒温恒容密闭容器中充入 水蒸气和
水蒸气和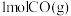 ,发生反应Ⅲ,达平衡时,
,发生反应Ⅲ,达平衡时, 的转化率为
的转化率为 。平衡时,
。平衡时, 的平衡分压为
的平衡分压为___________ 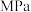 ,此温度下,该反应的平衡常数
,此温度下,该反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(5)调整CO和 初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:

A、B、C、D、E中温度最高的点是___________ 。
反应Ⅰ:

反应Ⅱ:
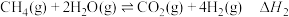
反应Ⅲ:

回答下列问题:
(1)

 ,反应Ⅱ能在
,反应Ⅱ能在(2)某温度下,按照投料比
 加入密闭容器中发生反应Ⅰ,平衡时
加入密闭容器中发生反应Ⅰ,平衡时 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高
 的产率。应用化学平衡移动原理解释原因
的产率。应用化学平衡移动原理解释原因(4)在T℃、
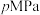 条件下,向恒温恒容密闭容器中充入
条件下,向恒温恒容密闭容器中充入 水蒸气和
水蒸气和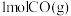 ,发生反应Ⅲ,达平衡时,
,发生反应Ⅲ,达平衡时, 的转化率为
的转化率为 。平衡时,
。平衡时, 的平衡分压为
的平衡分压为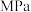 ,此温度下,该反应的平衡常数
,此温度下,该反应的平衡常数
 物质的量分数)。
物质的量分数)。(5)调整CO和
 初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
A、B、C、D、E中温度最高的点是
您最近一年使用:0次
名校
10 . 研究碳、氮等元素化合物的性质或转化对体会化学与生活有重要意义。
Ⅰ.以CO2和NH3为原料合成尿素总反应为:CO2 (g)+ 2NH3 (g) CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
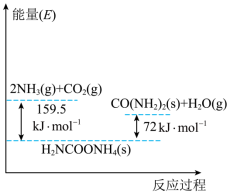
(1)总反应的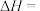
______  ,该反应在
,该反应在______ (填“高温”或“低温”或“任何条件都不”)可以自发进行。
(2)若该反应在恒容密闭容器中进行,判断该反应达到化学平衡状态的依据是________ (填字母序号)。
(3)在恒温、体积为1L的恒容装置中通入CO2和NH3各1mol 、1.5mol,达平衡时CO2的转化率为50%,平衡常数的值为_______ 。
Ⅱ.亚硝酸钠(NaNO2)是肉制品生产中常使用的一种食品添加剂,外观与食盐极为相似,具有较强毒性,误食可能造成死亡。已知常温下 Ka(HNO2)=1.75×10-4,Ka(CH3COOH)=1.8×10-5。
(4)常温下,pH=4的HNO2溶液中,由水电离出的c(H+)约为______ mol·L-1,浓度均为 0.1mol/L 的 NaNO2和 CH3COONa 的混合溶液中各离子浓度由大到小的关系为__________ 。
(5)高锰酸钾常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02000 mol·L-1 KMnO4标准溶液(酸性)进行滴定,反应离子方程式是: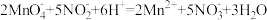 ,滴定结束后消耗KMnO4溶液VmL。
,滴定结束后消耗KMnO4溶液VmL。
进行滴定操作时无需另加指示剂,达到滴定终点时的现象是_______ ,测得该样品中NaNO2的质量分数为_______ 。(写出计算式)
Ⅰ.以CO2和NH3为原料合成尿素总反应为:CO2 (g)+ 2NH3 (g)
 CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
(1)总反应的
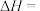
 ,该反应在
,该反应在(2)若该反应在恒容密闭容器中进行,判断该反应达到化学平衡状态的依据是________ (填字母序号)。
| A.反应速率2 v(CO2) = v(NH3) | B.混合气体中 CO2的浓度保持不变 |
| C.混合气体密度不变 | D.消耗2 mol NH3的同时生成 1 mol H2O |
(3)在恒温、体积为1L的恒容装置中通入CO2和NH3各1mol 、1.5mol,达平衡时CO2的转化率为50%,平衡常数的值为
Ⅱ.亚硝酸钠(NaNO2)是肉制品生产中常使用的一种食品添加剂,外观与食盐极为相似,具有较强毒性,误食可能造成死亡。已知常温下 Ka(HNO2)=1.75×10-4,Ka(CH3COOH)=1.8×10-5。
(4)常温下,pH=4的HNO2溶液中,由水电离出的c(H+)约为
(5)高锰酸钾常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02000 mol·L-1 KMnO4标准溶液(酸性)进行滴定,反应离子方程式是:
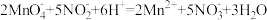 ,滴定结束后消耗KMnO4溶液VmL。
,滴定结束后消耗KMnO4溶液VmL。进行滴定操作时无需另加指示剂,达到滴定终点时的现象是
您最近一年使用:0次



