解题方法
1 . 合成气(CO+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品。
(1)煤化工中生产合成气的反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.5kJ·mol-1
CO(g)+H2(g) ΔH=+131.5kJ·mol-1
①判断该反应的自发性条件___________ ;
②在恒温恒容下,同时放入C(s)、H2O(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H2O(g) CO(g)+H2(g)已达到平衡的是
CO(g)+H2(g)已达到平衡的是___________ 。
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH—O键断裂的同时有1molH—H键断裂
D.混合气体的平均相对分子质量保持不变
(2)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g) 2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
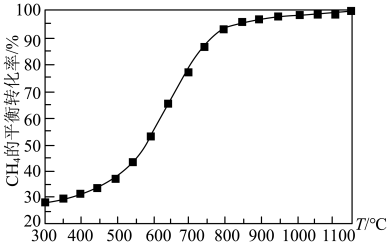
①请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线________ 。
②现有实验测得反应2CH4(g)+O2(g) 2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
最佳碳氧比[n(CH4)/n(O2)]为___________ 。
(1)煤化工中生产合成气的反应为:C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.5kJ·mol-1
CO(g)+H2(g) ΔH=+131.5kJ·mol-1①判断该反应的自发性条件
②在恒温恒容下,同时放入C(s)、H2O(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H2O(g)
 CO(g)+H2(g)已达到平衡的是
CO(g)+H2(g)已达到平衡的是A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH—O键断裂的同时有1molH—H键断裂
D.混合气体的平均相对分子质量保持不变
(2)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g)
 2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
①请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线
②现有实验测得反应2CH4(g)+O2(g)
 2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)| 碳氧比[n(CH4)/n(O2)] | 1︰0.25 | 1︰0.5 | 1︰1 | 1︰1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
您最近一年使用:0次
解题方法
2 .  的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。
Ⅰ.利用 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:
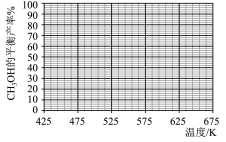
反应①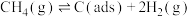

反应②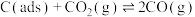

有关物质的相对能量与反应历程的变化如图所示[ 为吸附性活性炭]:
为吸附性活性炭]:
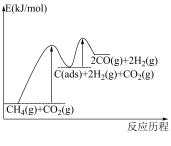
(1)总反应 能自发进行的条件为
能自发进行的条件为_______ 。
(2)总反应速率由反应_______ (填“①”或“②”)决定,增加 的浓度,
的浓度,_______ (填“能”或“不能”)显著提升总反应的速率。
Ⅱ.工业上可利用 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:
反应③

反应④
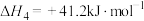
在5MPa的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。

(3)在425℃~675℃范围内(其他条件不变), 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:_______ ,_______ 。
(4)下列说法正确的是_______(填字母)。
(5)反应④在545K时的平衡常数
_______ 。
(6)结合上图,在下图中画出 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线_______ (标出B点坐标)。
 的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。Ⅰ.利用
 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:反应①
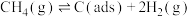

反应②
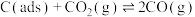

有关物质的相对能量与反应历程的变化如图所示[
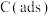 为吸附性活性炭]:
为吸附性活性炭]:
(1)总反应
 能自发进行的条件为
能自发进行的条件为(2)总反应速率由反应
 的浓度,
的浓度,Ⅱ.工业上可利用
 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:反应③


反应④

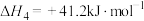
在5MPa的恒压反应器中,按照
 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。
(3)在425℃~675℃范围内(其他条件不变),
 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:(4)下列说法正确的是_______(填字母)。
| A.曲线Ⅱ代表CO的选择性随温度的变化 |
B.温度越低,越有利于工业生产 |
C.上述反应条件下, 的平衡转化率等于 的平衡转化率等于 的平衡转化率 的平衡转化率 |
D.原料气中掺入适量CO能提高 的产率 的产率 |
(5)反应④在545K时的平衡常数

(6)结合上图,在下图中画出
 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线
您最近一年使用:0次
解题方法
3 . 一个化学反应在给定条件(通常指温度、压强)下能否自发进行以及在什么条件下有可能按预期的方向发生,需寻求一种客观的判据,用它来判断一个化学反应能否正向自发进行。研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。在研究了大量实验的基础上,人们发现可以用化学平衡常数来定量描述化学反应的限度。
(1)下列关于自发反应的叙述,正确的是___________。
(2)下列说法中正确的是___________。
(3)某温度下,可逆反应 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。
(4)在一定温度下,下列反应的化学平衡常数数值如下:
①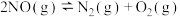
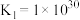
②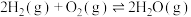
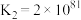
③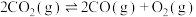
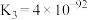
下列说法正确的是___________。
(5)在某密闭容器中把CO和 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。
(6)地下水中的氮污染主要是由 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: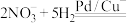

①氮肥 溶于水的过程中熵值
溶于水的过程中熵值___________ (填“增大”或“减小”),Pd/Cu双金属催化剂___________ (填“是”或“不是”)决定反应自发发生的决定因素。
②已知: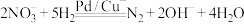 的
的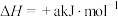 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应___________ (填“能”“不能”或“无法判断是否能”)自发进行。
(7)在一定体积的密闭容器中进行如下化学反应:
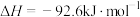 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:
①试判断
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
②T℃( )的某时刻下,
)的某时刻下, ,
,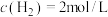 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态___________ (选填“是”或“否”),此时反应速率是
___________  (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是___________ 。
(1)下列关于自发反应的叙述,正确的是___________。
| A.自发反应的逆过程在相同条件下也必定是自发的 |
| B.铁在潮湿的空气中生锈属于非自发反应 |
| C.自发过程可以是物理过程,不一定是自发反应,而自发反应一定是自发过程 |
| D.自发反应与外界条件无关 |
A.若 , , ,化学反应在任何温度下都能自发进行 ,化学反应在任何温度下都能自发进行 |
B.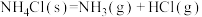 在室温下不能自发进行,则该反应的 在室温下不能自发进行,则该反应的 |
C. 在低温下能自发进行,则该反应的 在低温下能自发进行,则该反应的 |
| D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变 |
 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。| A.温度越高,K一定越大 |
B.如果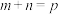 ,则 ,则 |
| C.若缩小反应器的容积,增大压强,则K增大 |
| D.K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
①
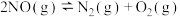
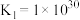
②
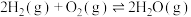
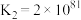
③
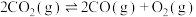
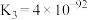
下列说法正确的是___________。
A.该温度下,反应①的平衡常数表达式为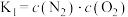 |
B.该温度下,反应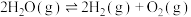 的平衡常数的数值约为 的平衡常数的数值约为 |
C.该温度下,反应①、反应②的逆反应、反应③产生 的倾向由大到小的顺序为 的倾向由大到小的顺序为 |
| D.以上说法都不正确 |
 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。| A.40% | B.50% | C.60% | D.83.3% |
 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: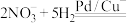

①氮肥
 溶于水的过程中熵值
溶于水的过程中熵值②已知:
 的
的 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应(7)在一定体积的密闭容器中进行如下化学反应:

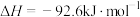 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:| T℃ | 25 | 125 | 225 |
| K | 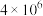 |  |  |

 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)②T℃(
 )的某时刻下,
)的某时刻下, ,
,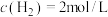 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态
 (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是
您最近一年使用:0次
解题方法
4 . 研究化学反应进行的方向对于反应设计等具有重要意义,下列说法正确的是
A. <0、 <0、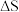 >0的反应在温度低时不能自发进行 >0的反应在温度低时不能自发进行 |
| B.在其他外界条件不变的情况下,汽车排气管中使用催化剂可以改变产生尾气的反应方向 |
| C.冰在室温下自动熔化成水是一个熵增的过程 |
D.一定温度下,反应MgCl2(1) Mg(1)+Cl2(g)的 Mg(1)+Cl2(g)的 <0、 <0、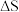 >0 >0 |
您最近一年使用:0次
解题方法
5 . 下列有关说法正确的是
| A.回收处理废旧电池,主要是为了变废为宝 |
| B.在化学工业中,选用催化剂一定能提高经济效益 |
C.反应 在室温下可自发进行,则该反应的 在室温下可自发进行,则该反应的 |
| D.可用pH试纸测定新制氯水的pH,但是不能用蒸馏水将pH试纸事先润湿 |
您最近一年使用:0次
6 . 化学反应伴随着能量变化,研究化学反应中的能量变化具有重大意义。请回答下列问题:
Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:
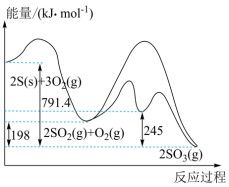
(1)表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为______ 。
(2)对于反应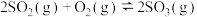 :
:
①______ (填“低温”、“高温”或“任意温度”)有利于该反应正向自发进行。
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是______ (填标号)。
A.升高温度 B.压缩容器体积 C.增大 浓度 D.再充入一定量的
浓度 D.再充入一定量的
Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
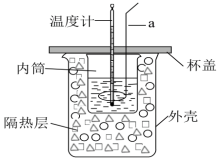
实验步骤:
①量取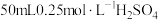 ,溶液倒入小烧杯中,测量温度;
,溶液倒入小烧杯中,测量温度;
②量取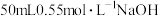 溶液,测量温度;
溶液,测量温度;
③将溶液倒入小烧杯中,混合均匀后测量混合液温度。
(3)仪器a的名称为______ ,使用的溶液稍微过量的原因是______ 。
(4)实验数据记录:
(5)实验过程中,向 溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
______ (填“偏大”或“偏小”,下同);若用 氨水代替NaOH溶液,将会导致测得的
氨水代替NaOH溶液,将会导致测得的
______ 。
Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:

(1)表示
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)对于反应
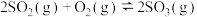 :
:①
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是
A.升高温度 B.压缩容器体积 C.增大
 浓度 D.再充入一定量的
浓度 D.再充入一定量的
Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。

实验步骤:
①量取
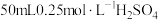 ,溶液倒入小烧杯中,测量温度;
,溶液倒入小烧杯中,测量温度;②量取
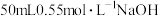 溶液,测量温度;
溶液,测量温度;③将溶液倒入小烧杯中,混合均匀后测量混合液温度。
(3)仪器a的名称为
(4)实验数据记录:
实验次数 | 反应物的初始温度/℃ | 反应后体系的温度/℃ | ||
H2SO4溶液 | NaOH溶液 | 平均值 | ||
1 | 25.2 | 25.4 | 28.6 | |
2 | 24.9 | 25.1 | 28.4 | |
3 | 25.3 | 25.3 | 28.0 | |
4 | 25.0 | 25.2 | 28.3 | |
设实验所用的酸、碱溶液的密度均为 ,反应前后溶液的比热容
,反应前后溶液的比热容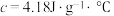 。计算该实验的
。计算该实验的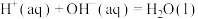

 。
。
(5)实验过程中,向
 溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
 氨水代替NaOH溶液,将会导致测得的
氨水代替NaOH溶液,将会导致测得的
您最近一年使用:0次
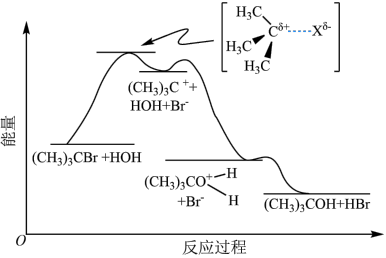
7 . 已知:空间位阻越大,离去越容易。2-溴-2-甲基丙烷(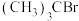 )发生水解反应[
)发生水解反应[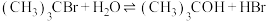 ]的能量变化与反应过程的关系如图所示。下列说法不正确的是
]的能量变化与反应过程的关系如图所示。下列说法不正确的是
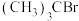 )发生水解反应[
)发生水解反应[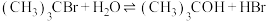 ]的能量变化与反应过程的关系如图所示。下列说法不正确的是
]的能量变化与反应过程的关系如图所示。下列说法不正确的是
| A.该反应在低温下自发进行 |
B.碘原子半径比氧大,因此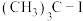 水解生成 水解生成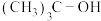 的速率比 的速率比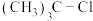 快 快 |
| C.升高温度,可能加快反应速率,同时提高2-溴-2甲基丙烷的平衡转化率 |
D.为了提高2-溴-2-甲基丙烷的水解程度,可以加入适量 固体 固体 |
您最近一年使用:0次
名校
8 . 某小组学生用如图所示简易量热计进行中和反应反应热的测定。近似处理实验所用酸、碱溶液的密度为1.0 g∙cm-3、比热容为4.2J/(g∙℃),忽略量热计的比热容。
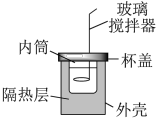
【药品】:50mL 0.50mol/L 盐酸、50mL 0.55mol/L NaOH溶液、50mL 0.55mol/L KOH溶液。
【实验数据】学生甲进行的三次实验数据如下表所示:
(1)从实验装置上看,还缺少的仪器名称是___________ 。
(2)学生甲实测数据处理
①∆t=___________ ℃。
②放出的热量Q甲___________ kJ(保留一位数)。
③Q甲kJ比该反应理论上放热为Q kJ略微偏小,其原因可能是___________ (写一条)。
(3)学生乙选用KOH溶液,其他均与学生甲同,且操作规范,预测实验放出热量的数值Q乙___________ Q甲(填“<”或“=”或“>”)。
(4)写出上面实验理论上生成1mol H2O时,中和反应的反应热的热化学方程式为(用含Q的代数式表示)___________ 。
(5)TiO2转化为TiCl4有直接氯化法和碳氯化法。1000 ℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+172 kJ·mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH2=-51 kJ·mol-1,Kp2=1.2×1012Pa
①反应2C(s)+O2(g)=2CO(g)的ΔH为___________ kJ·mol-1,Kp=___________ Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是___________ 。
③数据显示在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是___________ 。
④TiO2碳氯化是一个“气-固-固”反应,有利于TiO2-C“固-固”接触的措施是___________ 。

【药品】:50mL 0.50mol/L 盐酸、50mL 0.55mol/L NaOH溶液、50mL 0.55mol/L KOH溶液。
【实验数据】学生甲进行的三次实验数据如下表所示:
| 实验次数 | 反应前体系的温度/℃ | 反应后体系温度/℃ | 温度差平均值/℃ | ||
| 50mL 0.50mol/L盐酸 | 50mL 0.55mol/L NaOH溶液 | 平均值 | |||
| 1 | 24.9 | 25.1 | 28.4 | ∆t | |
| 2 | 25.1 | 25.0 | 26.3 | ||
| 3 | 25.0 | 25.0 | 28.4 | ||
(1)从实验装置上看,还缺少的仪器名称是
(2)学生甲实测数据处理
①∆t=
②放出的热量Q甲
③Q甲kJ比该反应理论上放热为Q kJ略微偏小,其原因可能是
(3)学生乙选用KOH溶液,其他均与学生甲同,且操作规范,预测实验放出热量的数值Q乙
(4)写出上面实验理论上生成1mol H2O时,中和反应的反应热的热化学方程式为(用含Q的代数式表示)
(5)TiO2转化为TiCl4有直接氯化法和碳氯化法。1000 ℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+172 kJ·mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH2=-51 kJ·mol-1,Kp2=1.2×1012Pa
①反应2C(s)+O2(g)=2CO(g)的ΔH为
②碳氯化的反应趋势远大于直接氯化,其原因是
③数据显示在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
④TiO2碳氯化是一个“气-固-固”反应,有利于TiO2-C“固-固”接触的措施是
您最近一年使用:0次
9 . 证据推理是化学学科重要核心素养。下列证据能得出相应推论的是
| 选项 | 证据 | 推论 |
| A | 反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g)能自发进行 C2H4(g)+4H2O(g)能自发进行 | 该反应的△H<0 |
| B | 增大压强,化学反应速率加快 | 增大压强,活化分子百分数增多,有效碰撞概率增大 |
| C | 用pH计测定浓度相等的NaClO溶液和Na2CO3溶液的pH,NaClO溶液碱性更强 | 酸性:H2CO3>HClO |
| D | 向双氧水中滴加浓硫酸,产生气体的速率加快 | 浓硫酸对H2O2的分解具有催化作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . “节能减排”和“低碳经济”的一项重要课题就是如何将 转化为可利用的资源。
转化为可利用的资源。
Ⅰ.目前工业上有一种方法是用 来生产燃料甲醇。
来生产燃料甲醇。
已知: 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol 、
、 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol
反应①:
 kJ⋅mol
kJ⋅mol
反应②:
 kJ⋅mol
kJ⋅mol
反应③:

(1)


(2)恒温条件下,在某恒容密闭容器中;按照
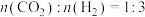 投料发生反应③,测得
投料发生反应③,测得 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。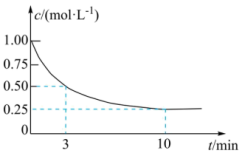
①从反应开始到3 min, 的平均反应速率
的平均反应速率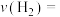
 ⋅min
⋅min ;试在图中绘制出
;试在图中绘制出 的浓度随时间变化的图像
的浓度随时间变化的图像
②该反应的平衡常数
(3)恒温条件下,在某恒压密闭容器中仅发生反应①,当反应达到平衡后,
Ⅰ.降低温度,CO的平衡转化率
Ⅱ.向平衡体系中通入惰性气体,平衡
您最近一年使用:0次



