名校
解题方法
1 . 今有室温下四种溶液,下列有关叙述不正确的是
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 |
| B.②和③两溶液等体积混合,所得溶液中c(H+)<c(OH-) |
| C.分别加水稀释10倍,四种溶液的pH:①>②>④>③ |
| D.V1 L ④与V2 L ①溶液混合后,若混合后溶液pH=7,则V1<V2 |
您最近一年使用:0次
2021-02-22更新
|
483次组卷
|
58卷引用:新疆石河子第一中学人教版高中化学选修4知识点练习:3.3.2 盐类水解
新疆石河子第一中学人教版高中化学选修4知识点练习:3.3.2 盐类水解新疆霍城县江苏中学2018-2019学年高二上学期期末考试化学试题(已下线)2014高考名师推荐化学弱电解电离2015届浙江省嘉兴市一中等五校高三上学期第一次联考化学试卷2015届浙江省高三第一次五校联考化学试卷2016届山东省枣庄第三中学高三上10月阶段质检化学试卷2015-2016学年浙江余姚中学高二上学期期中考试化学试卷2015-2016学年黑龙江省大兴安岭实验中学高二上学期期末化学试卷2016-2017学年四川省双流中学高二3月月考化学试卷2018版化学(苏教版)高考总复习专题八课时跟踪训练--弱电解质的电离平衡黑龙江省哈尔滨市第三中学2018届高三上学期(10月)第二次验收考试化学试题河南省商丘市第一高级中学2017-2018学年高二上学期期中考试化学试题贵州省铜仁市第一中学2017-2018学年高二上学期期末考试化学试题福建省晋江市季延中学2017-2018学年高二下学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)10月月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期末考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高二下学期开学考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题北京市2019—2020学年高二上学期期中考试化学试题(选修4人教版)北京市2019—2020学年高二上学期期末考试模拟试题(选修4人教版 )2019—2020学年高二上学期化学期末复习—选择题专题训练一湖南省株洲市醴陵市第四中学2019-2020学年高二上学期12月月考化学试题(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》宁夏石嘴山市第三中学2020届高三12月月考化学试题辽宁省丹东市凤城市第一中学2019-2020学年高二上学期12月月考化学试题黑龙江省哈尔滨市尚志市尚志中学2019-2020学年高二上学期第三次月考化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题河南省驻马店市正阳县高级中学2019-2020学年高二上学期第三次素质检测化学试题黑龙江省哈尔滨工业大学附属中学2019-2020学年高二上学期期末考试化学试题安徽省合肥市六校2019-2020学年高二上学期期末考试化学(理)试题云南省陆良县联办高级中学2019-2020学年高二上学期期末考试化学试题安徽省枞阳县浮山中学2019-2020学年高二下学期开学考试化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二下学期期中考试化学试题河北省枣强中学2019-2020学年高二下学期第三次月考化学试题四川省成都龙泉第二中学2021届高三上学期九月月考化学试题江西省高安中学2020-2021学年高二第一次段考化学(B)试题山东省临沂市第四中学2020-2021学年高二11月份阶段检测化学试题四川省成都市简阳市阳安中学2020-2021学年高二上学期期中考试化学试题安徽省肥东县高级中学2020-2021学年高二上学期期中考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题河南省漯河市漯河实验高中2020-2021学年高二上学期期中考试化学试题甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题江西省南昌市第十中学2020-2021学年高二上学期期末考试化学试题湖北省石首市第一中学2020-2021学年高二上学期12月月考化学试题(已下线)【浙江新东方】高中化学20210304-004黑龙江大庆市东风中学2020-2021学年高二下开学测试化学试题湖南省常德市一中2020-2021学年高二下学期第一次月考化学试题(已下线)第24讲 水的电离和溶液的pH(精讲)-2022年一轮复习讲练测(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)北京市第十四中学2021-2022学年高二上学期期中考试化学试题湖北省恩施利川市第五中学2019-2020学年高二上学期期中考试化学试题重庆育才中学2021-2022学年高二上学期第三次定时练习化学试题湖南省临澧县第一中学2021-2022学年高二上学期期中段考化学试题湖南省常德市临澧县第一中学2021-2022学年高二上学期期中考试化学试题江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题四川省峨眉第二中学校2021-2022学年高二下学期5月月考化学试题上海市虹口区2021-2022学年高一下学期联合体期末模拟考试化学试题湖北省潜江市华中师范大学潜江附属中学2021-2022学年高二上学期期中考试化学试题
名校
2 . 等物质的量的NH4Cl和NH3·H2O的混合溶液
电荷守恒:________
物料守恒:________
质子守恒:________
电荷守恒:
物料守恒:
质子守恒:
您最近一年使用:0次
名校
解题方法
3 . pH=3的HF和pH=11的NaOH溶液等体积混合后,溶液显________ ,溶液中的离子浓度大小关系是_________ 。
您最近一年使用:0次
名校
解题方法
4 . 0.2 mol/L CH3COOH溶液和0.1 mol/L NaOH溶液等体积混合,则溶液显_______ ,溶液中离子浓度大小关系是______ 。
您最近一年使用:0次
名校
解题方法
5 . 常温下,有下列五种溶液
回答下列问题:
(1)溶液①稀释到原来的100倍后的溶液pH______ ③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______ ④。
(2)在相同温度时,10mL ①的溶液与100mL②的溶液相比较,下列数值后者大于前者的是_________________________________ (填字母)。
A.中和时所需NaOH的量
B.电离程度
C.水电离出的c(H+)
D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是______ (填字母)。
A.C(OH-) B.C(NH3·H2O)/C(OH-)
C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)在体积相等、pH相等的 ③ 溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体_______ (填“多”、“少”或“相等”)。
| ① | ② | ③ | ④ | ⑤ |
| 0.1 mol/L CH3COOH溶液 | 0.01 mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 | 0.1 mol/L NaOH溶液 | 0.1 mol/L 氨水 |
回答下列问题:
(1)溶液①稀释到原来的100倍后的溶液pH
(2)在相同温度时,10mL ①的溶液与100mL②的溶液相比较,下列数值后者大于前者的是
A.中和时所需NaOH的量
B.电离程度
C.水电离出的c(H+)
D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是
A.C(OH-) B.C(NH3·H2O)/C(OH-)
C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)在体积相等、pH相等的 ③ 溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体
您最近一年使用:0次
名校
解题方法
6 . 25 ℃时,水的电离达到平衡:H2O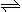 H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
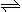 H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H﹢)增大,Kw不变 |
| C.向水中通入少量HCl气体,平衡正向移动,c(H﹢)增大 |
| D.将水加热,Kw增大,pH不变 |
您最近一年使用:0次
名校
解题方法
7 . 混合溶液中离子浓度大小比较(一般情况弱电解质的电离程度约为百分之一,而盐类水解程度约为千分之一)
(1)等物质的量的NH3·H2O和NH4Cl的混合溶液中存在的水解平衡是____ ,存在的电离平衡是____ (不写水的电离平衡),由于NH3·H2O的电离程度_____ NH4Cl的水解程度,故溶液显____ 性。溶液中离子浓度大小关系是_________ 。
(2)等物质的量的CH3COOH和CH3COONa的混合溶液中存在的水解平衡是____ ,存在的电离平衡是_______ (不写水的电离平衡),由于CH3COOH的电离程度_____ CH3COONa的水解程度,故溶液显____ 性。溶液中离子浓度大小关系是_________ 。
(3)等物质的量的HCN和NaCN的混合溶液中存在的水解平衡是___ ,存在的电离平衡是___ (不写水的电离平衡),由于HCN的电离程度_____ NaCN的水解程度,故溶液显____ 性。溶液中离子浓度大小关系是____ 。
(1)等物质的量的NH3·H2O和NH4Cl的混合溶液中存在的水解平衡是
(2)等物质的量的CH3COOH和CH3COONa的混合溶液中存在的水解平衡是
(3)等物质的量的HCN和NaCN的混合溶液中存在的水解平衡是
您最近一年使用:0次
名校
解题方法
8 . 0.2 mol/L的HCN溶液和0.1 mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系不正确的是_______
| A.c(HCN)>c(CN-) | B.c(Na+)>c(CN-) |
| C.c(HCN)-c(CN-)=c(OH-) | D.c(HCN)+c(CN-)=0.1 mol/L |
您最近一年使用:0次
名校
解题方法
9 . 常温下,关于1L pH=3的H2SO4溶液说法正确的是
| A.与等体积pH=11氨水混合后所得溶液pH小于7 |
| B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 |
| C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3 |
| D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
您最近一年使用:0次
名校
10 . (1)内因:___________________ 。
(2)外因:①浓度:_________________________
②温度:________________________________________
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显__________ ,原因是_____________________________ 。多元弱酸酸式盐溶液的酸碱性取决于_____________________________________ ,例如NaHCO3溶液显碱性,原因是_________________ ,_______________________________ (离子方程式和文字说明);
NaHSO3溶液显酸性的原因是________________ ,_____________________ (离子方程式和文字说明)。
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-_______________
(2)外因:①浓度:
②温度:
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显
NaHSO3溶液显酸性的原因是
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O
 CH3COOH+OH-
CH3COOH+OH-| 改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
| 加入CH3COONa | ||||
| 通入HCl | ||||
| 升温 | ||||
| 加水 | ||||
| 加NaOH | ||||
| 加HAc | ||||
| 加NH4Cl |
您最近一年使用:0次



