解题方法
1 . 天然水体中的H2CO3与空气中的CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9, 某溶洞水体中lg c(X)(X为H2CO3、HCO 、CO
、CO 或Ca2+) 与pH的关系如图所示。下列说法正确的是
或Ca2+) 与pH的关系如图所示。下列说法正确的是

 、CO
、CO 或Ca2+) 与pH的关系如图所示。下列说法正确的是
或Ca2+) 与pH的关系如图所示。下列说法正确的是
A.曲线①代表CO |
| B.H2CO3的一级电离常数为10-8.3 |
| C.c(Ca2+)随 pH升高而增大 |
| D.pH=8.3 时,c(Ca2+)=2.8×10-4 mol·L-1 |
您最近一年使用:0次
2023-02-08更新
|
261次组卷
|
2卷引用:湖南省娄底市涟源市2023-2024学年高二上学期1月期末考试化学试题
名校
解题方法
2 . 下列图示实验正确的是
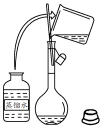 | 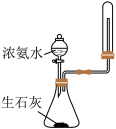 |
| A.洗涤烧杯并将洗涤液转入容量瓶 | B.实验室快速制备 |
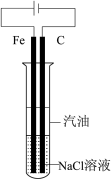 |  |
C.制备并观察 的颜色 的颜色 | D.证明溶解度: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是 ,还含有
,还含有 、
、 、CuO等杂质)制取碳酸锰的流程如下图所示:
、CuO等杂质)制取碳酸锰的流程如下图所示:

已知:①还原焙烧的主反应为
②氧化能力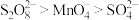
可能用到的数据如下:
根据要求回答下列问题:
(1)基态锰原子的价层电子排布式为_______ , 中存在过氧键(—O—O—),请问
中存在过氧键(—O—O—),请问 中S的化合价为
中S的化合价为_______ 。
(2)在实验室进行步骤A操作时,可能用到的主要仪器为_______ 。
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节 ,其目的是
,其目的是_______ 。
(4)步骤G发生的离子方程式为_______ ,若 恰好沉淀完全时测得溶液中
恰好沉淀完全时测得溶液中 的浓度为
的浓度为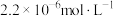 ,则
,则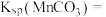
_______ 。
(5)实验室可以用 溶液来检验
溶液来检验 是否完全发生反应,请写出对应的离子方程式
是否完全发生反应,请写出对应的离子方程式_______ 。
 ,还含有
,还含有 、
、 、CuO等杂质)制取碳酸锰的流程如下图所示:
、CuO等杂质)制取碳酸锰的流程如下图所示:
已知:①还原焙烧的主反应为

②氧化能力
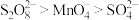
可能用到的数据如下:
| 氢氧化物 |  |  |  |  |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)基态锰原子的价层电子排布式为
 中存在过氧键(—O—O—),请问
中存在过氧键(—O—O—),请问 中S的化合价为
中S的化合价为(2)在实验室进行步骤A操作时,可能用到的主要仪器为
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节
 ,其目的是
,其目的是(4)步骤G发生的离子方程式为
 恰好沉淀完全时测得溶液中
恰好沉淀完全时测得溶液中 的浓度为
的浓度为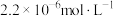 ,则
,则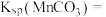
(5)实验室可以用
 溶液来检验
溶液来检验 是否完全发生反应,请写出对应的离子方程式
是否完全发生反应,请写出对应的离子方程式
您最近一年使用:0次
解题方法
4 . 下列离子方程式书写正确的是
A.利用覆铜板制作图案的原理: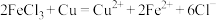 |
B.含氟牙膏防治龋齿的原理: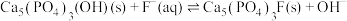 |
C.用醋酸除去水垢中的碳酸钙: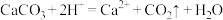 |
D.小苏打可中和过多的胃酸: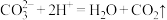 |
您最近一年使用:0次
名校
解题方法
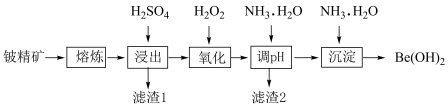
5 . 铍是一种核性能优良的材料,铍精矿的主要成分为铍、铝、硅、铁的氧化物、碳酸钙及部分其他杂质,以铍精矿为原料制备氢氧化铍的工艺流程如图所示:
已知:i. 和
和 可通过调节溶液
可通过调节溶液 实现分步沉淀;
实现分步沉淀;
ii. 与
与 具有相似的化学性质。
具有相似的化学性质。
下列说法正确的是

已知:i.
 和
和 可通过调节溶液
可通过调节溶液 实现分步沉淀;
实现分步沉淀;ii.
 与
与 具有相似的化学性质。
具有相似的化学性质。下列说法正确的是
A.“熔炼”过程中 不发生化学变化 不发生化学变化 |
B.“氧化”工序中用 代替 代替 可达到目的且不影响产品纯度 可达到目的且不影响产品纯度 |
C.“沉淀”工序中需严格控制 加入量,以减少 加入量,以减少 溶解损失 溶解损失 |
D.“氧化”工序的主要反应为 |
您最近一年使用:0次
2023-01-12更新
|
323次组卷
|
3卷引用:湖南省益阳市2022-2023学年高三上学期期末质量检测化学试题
名校
解题方法
6 . 印刷电路板废液主要含 、
、 以及少量的
以及少量的 等物质,以废液为原料制备
等物质,以废液为原料制备 ,实现资源回收再利用,流程如图所示。
,实现资源回收再利用,流程如图所示。

(1)粗 溶液的制备
溶液的制备
①上述流程中能加快反应速率的措施有_______ 。
②加入铁屑后,印刷电路板废液中发生的离子反应有_______ 。
(2) 溶液的精制
溶液的精制
ⅰ.经检验,粗 溶液含有
溶液含有
ⅱ.向粗 溶液滴加3%的
溶液滴加3%的 溶液,当溶液中
溶液,当溶液中 完全氧化后,加
完全氧化后,加 粉末调节溶液的
粉末调节溶液的 。
。
ⅲ.将溶液加热至沸,趁热减压过滤,得到精制 溶液。
溶液。
①用离子方程式说明加入 溶液的作用
溶液的作用_______ 。
②已知25℃时, ,
,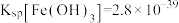 。调节溶液
。调节溶液 ,此时
,此时
_______ mol⋅L ,
, 已沉淀完全。
已沉淀完全。
③ 时判断
时判断 尚未开始沉淀,根据是此时溶液中
尚未开始沉淀,根据是此时溶液中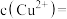
_______ mol⋅L ,与饱和溶液中
,与饱和溶液中 的物质的量浓度相比
的物质的量浓度相比_______ (填“大”“小”或“相等”)(已知25℃时 饱和溶液中
饱和溶液中 的物质的量浓度为1.41 mol⋅L
的物质的量浓度为1.41 mol⋅L )
)
 、
、 以及少量的
以及少量的 等物质,以废液为原料制备
等物质,以废液为原料制备 ,实现资源回收再利用,流程如图所示。
,实现资源回收再利用,流程如图所示。
(1)粗
 溶液的制备
溶液的制备①上述流程中能加快反应速率的措施有
②加入铁屑后,印刷电路板废液中发生的离子反应有
(2)
 溶液的精制
溶液的精制ⅰ.经检验,粗
 溶液含有
溶液含有
ⅱ.向粗
 溶液滴加3%的
溶液滴加3%的 溶液,当溶液中
溶液,当溶液中 完全氧化后,加
完全氧化后,加 粉末调节溶液的
粉末调节溶液的 。
。ⅲ.将溶液加热至沸,趁热减压过滤,得到精制
 溶液。
溶液。①用离子方程式说明加入
 溶液的作用
溶液的作用②已知25℃时,
 ,
,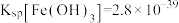 。调节溶液
。调节溶液 ,此时
,此时
 ,
, 已沉淀完全。
已沉淀完全。③
 时判断
时判断 尚未开始沉淀,根据是此时溶液中
尚未开始沉淀,根据是此时溶液中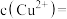
 ,与饱和溶液中
,与饱和溶液中 的物质的量浓度相比
的物质的量浓度相比 饱和溶液中
饱和溶液中 的物质的量浓度为1.41 mol⋅L
的物质的量浓度为1.41 mol⋅L )
)
您最近一年使用:0次
7 . 下列有关水溶液中的平衡相关的问题,请填空。
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式_______
(2)保存FeCl3溶液时需要稍微多加点盐酸,原因是_______ (用离子方程式说明)
(3)NaClO溶液显碱性的原因是_______ (用离子方程式说明)
常温时pH=10的NaClO溶液中c(Na+)-c(ClO-)=_______ (列出数值计算表达式)mol·L-1。
(4)25℃时,三种弱酸的电离平衡常数如表所示:
①少量CO2通入NaClO溶液中反应的离子方程式_______
②在某CH3COOH和CH3COONa的混合液中,当 =
= 时,溶液的pH=
时,溶液的pH= _______
③下列离子①CO ②HCO
②HCO ③ClO-④CH3COO-结合质子能力由强到弱的顺序为
③ClO-④CH3COO-结合质子能力由强到弱的顺序为_______
(5)已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.取一定量含有I-、Cl-的溶液向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中 为
为_______ (保留有效数字2位)
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式
(2)保存FeCl3溶液时需要稍微多加点盐酸,原因是
(3)NaClO溶液显碱性的原因是
常温时pH=10的NaClO溶液中c(Na+)-c(ClO-)=
(4)25℃时,三种弱酸的电离平衡常数如表所示:
| 分子式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
②在某CH3COOH和CH3COONa的混合液中,当
 =
= 时,溶液的pH=
时,溶液的pH= ③下列离子①CO
 ②HCO
②HCO ③ClO-④CH3COO-结合质子能力由强到弱的顺序为
③ClO-④CH3COO-结合质子能力由强到弱的顺序为(5)已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.取一定量含有I-、Cl-的溶液向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中
 为
为
您最近一年使用:0次
2022-12-11更新
|
210次组卷
|
2卷引用:湖南省长沙市德成学校2023-2024学年高二上学期1月期末化学试题
名校
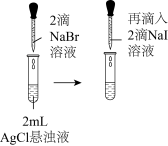
8 . 下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明 沉淀可以转化为 沉淀可以转化为 沉淀 沉淀 | 向 溶液中先加入3滴 溶液中先加入3滴 溶液,再加入3滴 溶液,再加入3滴 溶液 溶液 |
| B | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
| C | 测定未知浓度的NaOH溶液 | 用甲基橙作指示剂,标准盐酸溶液滴定NaOH溶液时,当溶液颜色由黄色变为橙色,且半分钟内不视色即为滴定终点 |
| D | 验证可溶性MR为强酸强碱盐 | 25℃,测得可溶性正盐MR的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-06更新
|
263次组卷
|
4卷引用:湖南省岳阳市汨罗市第一中学等两校2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
9 . 25℃时,向10mL 0.05 的
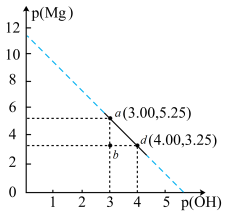
的 溶液中通入氨气,测得溶液中的p(OH)与p(Mg)之间的变化曲线如图所示。已知:
溶液中通入氨气,测得溶液中的p(OH)与p(Mg)之间的变化曲线如图所示。已知: ,
, ,
,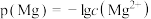 ,忽略反应过程中溶液体积的变化。下列说法正确的是
,忽略反应过程中溶液体积的变化。下列说法正确的是
 的
的 溶液中通入氨气,测得溶液中的p(OH)与p(Mg)之间的变化曲线如图所示。已知:
溶液中通入氨气,测得溶液中的p(OH)与p(Mg)之间的变化曲线如图所示。已知: ,
, ,
,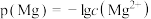 ,忽略反应过程中溶液体积的变化。下列说法正确的是
,忽略反应过程中溶液体积的变化。下列说法正确的是
A.a点溶液满足: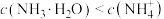 | B.b点溶液中会产生 沉淀 沉淀 |
C.d点溶液满足: | D.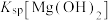 的数量级是 的数量级是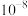 |
您最近一年使用:0次
2022-11-30更新
|
229次组卷
|
5卷引用:湖南省郴州市2023-2024学年高二上学期期末教学质量监测化学试题
名校
解题方法
10 . 磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如图:
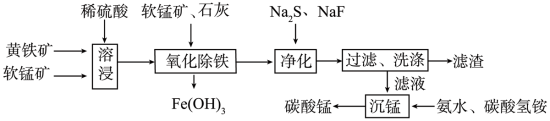
已知:几种金属离子沉淀的pH如表。
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有____ 。
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,还含有少量Fe2+、Cu2+、Ca2+。在加入石灰调节溶液的pH前,先加入适量的软锰矿,其发生反应的离子方程式为____ ,加入石灰调节溶液pH的范围为____ 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是CaF2和____ (填化学式)。若测得滤液中c(F-)为0.001mol•L-1,则净化工序中Ca2+是否沉淀完全?____ (填“是”或“否”)[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是____ 。
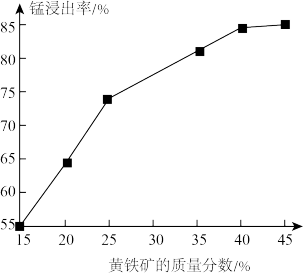
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在____ %左右。

已知:几种金属离子沉淀的pH如表。
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10.4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有
| A.搅拌 | B.适当升高温度 | C.研磨矿石 | D.加入足量的水 |
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是CaF2和
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在

您最近一年使用:0次
2022-11-12更新
|
291次组卷
|
2卷引用:湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题



