1 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 | 原溶液中有 ,无 ,无 |
| B | 向浓度均为 的 的 、 、 混合溶液中滴加少量 混合溶液中滴加少量 溶液,有黄色沉淀生成 溶液,有黄色沉淀生成 | 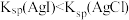 |
| C | 用注射器吸入 由 由 和 和 组成的混合气体,向外拉动注射器活塞至气体体积为原来的2倍,气体颜色变浅 组成的混合气体,向外拉动注射器活塞至气体体积为原来的2倍,气体颜色变浅 | 反应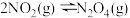 的平衡正向移动 的平衡正向移动 |
| D | 用 试纸测得: 试纸测得: 溶液的 溶液的 约为9, 约为9, 溶液的 溶液的 约为8 约为8 |  电离出 电离出 的能力比 的能力比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成不利影响,因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂成为热点。以下是以含钴废渣(主要成分 、
、 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程:
的一种工艺流程:
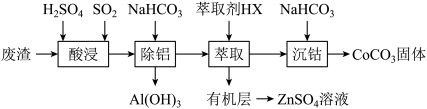
已知: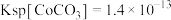 ,
,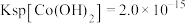
回答下列问题:
(1)为了加快“酸浸”速率,可以采取的操作有_______ 。(至少答两条)
(2)酸浸时通入 的主要作用是
的主要作用是_______ 。
(3)“除铝”步骤中,铝离子发生的离子反应方程式_______ 。
(4)“沉钴”的离子方程式是_______ 。“沉钴”步骤选择 ,而不选择
,而不选择 是为了避免有
是为了避免有 的生成,向溶液加入
的生成,向溶液加入 溶液,当溶液的
溶液,当溶液的 达到8时,就会同时有
达到8时,就会同时有 生成,计算当溶液的
生成,计算当溶液的 为8时,溶液中的
为8时,溶液中的 浓度=
浓度=_______  。
。
(5) 与纯碱反应可以制备重要的电极材料钴酸锂(
与纯碱反应可以制备重要的电极材料钴酸锂( )。一种充电电池的装置如下图所示,充放电过程中,存在
)。一种充电电池的装置如下图所示,充放电过程中,存在 与
与 之间的转化,放电过程中
之间的转化,放电过程中 从A电极向B电极迁移,写出该电池放电时的正极反应:
从A电极向B电极迁移,写出该电池放电时的正极反应:_______ ,若用该电池进行电解食盐水,当通过隔膜的离子数目为 时,电解池阴极收集到的气体体积在标准状况下为
时,电解池阴极收集到的气体体积在标准状况下为_______ L。

 、
、 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程:
的一种工艺流程:
已知:
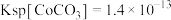 ,
,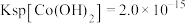
回答下列问题:
(1)为了加快“酸浸”速率,可以采取的操作有
(2)酸浸时通入
 的主要作用是
的主要作用是(3)“除铝”步骤中,铝离子发生的离子反应方程式
(4)“沉钴”的离子方程式是
 ,而不选择
,而不选择 是为了避免有
是为了避免有 的生成,向溶液加入
的生成,向溶液加入 溶液,当溶液的
溶液,当溶液的 达到8时,就会同时有
达到8时,就会同时有 生成,计算当溶液的
生成,计算当溶液的 为8时,溶液中的
为8时,溶液中的 浓度=
浓度= 。
。(5)
 与纯碱反应可以制备重要的电极材料钴酸锂(
与纯碱反应可以制备重要的电极材料钴酸锂( )。一种充电电池的装置如下图所示,充放电过程中,存在
)。一种充电电池的装置如下图所示,充放电过程中,存在 与
与 之间的转化,放电过程中
之间的转化,放电过程中 从A电极向B电极迁移,写出该电池放电时的正极反应:
从A电极向B电极迁移,写出该电池放电时的正极反应: 时,电解池阴极收集到的气体体积在标准状况下为
时,电解池阴极收集到的气体体积在标准状况下为
您最近一年使用:0次
2023-02-11更新
|
193次组卷
|
2卷引用:湖南省长沙市浏阳市2022-2023学年高二上学期期末考试化学试题
解题方法
3 . 下列有关难溶电解质的溶解平衡的说法中正确的是
| A.向AgCl悬浊液中加水,平衡右移,c(Ag+)和c(Cl-)均增大 |
B.Ca(OH)2悬浊液存在平衡: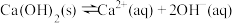 ,升温,溶液碱性增强 ,升温,溶液碱性增强 |
| C.向盛有2 mL0.1 mol/LAgNO3溶液的试管中滴加几滴0.1 mol/LNaCl溶液,再向其中滴加0.001 mol/LNaI溶液,先观察到白色沉淀,后又产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) |
D.将0.001 mol/LAgNO3溶液滴入含有同浓度KCl和K2CrO4的混合溶液中,先产生AgCl沉淀[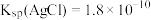 , , ] ] |
您最近一年使用:0次
名校
解题方法
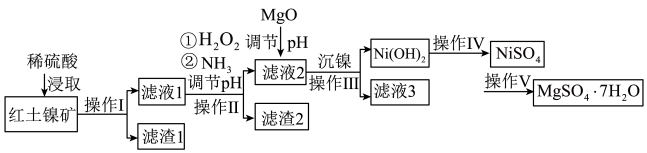
4 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;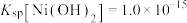 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是______ ,“滤渣1”的成分______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是______ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______  。
。
(6)操作V是______ 、过滤、洗涤。
(7) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为______ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;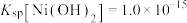 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全( | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(6)操作V是
(7)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-02-10更新
|
1039次组卷
|
7卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
5 . 在化学分析中,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。已知25℃时,
反应生成砖红色沉淀指示滴定终点。已知25℃时, ,
, ,当溶液中的
,当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中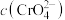 约为
约为
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。已知25℃时,
反应生成砖红色沉淀指示滴定终点。已知25℃时, ,
, ,当溶液中的
,当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中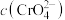 约为
约为A. | B.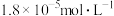 | C.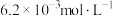 | D. |
您最近一年使用:0次
2023-02-10更新
|
657次组卷
|
13卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题湖南省邵东市第一中学2022-2023学年高二上学期期末考试化学试题 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题浙江省湖州市2021-2022学年高二上学期期末考试化学试题浙江省湖州市2021-2022学年高二上学期期末调研测试化学试题(已下线)专题08 沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)吉林省长春市第二实验中学2021-2022学年高二下学期开学考试化学试题云南省昆明市安宁中学2022-2023学年高二下学期第一次检测化学试题四川省雅安中学2022-2023学年高二下学期期中考试化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期11月期中化学试题黑龙江省哈尔滨市第九中学2023-2024学年高二下学期开学考试化学试卷江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题
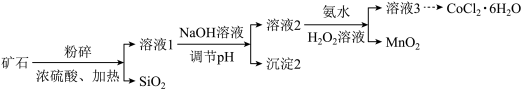
6 . 氯化钴 在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。某钴矿石的主要成分包括
在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。某钴矿石的主要成分包括 和
和 。由该矿石制
。由该矿石制 固体的方法如图(部分分离操作省略):
固体的方法如图(部分分离操作省略):
资料: 生成
生成 ,开始沉淀时
,开始沉淀时 ,完全沉淀时
,完全沉淀时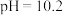
(1)上述矿石溶解过程中,能够加快化学反应速率的措施有_______ (写出一条即可)。
(2) 溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括
溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括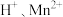 和
和_______ 。
(3)已知 时溶液中
时溶液中 完全沉淀。沉淀2是
完全沉淀。沉淀2是_______ 。
(4)溶液2中含有 和
和 。
。
ⅰ.已知: 时
时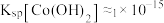 ,当
,当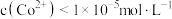 时可认为
时可认为 完全沉淀。若向溶液2中加入碱溶液,常温下,当
完全沉淀。若向溶液2中加入碱溶液,常温下,当
_______ 时 完全沉淀。由此可知,通过调节
完全沉淀。由此可知,通过调节 无法将
无法将 和
和 完全分离。
完全分离。
ⅱ.溶液2中加入氨水和 溶液的目的是
溶液的目的是_______ 。
 在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。某钴矿石的主要成分包括
在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。某钴矿石的主要成分包括 和
和 。由该矿石制
。由该矿石制 固体的方法如图(部分分离操作省略):
固体的方法如图(部分分离操作省略):
资料:
 生成
生成 ,开始沉淀时
,开始沉淀时 ,完全沉淀时
,完全沉淀时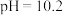
(1)上述矿石溶解过程中,能够加快化学反应速率的措施有
(2)
 溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括
溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括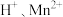 和
和(3)已知
 时溶液中
时溶液中 完全沉淀。沉淀2是
完全沉淀。沉淀2是(4)溶液2中含有
 和
和 。
。ⅰ.已知:
 时
时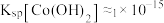 ,当
,当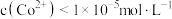 时可认为
时可认为 完全沉淀。若向溶液2中加入碱溶液,常温下,当
完全沉淀。若向溶液2中加入碱溶液,常温下,当
 完全沉淀。由此可知,通过调节
完全沉淀。由此可知,通过调节 无法将
无法将 和
和 完全分离。
完全分离。ⅱ.溶液2中加入氨水和
 溶液的目的是
溶液的目的是
您最近一年使用:0次
7 .  的溶解度随温度升高而增大,
的溶解度随温度升高而增大, 时,
时, 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
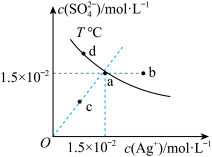
 的溶解度随温度升高而增大,
的溶解度随温度升高而增大, 时,
时, 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.根据曲线利用a点数据计算可知, 下, 下, |
B.a点与d点 数值不相等 数值不相等 |
| C.a点溶液降低温度,则a点可沿虚线移动到c点 |
D.向a点的悬浊液中加入 固体,溶液组成可能会由a向d方向移动 固体,溶液组成可能会由a向d方向移动 |
您最近一年使用:0次
名校
解题方法
8 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
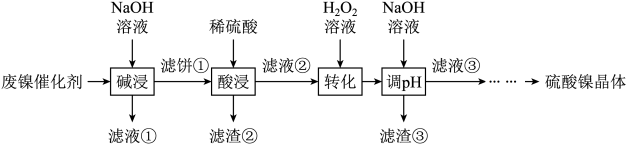
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)Ni在元素周期表中的位置___________ 。
(2)“碱浸”中NaOH的两个作用,一个是溶解铝及其氧化物,另一个是___________ 。为回收金属,用稀硫酸将“滤液①”中的铝元素恰好完全转化为沉淀的pH为___________ 。(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全; :
: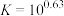 ,
,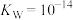 ,
, )
)
(3)“转化”中发生的离子反应为___________ ,可替代 的物质是
的物质是___________ 。
(4)利用上述表格数据,如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式___________ 。
(6)由滤液③得到硫酸镍晶体的一系列操作为___________ 。
 ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH沉淀完全时(  )的pH )的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
回答下列问题:
(1)Ni在元素周期表中的位置
(2)“碱浸”中NaOH的两个作用,一个是溶解铝及其氧化物,另一个是
 为沉淀完全;
为沉淀完全; :
: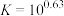 ,
,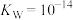 ,
, )
)(3)“转化”中发生的离子反应为
 的物质是
的物质是(4)利用上述表格数据,如果“转化”后的溶液中
 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)由滤液③得到硫酸镍晶体的一系列操作为
您最近一年使用:0次
名校
解题方法
9 . 稀土是元素周期表第Ⅲ族副族元素钪(SC)、钇(Y)和镧系元素共17种化学元素的合称,是隐形战机、超导、核工业等高精尖领域必备的原料,但是稀土的开采和加工对环境破坏比较大。从某种矿物(含铁、铝等元素)中提取稀土(用R表示)的工艺如图:
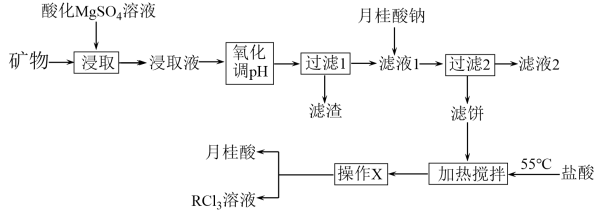
已知:①月桂酸(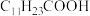 )熔点为44℃,难溶于水;
)熔点为44℃,难溶于水;
②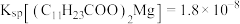 ;
;
③ 开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
(1)“过滤1”前,用NaOH溶液调pH,控制pH的范围为_______ ,得到的滤渣主要成分为_______ 。
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中 浓度为0.2mol/L。为尽可能多地提取
浓度为0.2mol/L。为尽可能多地提取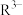 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中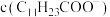 低于
低于_______  (保留两位有效数字)。
(保留两位有效数字)。
(3)“加热搅拌”控制在55℃左右,其原因是_______ 。
(4)稀土中钪元素的单质具有较高熔点且密度和铝接近,可制备高熔点轻质合金,此种合金可用作_______ (任答出一种用途即可)。
(5)某甲醇/ 燃料电池,电解质是掺杂
燃料电池,电解质是掺杂 的
的 晶体,它在熔融状态下能传导
晶体,它在熔融状态下能传导 ,写出该电池负极的电极反应式
,写出该电池负极的电极反应式_______ 。

已知:①月桂酸(
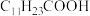 )熔点为44℃,难溶于水;
)熔点为44℃,难溶于水;②
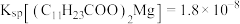 ;
;③
 开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。| 离子 |  |  |  |  |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中
 浓度为0.2mol/L。为尽可能多地提取
浓度为0.2mol/L。为尽可能多地提取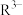 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中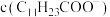 低于
低于 (保留两位有效数字)。
(保留两位有效数字)。(3)“加热搅拌”控制在55℃左右,其原因是
(4)稀土中钪元素的单质具有较高熔点且密度和铝接近,可制备高熔点轻质合金,此种合金可用作
(5)某甲醇/
 燃料电池,电解质是掺杂
燃料电池,电解质是掺杂 的
的 晶体,它在熔融状态下能传导
晶体,它在熔融状态下能传导 ,写出该电池负极的电极反应式
,写出该电池负极的电极反应式
您最近一年使用:0次
2023-02-09更新
|
220次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
10 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。请回答下列有关平衡的问题。
Ⅰ.在一定温度下,向一个容积不变(1L)的密闭容器中,加入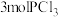 和
和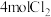 使之发生反应
使之发生反应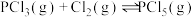 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答:
(1)已知:可逆反应的平衡常数可以用平衡分压代替平衡浓度(称为分压平衡常数,用 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
_______ (用含 的代数式表示)。
的代数式表示)。
(2)保持同一反应温度和体积,若将起始物改为amolPCl3,bmolCl2,cmol 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为_______ 。
Ⅱ.某三元羧酸在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向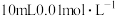 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
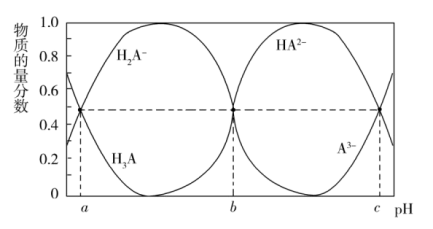
(3)常温时, 的
的 溶液的pH约为
溶液的pH约为_______ 。(已知 )
)
(4)常温时,反应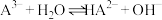 的平衡常数为K=
的平衡常数为K=_______ (用含a或b或c的代数式表示)
(5)当滴入30mLNaOH溶液时,下列溶液中微粒浓度关系正确的是_______
Ⅲ.含有 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含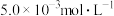 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
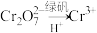 、
、
(6)该废水加硫酸酸化后,再加入绿矾( ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(7)若处理后的废水中残留的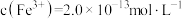 ,则残留的
,则残留的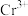 的浓度为
的浓度为_______ mol/L。(已知: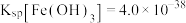 ,
,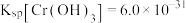 )。
)。
Ⅰ.在一定温度下,向一个容积不变(1L)的密闭容器中,加入
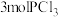 和
和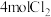 使之发生反应
使之发生反应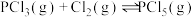 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答:(1)已知:可逆反应的平衡常数可以用平衡分压代替平衡浓度(称为分压平衡常数,用
 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
 的代数式表示)。
的代数式表示)。(2)保持同一反应温度和体积,若将起始物改为amolPCl3,bmolCl2,cmol
 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为Ⅱ.某三元羧酸在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向
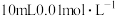 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
(3)常温时,
 的
的 溶液的pH约为
溶液的pH约为 )
)(4)常温时,反应
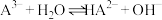 的平衡常数为K=
的平衡常数为K=(5)当滴入30mLNaOH溶液时,下列溶液中微粒浓度关系正确的是_______
A.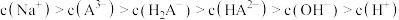 |
B.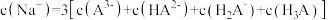 |
C.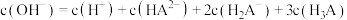 |
D.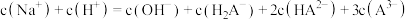 |
Ⅲ.含有
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含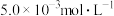 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: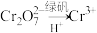 、
、
(6)该废水加硫酸酸化后,再加入绿矾(
 ),发生反应的离子方程式为
),发生反应的离子方程式为(7)若处理后的废水中残留的
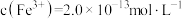 ,则残留的
,则残留的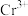 的浓度为
的浓度为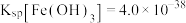 ,
,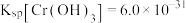 )。
)。
您最近一年使用:0次
2023-02-09更新
|
440次组卷
|
3卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题




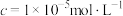 )时的pH
)时的pH

