1 . 常温下,几种物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净的CuCl2溶液,宜加入_______ 调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_______ 。
(2)过滤后,将所得滤液经过_______ 、_______ 操作,可得到CuCl2·2H2O晶体。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①可选用_______ 作指示剂,滴定终点的现象是_______ 。
②CuCl2溶液与KI反应的离子方程式为_______ 。
③该试样中CuCl2·2H2O的质量百分数为_______ 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净的CuCl2溶液,宜加入
(2)过滤后,将所得滤液经过
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O
 =S4O
=S4O +2I-)。
+2I-)。①可选用
②CuCl2溶液与KI反应的离子方程式为
③该试样中CuCl2·2H2O的质量百分数为
您最近一年使用:0次
2022-11-03更新
|
166次组卷
|
3卷引用:湖南省衡阳市第八中学2022-2023学年高二上学期期末考试化学试题
名校
2 . 25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是


A.a点溶液满足:c(NH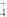 )>c(NH3·H2O)>c(Mg2+)>c(OH-) )>c(NH3·H2O)>c(Mg2+)>c(OH-) |
| B.b点溶液中无Mg(OH)2沉淀产生 |
C.c点溶液满足:2c(Mg2+)+c( )>c(Cl-) )>c(Cl-) |
| D.Ksp[Mg(OH)2]的数量级是10-12 |
您最近一年使用:0次
2022-10-27更新
|
427次组卷
|
3卷引用:湖南省衡阳市第八中学2022-2023学年高二上学期期末考试化学试题
解题方法
3 . 磷化镉(Cd3P2)常用作杀虫剂。一种以镉铁矿(主要成分为CdO2,Fe2O3、FeO,还有少量的Al2O3和SiO2)为原料制备Cd3P2的工艺流程如图:
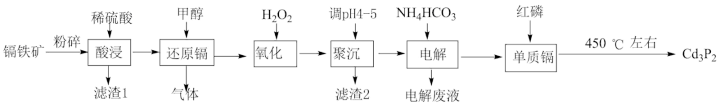
已知:25℃时,0.1mol·L-1相关金属离子形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)镉铁矿“粉碎”的目的是_______ 。
(2)“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为_______ 。
(3)加入H2O2溶液的目的是_______ 。
(4)“滤渣2”所含物质的化学式是_______ 。
(5)工业生产中,有时采用阳离子交换树脂法来测定“聚沉”后溶液中Cd2+的含量,其原理是:Cd2++2NaR=2Na++CdR2,其中NaR为阳离子交换树脂。常温下,将“聚沉”后的溶液经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.0048mol·L-1,若该条件下Cd(OH)2的Ksp=2.4×10-15,此时“聚沉”后溶液的pH=_______ 。
(6)电解制取Cd,Cd在_______ (填“阳极”或“阴极”)析出,阳极反应式为_______ 。

已知:25℃时,0.1mol·L-1相关金属离子形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Cd2+ |
| 开始沉淀的pH | 1.7 | 6.3 | 3.1 | >7.0 |
| 沉淀完全的pH | 3.3 | 8.3 | 4.7 |
回答下列问题:
(1)镉铁矿“粉碎”的目的是
(2)“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为
(3)加入H2O2溶液的目的是
(4)“滤渣2”所含物质的化学式是
(5)工业生产中,有时采用阳离子交换树脂法来测定“聚沉”后溶液中Cd2+的含量,其原理是:Cd2++2NaR=2Na++CdR2,其中NaR为阳离子交换树脂。常温下,将“聚沉”后的溶液经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.0048mol·L-1,若该条件下Cd(OH)2的Ksp=2.4×10-15,此时“聚沉”后溶液的pH=
(6)电解制取Cd,Cd在
您最近一年使用:0次
4 . 常温下,已知KSP(ZnS)=1.6×10-24,KSP(CuS)=1.3×10-36。CuS和ZnS饱和溶液中阳离子(R2+ )浓度与阴离子( S2- )浓度的负对数关系如图所示,下列说法不正确的是


| A.曲线A表示的是CuS,曲线B表示的是ZnS |
| B.p点表示CuS或ZnS的不饱和溶液 |
| C.向CuS饱和溶液中加入CuCl2固体,CuS的溶解平衡逆向移动,KSP(CuS)减小 |
| D.向曲线A表示的溶液中加入Na2S溶液,不可能实现n点到m点的转化 |
您最近一年使用:0次
2022-09-21更新
|
926次组卷
|
17卷引用:湖南省衡阳市衡阳县第五中学2022-2023学年高二上学期期末考试化学试题
湖南省衡阳市衡阳县第五中学2022-2023学年高二上学期期末考试化学试题广西钦州市2021-2022学年高二下学期期末考试化学试题广东省广州市番禺区2021-2022学年高二上学期期末考试化学试题(已下线)高二上期末考化学190湖北省恩施咸丰春晖学校2021-2022学年高二上学期第一次月考化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)湖北省仙桃中学、天门中学(B班)2021-2022学年高二上学期期中考试化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)湖北省武汉市部分学校2021-2022学年高二上学期12月联考化学试题广东省佛山市第四中学2021-2022学年高二上学期11月第二阶段考试化学试题重庆市育才中学校2021-2022学年高二上学期高二第五次定时练习化学试题云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(A卷)河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题北京市清华大学附属中学2022-2023学年高二上学期12月月考化学试题浙江省杭州学军中学2022-2023学年高二上学期期中考试 化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
5 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
(1)某温度下,纯水中的c(H+)=1.5×10-7,则纯水中的
_______ mol/L,该温度时的水的离子积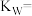
_______ 。保持温度不变,滴入稀盐酸使溶液中的 ,则溶液中的
,则溶液中的 为
为_______  。
。
(2)常温中,一定浓度的CH3COONa溶液的pH=8,已知CH3COOH的电离平衡常数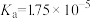 ,则该CH3COONa溶液中:
,则该CH3COONa溶液中: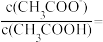
_______ 。
(3)甲酸钠(HCOONa)溶液呈碱性的原因是_______ (用离子方程式表示)。0.02mol/L的HCOONa溶液中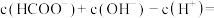
_______ mol/L。
(4)25℃,在0.10mol•L1硫酸铜溶液中加入氢氧化钠稀溶液充分反应,有蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=_______ molL1(Ksp[Cu(OH)2]=2.2×1020)。
(1)某温度下,纯水中的c(H+)=1.5×10-7,则纯水中的

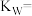
 ,则溶液中的
,则溶液中的 为
为 。
。(2)常温中,一定浓度的CH3COONa溶液的pH=8,已知CH3COOH的电离平衡常数
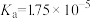 ,则该CH3COONa溶液中:
,则该CH3COONa溶液中: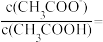
(3)甲酸钠(HCOONa)溶液呈碱性的原因是
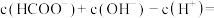
(4)25℃,在0.10mol•L1硫酸铜溶液中加入氢氧化钠稀溶液充分反应,有蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=
您最近一年使用:0次
2022-09-14更新
|
308次组卷
|
2卷引用:湖南省岳阳市华容县2021-2022学年高二上学期期末教学质量监测化学试题
6 . 下列实验事实不能用平衡移动原理解释的是
| A.利用TiCl4水解制备TiO2时,需加入大量水并加热 |
| B.将氯化铝溶液加热蒸干并灼烧,最终得到氧化铝固体 |
C.对2HI(g) H2(g)+I2(g),减小容器体积,气体颜色变深 H2(g)+I2(g),减小容器体积,气体颜色变深 |
| D.水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除 |
您最近一年使用:0次
7 . 工业上以软锰矿(主要成分 ,还含有少量的
,还含有少量的 、
、 、
、 等)为原料制取金属锰的工艺流程如图所示:
等)为原料制取金属锰的工艺流程如图所示:

(1)软锰矿“粉磨”的目的是_______ 。
(2)写出“浸出”操作中氧化还原反应的离子方程式_______ 。
(3)“除杂”反应中X可以是_______(填标号)。
(4)写出“沉锰”操作中发生反应的离子方程式_______ 。该操作包括过滤、洗涤等步骤,简述检验洗涤沉淀时是否洗干净的方法_______ 。
(5)“电解”操作中电极均为惰性电极,写出阴极的电极反应式_______ 。
(6)在废水处理中常用 将
将 转化
转化 除去,向含有
除去,向含有 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的
气体,调节溶液的 ,当
,当 时,
时, 开始沉淀,则a=
开始沉淀,则a=_______ 。
(已知:25℃时, 的电离常数
的电离常数 ,
,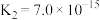 ;
; )
)
 ,还含有少量的
,还含有少量的 、
、 、
、 等)为原料制取金属锰的工艺流程如图所示:
等)为原料制取金属锰的工艺流程如图所示:
(1)软锰矿“粉磨”的目的是
(2)写出“浸出”操作中氧化还原反应的离子方程式
(3)“除杂”反应中X可以是_______(填标号)。
A. | B. | C. | D. |
(5)“电解”操作中电极均为惰性电极,写出阴极的电极反应式
(6)在废水处理中常用
 将
将 转化
转化 除去,向含有
除去,向含有 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的
气体,调节溶液的 ,当
,当 时,
时, 开始沉淀,则a=
开始沉淀,则a=(已知:25℃时,
 的电离常数
的电离常数 ,
,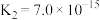 ;
; )
)
您最近一年使用:0次
名校
解题方法
8 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 向溶液X中滴加浓盐酸,将产生气体通入品红溶液,溶液褪色 | 证明溶液X中含有 或 或 |
| B | 室温下,向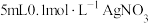 溶液中加入几滴 溶液中加入几滴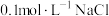 溶液出现白色沉淀,再滴加几滴 溶液出现白色沉淀,再滴加几滴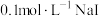 溶液,出现黄色沉淀 溶液,出现黄色沉淀 | 证明相同温度下: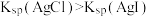 |
| C | 常温下,测得相同浓度溶液的 : : | 证明常温下的水解程度: |
| D | 将 溶液滴入酸性 溶液滴入酸性 溶液中,紫红色褪去 溶液中,紫红色褪去 | 证明 有还原性 有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-02更新
|
1369次组卷
|
4卷引用:湖南省郴州市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
9 . 高中化学《化学反应原理》模块从不同的视角对化学反应进行了探究、分析,以下观点中不正确 的是
| A.难溶电解质在水中达到溶解平衡时,再加入难溶电解质,溶液中各离子浓度不变 |
B.将 加入水中并加热使其转化为 加入水中并加热使其转化为 |
C.乙烯聚合为聚乙烯的反应是熵减的过程,却能够自发进行,可知该反应的 |
D. 溶液显碱性的原因: 溶液显碱性的原因: |
您最近一年使用:0次
2022-09-02更新
|
587次组卷
|
5卷引用:湖南省郴州市2021-2022学年高二上学期期末考试化学试题
名校
10 . 某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是


| A.步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热 |
B.步骤①中的反应式:3Fe(OH)3+S2O +2OH-=3Fe(OH)2+2SO +2OH-=3Fe(OH)2+2SO +4H2O +4H2O |
| C.步骤①中保险粉是作氧化剂 |
| D.从步骤②中可知OH-和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物 |
您最近一年使用:0次



