名校
1 . 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 探究H+浓度对 、 、 相互转化的影响 相互转化的影响 | 向K2CrO4溶液中加入足量稀硫酸,观察溶液颜色变化 |
| B | 比较HNO2与CH3COOH电离出H+的能力强弱 | 同温下,分别测定CH3COONa溶液和NaNO2溶液的pH |
| C | 证明AgCl的溶解度大于Ag2S | 向1mL 0.5mol/L的AgNO3溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴Na2S溶液产生黑色沉淀 |
| D | 探究水的电离过程是吸热的 | 分别用pH计测定常温和沸水的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-05更新
|
165次组卷
|
2卷引用:湖南省郴州市2023-2024学年高二上学期期末教学质量监测化学试题
2 . 已知:常温下,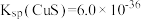 ,
, ,
,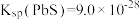 。在自然界中,闪锌矿(ZnS)和方铝矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是
。在自然界中,闪锌矿(ZnS)和方铝矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是
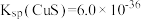 ,
, ,
,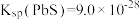 。在自然界中,闪锌矿(ZnS)和方铝矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是
。在自然界中,闪锌矿(ZnS)和方铝矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是A.饱和PbS溶液中,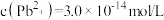 |
| B.相同温度下,在水中的溶解度:ZnS>CuS>PbS |
C.向PbS固体中滴加一定量 溶液,反应达到平衡时,溶液中 溶液,反应达到平衡时,溶液中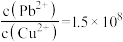 |
D.向含浓度相同的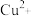 、 、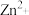 、 、 的混合溶液中逐滴加入 的混合溶液中逐滴加入 稀溶液, 稀溶液,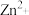 先沉淀 先沉淀 |
您最近一年使用:0次
解题方法
3 . 下列离子方程式符合题意的是
A.往 溶液中滴入醋酸溶液: 溶液中滴入醋酸溶液: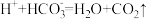 |
B.加入ZnS固体除去废水中的 |
C.将NaClO碱性溶液与含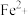 的溶液混合: 的溶液混合: |
D.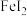 溶液中通入少量 溶液中通入少量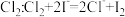 |
您最近一年使用:0次
4 . 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
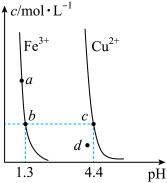

| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.c、d两点代表的溶液中c(H+)与c(OH-)乘积不相等 |
| C.加适量NH4Cl固体可使溶液由a点变到b点 |
| D.在b、c两点代表的溶液中Fe(OH)3、Cu(OH)2均达到饱和 |
您最近一年使用:0次
5 . 回答下列问题
(1)常温下,浓度均为0.1 的五种钠盐溶液的
的五种钠盐溶液的 如下表所示:
如下表所示:
①上述几种钠盐的阴离子,结合氢离子能力最强的是____________ (填离子符号)。
②根据表中数据判断,将浓度均为0.01 的下列四种酸的溶液分别稀释至原体积的100倍,
的下列四种酸的溶液分别稀释至原体积的100倍, 变化最大的是
变化最大的是____________ 。
a. B.
B. C.
C. D.
D.
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
已知:几种离子开始沉淀时溶液的 如下表所示:
如下表所示:
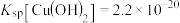 ,
, 。
。
①用150 1
1
 溶液吸收标准状况下的2.24L
溶液吸收标准状况下的2.24L ,所得溶液中各离子的浓度由大到小的顺序为
,所得溶液中各离子的浓度由大到小的顺序为____________ 。
②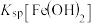
___________ (填“>”“=”或“<”)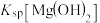 。
。
③当向含有相同浓度的 、
、 、
、 的溶液中滴加
的溶液中滴加 溶液时,
溶液时,_________ (填离子符号)先沉淀。
④要使0.2
 溶液中
溶液中 沉淀完全,则应向溶液中加入
沉淀完全,则应向溶液中加入 溶液使溶液的
溶液使溶液的 不低于
不低于_________ (保留1位小数)。
(1)常温下,浓度均为0.1
 的五种钠盐溶液的
的五种钠盐溶液的 如下表所示:
如下表所示:溶质 |
|
|
|
|
|
| 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述几种钠盐的阴离子,结合氢离子能力最强的是
②根据表中数据判断,将浓度均为0.01
 的下列四种酸的溶液分别稀释至原体积的100倍,
的下列四种酸的溶液分别稀释至原体积的100倍, 变化最大的是
变化最大的是a.
 B.
B. C.
C. D.
D.
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
已知:几种离子开始沉淀时溶液的
 如下表所示:
如下表所示:离子 |
|
|
|
| 7.6 | 5.2 | 10.1 |
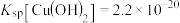 ,
, 。
。①用150
 1
1
 溶液吸收标准状况下的2.24L
溶液吸收标准状况下的2.24L ,所得溶液中各离子的浓度由大到小的顺序为
,所得溶液中各离子的浓度由大到小的顺序为②
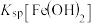
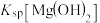 。
。③当向含有相同浓度的
 、
、 、
、 的溶液中滴加
的溶液中滴加 溶液时,
溶液时,④要使0.2

 溶液中
溶液中 沉淀完全,则应向溶液中加入
沉淀完全,则应向溶液中加入 溶液使溶液的
溶液使溶液的 不低于
不低于
您最近一年使用:0次
2023-03-01更新
|
100次组卷
|
2卷引用:湖南省邵阳市新邵县第八中学2022-2023学年高二上学期期末质量检测化学试题
6 . 钼(Mo)是一种难熔稀有金属,钼及其合金在冶金、环保和航天等方面有着广泛的应用,其化合物钼酸钠晶体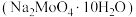 可制造金属缓蚀剂。下图为钼精矿(主要成分
可制造金属缓蚀剂。下图为钼精矿(主要成分 ,含有少量不反应杂质)制备钼酸钠晶体的工艺流程。
,含有少量不反应杂质)制备钼酸钠晶体的工艺流程。
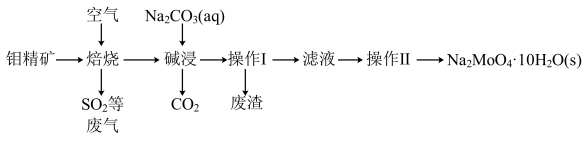
(1)“操作Ⅰ”的名称为_______ 。
(2)“焙烧”过程中钼的产物为 ,其反应的化学方程式为
,其反应的化学方程式为_______ 。
(3)提高“碱浸”浸出率的措施有_______ 。(任写一条)
(4)已知钼酸钠的溶解度曲线如图所示,“操作Ⅱ”的系列名称为_______ 、过滤、洗涤、烘干。

(5)在实际生产中会有少量 生成,用固体
生成,用固体 除去。在除
除去。在除 前测定碱浸液中
前测定碱浸液中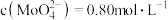 ,
,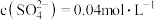 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率为
的去除率为_______ 。[已知 ,
,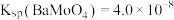 ,溶液体积变化可忽略不计]。
,溶液体积变化可忽略不计]。
(6)电氧化法提纯钼的原理:将辉钼矿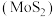 放入装有食盐水的电解槽中,用惰性电极电解时,
放入装有食盐水的电解槽中,用惰性电极电解时, 被氧化为
被氧化为 和
和 。
。
①辉钼矿应放入电解槽的_______ (填“阴极区”或“阳极区”);
②阴极的电极反应式为_______ 。
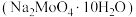 可制造金属缓蚀剂。下图为钼精矿(主要成分
可制造金属缓蚀剂。下图为钼精矿(主要成分 ,含有少量不反应杂质)制备钼酸钠晶体的工艺流程。
,含有少量不反应杂质)制备钼酸钠晶体的工艺流程。
(1)“操作Ⅰ”的名称为
(2)“焙烧”过程中钼的产物为
 ,其反应的化学方程式为
,其反应的化学方程式为(3)提高“碱浸”浸出率的措施有
(4)已知钼酸钠的溶解度曲线如图所示,“操作Ⅱ”的系列名称为

(5)在实际生产中会有少量
 生成,用固体
生成,用固体 除去。在除
除去。在除 前测定碱浸液中
前测定碱浸液中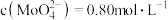 ,
,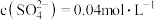 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率为
的去除率为 ,
,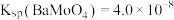 ,溶液体积变化可忽略不计]。
,溶液体积变化可忽略不计]。(6)电氧化法提纯钼的原理:将辉钼矿
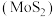 放入装有食盐水的电解槽中,用惰性电极电解时,
放入装有食盐水的电解槽中,用惰性电极电解时, 被氧化为
被氧化为 和
和 。
。①辉钼矿应放入电解槽的
②阴极的电极反应式为
您最近一年使用:0次
7 . 某元素M的氢氧化物 在水中的溶解反应为:
在水中的溶解反应为: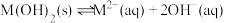 、
、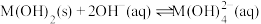 ,25℃时,
,25℃时,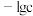 (c为
(c为 或
或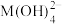 浓度的值)与
浓度的值)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 在水中的溶解反应为:
在水中的溶解反应为: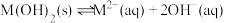 、
、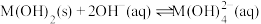 ,25℃时,
,25℃时,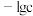 (c为
(c为 或
或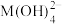 浓度的值)与
浓度的值)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.曲线②代表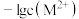 与 与 的关系 的关系 |
B. 的 的 约为 约为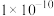 |
C.向 的溶液中加入 的溶液中加入 溶液至 溶液至 ,体系中元素M主要以 ,体系中元素M主要以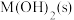 存在 存在 |
D.向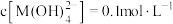 的溶液中加入等体积 的溶液中加入等体积 的 的 后,体系中元素M主要以 后,体系中元素M主要以 存在 存在 |
您最近一年使用:0次
2023-02-19更新
|
330次组卷
|
2卷引用:湖南省永州市2022-2023学年高二上学期期末考试化学试题
解题方法
8 . 化学与生活、生产及科技密切相关,下列有关说法不正确的是
A. 可用作自来水的消毒杀菌 可用作自来水的消毒杀菌 |
| B.利用原子光谱上的特征谱线,可鉴定元素 |
| C.牙膏中添加氟化物,也能起到预防龋齿的作用 |
D.血浆中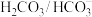 缓冲体系可稳定人体内体系的酸碱度 缓冲体系可稳定人体内体系的酸碱度 |
您最近一年使用:0次
9 . 请按要求回答下列问题:
(1)25℃时,三种弱酸的电离平衡常数如下表所示:
①25℃时, 溶液中
溶液中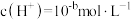 ,
, 的电离常数
的电离常数
_______ 。(用含a和b的代数式表示)。
②有下列四种离子:① ②
② ③
③ ④
④ ,结合质子能力由强到弱的顺序为
,结合质子能力由强到弱的顺序为_______ 。(用序号表示)。
③少量 通入NaClO溶液中反应的离子方程式
通入NaClO溶液中反应的离子方程式_______ 。
④某 和
和 的混合液中,当
的混合液中,当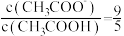 时,溶液的
时,溶液的
_______ 。
(2)常温时, 的NaClO溶液中
的NaClO溶液中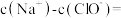
_______ (用数值表示) 。
。
(3)泡沫灭火器是将 溶液和
溶液和 溶液混合,有白色沉淀产生同时释放出
溶液混合,有白色沉淀产生同时释放出 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:_______ 。
(4)已知25℃时, ,
,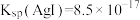 。取一定量含有
。取一定量含有 、
、 的溶液向其中滴加
的溶液向其中滴加 溶液,当AgCl和AgI同时沉淀时,溶液中
溶液,当AgCl和AgI同时沉淀时,溶液中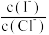 为
为_______ 。
(1)25℃时,三种弱酸的电离平衡常数如下表所示:
| 分子式 |  |  | HClO |
| 电离平衡常数 |  |  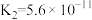 |  |
 溶液中
溶液中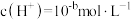 ,
, 的电离常数
的电离常数
②有下列四种离子:①
 ②
② ③
③ ④
④ ,结合质子能力由强到弱的顺序为
,结合质子能力由强到弱的顺序为③少量
 通入NaClO溶液中反应的离子方程式
通入NaClO溶液中反应的离子方程式④某
 和
和 的混合液中,当
的混合液中,当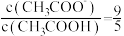 时,溶液的
时,溶液的
(2)常温时,
 的NaClO溶液中
的NaClO溶液中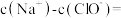
 。
。(3)泡沫灭火器是将
 溶液和
溶液和 溶液混合,有白色沉淀产生同时释放出
溶液混合,有白色沉淀产生同时释放出 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:(4)已知25℃时,
 ,
,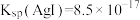 。取一定量含有
。取一定量含有 、
、 的溶液向其中滴加
的溶液向其中滴加 溶液,当AgCl和AgI同时沉淀时,溶液中
溶液,当AgCl和AgI同时沉淀时,溶液中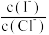 为
为
您最近一年使用:0次
2023-02-17更新
|
83次组卷
|
2卷引用:湖南省娄底市涟源市2023-2024学年高二上学期1月期末考试化学试题
10 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、 Mg2+、 Pb2+等 )制备高纯碳酸锶的工艺流程如下:
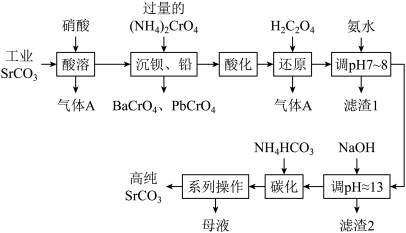
已知:I.Cr(OH)3为两性氢氧化物;
Ⅱ.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)基态Cr原子的价层电子排布为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (结合化学用语解释);“还原”时含铬微粒发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)已知:碳酸的电离常数Ka1=4.4×10-7、 Ka2= 4.7×10-11, 则碳化时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数 K =
SrCO3(s)+H2CO3(aq)的平衡常数 K =_______ (保留两位有效数字)。
(6)“系列操作”中,将结晶过滤后,不经洗涤,直接以200℃热风烘干,便可得高纯SrCO3,其原因是_______ 。

已知:I.Cr(OH)3为两性氢氧化物;
Ⅱ.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)基态Cr原子的价层电子排布为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)已知:碳酸的电离常数Ka1=4.4×10-7、 Ka2= 4.7×10-11, 则碳化时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数 K =
SrCO3(s)+H2CO3(aq)的平衡常数 K =(6)“系列操作”中,将结晶过滤后,不经洗涤,直接以200℃热风烘干,便可得高纯SrCO3,其原因是
您最近一年使用:0次
2023-02-16更新
|
187次组卷
|
3卷引用:湖南省岳阳市汨罗市第一中学等两校2022-2023学年高二上学期1月期末考试化学试题






