名校
1 . 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.100g质量分数为46%的乙醇溶液中,含O—H键的数目为7NA |
| B.0.1mol·L-1的CH3COONa溶液中,含CH3COO-的数目小于0.1NA |
| C.含0.2molH2SO4的浓硫酸与足量的镁反应,转移的电子数小于0.2NA |
| D.常温下,1LpH=11的Ba(OH)2溶液中,含OH-的数目为0.002NA |
您最近一年使用:0次
2022-03-28更新
|
2953次组卷
|
9卷引用:河南省新乡市2022届高三第二次模拟考试理科综合化学试题
河南省新乡市2022届高三第二次模拟考试理科综合化学试题(已下线)专题02化学计量与化学计算-2022年高考真题+模拟题汇编(全国卷)(已下线)专题02化学计量与化学计算-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题02化学计量与化学计算-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题03 破解“七陷阱”突破NA-备战2023年高考化学一轮复习考点微专题(已下线)2022年辽宁省高考真题变式题(1-10)(已下线)2022年辽宁高考真题化学试题变式题(选择题1-5)山西省阳泉市第一中学校2022-2023学年高二上学期11月期中考试化学试题2023届河南省南阳市六校高三下学期第一次联考化学试卷
解题方法
2 . 常温下,向 一定浓度的硫酸铜溶液中逐滴滴入
一定浓度的硫酸铜溶液中逐滴滴入 的氨水,首先析出浅蓝色的
的氨水,首先析出浅蓝色的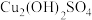 沉淀,氨水过量时此沉淀溶解,形成
沉淀,氨水过量时此沉淀溶解,形成 络离子(假定溶液混合后体积不变)。滴加过程中
络离子(假定溶液混合后体积不变)。滴加过程中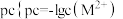 ,
, 为
为 或
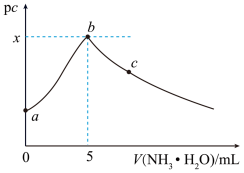
或 与氨水体积的关系如图所示。下列说法错误的是
与氨水体积的关系如图所示。下列说法错误的是
 一定浓度的硫酸铜溶液中逐滴滴入
一定浓度的硫酸铜溶液中逐滴滴入 的氨水,首先析出浅蓝色的
的氨水,首先析出浅蓝色的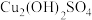 沉淀,氨水过量时此沉淀溶解,形成
沉淀,氨水过量时此沉淀溶解,形成 络离子(假定溶液混合后体积不变)。滴加过程中
络离子(假定溶液混合后体积不变)。滴加过程中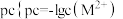 ,
, 为
为 或
或 与氨水体积的关系如图所示。下列说法错误的是
与氨水体积的关系如图所示。下列说法错误的是
A.硫酸铜溶液的浓度为 |
B.常温下, 点溶液中水的电离程度低于纯水的 点溶液中水的电离程度低于纯水的 |
C. 点溶液中存在 点溶液中存在 |
D.常温下,忽略 的影响,可得 的影响,可得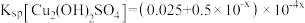 |
您最近一年使用:0次
解题方法
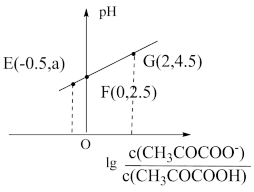
3 . 丙酮酸(CH3COCOOH)是一元弱酸。298K时,向20mL0.1mol·L-1丙酮酸溶液中滴加pH=13的NaOH溶液,溶液中lg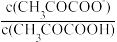 与pH的关系曲线如图所示。下列说法错误的是
与pH的关系曲线如图所示。下列说法错误的是
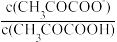 与pH的关系曲线如图所示。下列说法错误的是
与pH的关系曲线如图所示。下列说法错误的是
| A.E点溶液中,a=2 |
| B.298K时,CH3COCOOH的电离常数的数量级为10-3 |
| C.G点对应的NaOH溶液的体积为20mL |
| D.E、F、G三点对应的溶液中水的电离程度:E<F<G |
您最近一年使用:0次
2022-02-20更新
|
886次组卷
|
4卷引用:贵州省遵义市2021-2022学年高三下学期开学考试理科综合化学试题
名校
解题方法
4 . 常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是
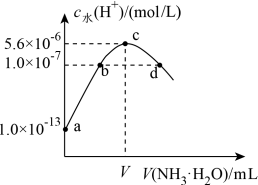

| A.V=40 |
| B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O) |
| C.NH3·H2O的电离常数K=10-4 |
D.d点所示溶液中:c(NH )=2c(SO )=2c(SO ) ) |
您最近一年使用:0次
2022-01-21更新
|
539次组卷
|
16卷引用:2016届山东省临沂市高三下学期教学质检一模化学试卷
2016届山东省临沂市高三下学期教学质检一模化学试卷2015-2016学年福建省厦门市海沧中学高二下学期期末化学试卷2016-2017学年辽宁省沈阳铁路中学高二上第一次月考化学试卷江西省景德镇市第一中学2016-2017学年高二(素质班)下学期期末考试化学试题【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题百所名校联考-水溶液中的离子平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——盐类水解中三大守恒的应用2020届高三化学选修4二轮专题练——混合溶液中微粒浓度大小的比较专题【精编23题】江西省南昌市南昌县莲塘第三中学2020-2021学年高二上学期第二次月考化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)第6讲 离子平衡坐标图像-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练新疆乌鲁木齐市第七十中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
5 . 常温下,将NaOH溶液滴加到某二元弱酸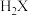 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是
溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是
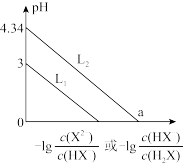
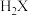 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是
溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是
A.NaHX溶液中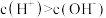 |
B.当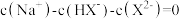 时, 时,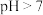 |
C.水的电离程度: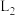 上的点大于 上的点大于 上的点 上的点 |
D.a点溶液中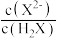 的数量级为 的数量级为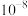 |
您最近一年使用:0次
2022-01-17更新
|
455次组卷
|
5卷引用:山东省济南市2021-2022上学期高二上学期期末考试化学试题
名校
解题方法
6 . 常温下,往20mL0.1mol·L-1NH4HSO4溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离的c水(H+)与所加NaOH溶液体积的关系如图所示(假设:混合后溶液体积的变化忽略不计,整个过程无氨气的逸出)。下列分析正确的是
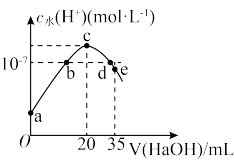
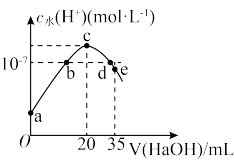
A.a~c之间,主要反应为NH +OH—=NH3·H2O +OH—=NH3·H2O |
| B.b点、d点对应溶液的pH均为7 |
C.d~e之间,溶液中c(Na+)+c(SO )=0.05mol/L )=0.05mol/L |
D.pH=7时,溶液中c(Na+)>c(SO )>c(NH )>c(NH )>c(OH—)=c(H+) )>c(OH—)=c(H+) |
您最近一年使用:0次
2022-01-16更新
|
467次组卷
|
3卷引用:上海市静安区2022届高三一模化学试题
名校
7 . 已知: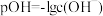 ,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随
,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随 上的变化如图所示。下列说法错误的是
上的变化如图所示。下列说法错误的是
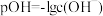 ,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随
,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随 上的变化如图所示。下列说法错误的是
上的变化如图所示。下列说法错误的是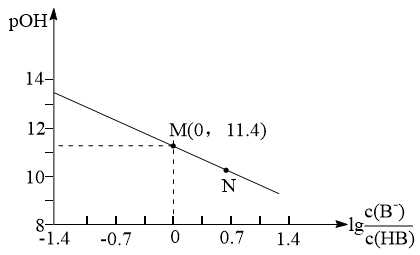
| A.当酸碱完全中和时,水的电离程度最大 |
B.室温下,HB的Ka数量级为 |
| C.将HB与NaB两溶液等体积等浓度混合,所得溶液呈碱性 |
D.N点对应溶液中: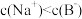 |
您最近一年使用:0次
2022-01-02更新
|
345次组卷
|
4卷引用:河南省名校联盟2021-2022学年高二上学期联考化学试题
名校
8 . 常温下,用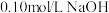 溶液分别滴定
溶液分别滴定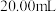 浓度均为
浓度均为 的
的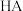 溶液和
溶液和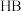 溶液,滴定曲线如图。下列说法正确的是
溶液,滴定曲线如图。下列说法正确的是

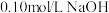 溶液分别滴定
溶液分别滴定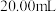 浓度均为
浓度均为 的
的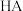 溶液和
溶液和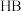 溶液,滴定曲线如图。下列说法正确的是
溶液,滴定曲线如图。下列说法正确的是
A.电离平衡常数: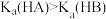 |
| B.水的电离程度:④>①>③>② |
C.点①和点②所示溶液中: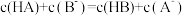 |
D.点③和点④所示溶液中均有: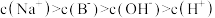 |
您最近一年使用:0次
2021-12-06更新
|
1438次组卷
|
6卷引用:重庆市高2022届高三第四次质量检测考试化学试题
名校
9 . 图中表示两种等体积的碱性溶液在稀释过程中pH的变化,下列相关说法正确的是
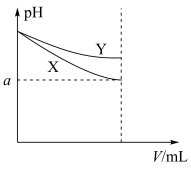

| A.两溶液稀释相同倍数,水电离的OH-浓度可能X>Y,也可能是X<Y |
| B.若图中曲线分别表示CH3COONa溶液和NaClO溶液,则X为CH3COONa溶液[已知Ka(CH3COOH)> Ka(HClO)] |
| C.加水稀释到任何程度,图中a一定大于7 |
| D.若图中曲线分别表示NaOH溶液和氨水,则起始时NaOH溶液浓度更大 |
您最近一年使用:0次
2021-11-15更新
|
885次组卷
|
6卷引用:浙江省A9协作体2021-2022学年高二上学期期中联考化学试题
浙江省A9协作体2021-2022学年高二上学期期中联考化学试题(已下线)期末综合测试卷01-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)浙江省桐庐中学2021-2022学年高二12月阶段性测试化学试题浙江省衢温“5+1”联盟2021-2022学年高一下学期期中考试化学(创新班)试题浙江省杭州市浙江大学附属中学2021-2022学年高二上学期期末考试化学试题安徽省池州市江南中学2021-2022学年高二上学期12月月考化学试题
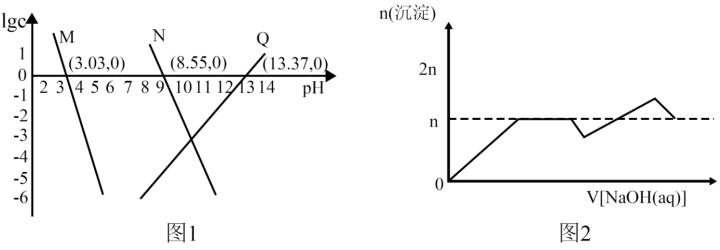
10 . 已知:①离子浓度为10-5mol/L时可认为沉淀完全;② 。向
。向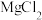 和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
下列说法正确的是:
 。向
。向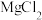 和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
下列说法正确的是:
| A.图1中M代表Mg2+ |
B. |
| C.[Al(OH)4]-完全沉淀时,溶液pH=6.37 |
| D.该实验中,沉淀的物质的量随NaOH溶液体积变化图象如图2 |
您最近一年使用:0次
2021-10-13更新
|
2317次组卷
|
2卷引用:湖北省武昌实验中学2022届高三十月阶段性测试化学试题



