名校
解题方法
1 . 某同学用邻苯二甲酸氢钾溶液来滴定NaOH溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_______ ,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是_______ ,选用指示剂是_______ 。
(2)滴定,并记录NaOH的终读数。重复滴定几次,数据记录如下表:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=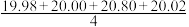 mL=20.20 mL,他的计算合理吗?理由是
mL=20.20 mL,他的计算合理吗?理由是_______ 。
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作_______ ;滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果_______ (填“偏大”、“偏小”或“无影响”)。
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是
(2)滴定,并记录NaOH的终读数。重复滴定几次,数据记录如下表:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
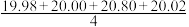 mL=20.20 mL,他的计算合理吗?理由是
mL=20.20 mL,他的计算合理吗?理由是(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作
您最近一年使用:0次
2022-04-12更新
|
43次组卷
|
2卷引用:云南省玉溪第三中学2021-2022学年高二上学期期末考试化学试题
名校
2 . 中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)_______ ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_______ 。
(2)滴定时,用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ,直到滴定终点。
(3)如图是某次滴定时的滴定管中的液面,其读数为_______ mL。

Ⅱ.维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告。(请填写空白)
测定目的:测定××牌软包装橙汁中维生素C的含量。
测定原理:C6H8O6+I2→C6H6O6+2H++2I-(待测橙汁中其他物质不与I2反应)
(1)实验用品及试剂:指示剂_______ (填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(2)实验过程:洗涤仪器,检查滴定管是否漏液,装好标准碘溶液待用。用酸式滴定管向锥形瓶中加入25.00mL待测橙汁,滴入2滴指示剂。进行滴定,滴定至终点时的现象是_______ 。
(3)数据记录与处理:重复上述实验2-3次后,平均消耗I2标准溶液的体积为15.00mL,则此橙汁中维生素C的含量是_______ g·L-1(保留2位小数)。
(4)下列操作,可能引起所测维生素C的含量偏高的是_______ 。
①用蒸馏水冲洗锥形瓶
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外
③读数时,滴定前仰视,滴定后俯视
Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)
(2)滴定时,用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视
(3)如图是某次滴定时的滴定管中的液面,其读数为

Ⅱ.维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告。(请填写空白)
测定目的:测定××牌软包装橙汁中维生素C的含量。
测定原理:C6H8O6+I2→C6H6O6+2H++2I-(待测橙汁中其他物质不与I2反应)
(1)实验用品及试剂:指示剂
(2)实验过程:洗涤仪器,检查滴定管是否漏液,装好标准碘溶液待用。用酸式滴定管向锥形瓶中加入25.00mL待测橙汁,滴入2滴指示剂。进行滴定,滴定至终点时的现象是
(3)数据记录与处理:重复上述实验2-3次后,平均消耗I2标准溶液的体积为15.00mL,则此橙汁中维生素C的含量是
(4)下列操作,可能引起所测维生素C的含量偏高的是
①用蒸馏水冲洗锥形瓶
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外
③读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
2021-04-21更新
|
124次组卷
|
2卷引用:云南省玉溪市一中2020-2021学年高二下学期4月月考化学试题
名校
解题方法
3 . 某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作
A.在250mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写) → → →D→ 。______ 。
(2)滴定管的读数应注意_____ 。
(3)E中在锥形瓶下垫一张白纸的作用是_____ 。
(4)D步骤中液面应调节到____ ,尖嘴部分应_____ 。
(5)滴定终点时锥形瓶中颜色变化是_____ 。
(6)若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会对测定结果_____ (指烧碱的纯度)有何影响?(指偏高、低或不变)
(7)该烧碱样品纯度的计算式为______ 。
A.在250mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写) → → →D→ 。
(2)滴定管的读数应注意
(3)E中在锥形瓶下垫一张白纸的作用是
(4)D步骤中液面应调节到
(5)滴定终点时锥形瓶中颜色变化是
(6)若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会对测定结果
(7)该烧碱样品纯度的计算式为
您最近一年使用:0次
2021-04-15更新
|
73次组卷
|
2卷引用:云南省玉溪市民族中学2021-2022学年高二上学期期末考试化学试题
解题方法
4 . 用标准盐酸滴定氢氧化钠溶液(甲基橙作指示剂),下列操作正确的是
| A.本实验最好选择酚酞作指示剂 |
| B.滴定管用蒸馏水洗涤后,即装入标准盐酸进行滴定 |
| C.当滴定至溶液由黄色变为橙色时,即为滴定终点,立即停止滴定 |
| D.滴定时,边摇动锥形瓶边观察瓶中溶液的颜色变化 |
您最近一年使用:0次
2020-09-20更新
|
411次组卷
|
2卷引用:云南省玉溪市江川区第二中学2021-2022学年高二下学期开学考试化学试题
9-10高一下·江西·期末
名校
解题方法
5 . 将V1 mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL,下列叙述正确的是( )


| A.做该实验时环境温度为22℃ |
| B.该实验表明化学能可能转化为热能 |
| C.NaOH溶液的浓度约为1.00mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |
您最近一年使用:0次
2020-03-19更新
|
1955次组卷
|
75卷引用:2010年云南省玉溪一中高二下学期期末考试化学试题
(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)09~10年江西白鹭洲中学高一下学期期末试题化学卷(已下线)2010年黑龙江牡丹江一中高二上学期期中考试化学试卷(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一下学期期初考试化学试卷(已下线)2011-2012学年浙江省杭州地区七校高二下学期期中联考化学试卷(已下线)2012-2013学年黑龙江省庆安三中高二上学期期中考试化学试卷(已下线)2012-2013学年重庆市第七中学高二上学期期中考试化学试卷(已下线)2012年苏教版高中化学选修6 6.1食醋总酸含量的测定练习卷(已下线)2014年高二化学人教版选修四 2中和反应反应热的测定练习卷(已下线)2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(已下线)2014-2015学年河南省南阳市新野三中上学期10月月考高二化学试卷2015-2016学年山西省右玉一中高二上学期第一次月考化学试卷2015-2016学年福建省师大附中高二上期末理化学试卷2015-2016学年浙江省安吉县上墅私立高中高一下期中化学试卷2015-2016学年云南省昆明三中高二下期中化学试卷2015-2016学年山东省泰安市高一下学期期末考试化学试卷2017届河北省邯郸一中等五校高三上学期第一次模拟化学试卷2016-2017学年河北省辛集中学高一下学期第二次月考化学试卷湖北省沙市中学2017-2018学年高二上学期第二次双周考化学试题山西省实验中学2017-2018学年高二上学期10月月考化学试题江西省九江市2017-2018学年高二上学期第一次阶段联考化学试题西藏日喀则市第二高级中学2017-2018学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B广东省中山市2017-2018学年高二上学期期末考试化学试题安徽省淮北市第一中学2017-2018学年高一下学期期中考试化学试题山西省忻州第一中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二上学期10月月考化学试题湖南省娄底市第四中学2018-2019学年高二上学期10月月考化学试题【全国百强校】山西省忻州市第一中学2018-2019学年高二上学期第一次月考化学试题湖北省荆州中学2018-2019学年高一下学期5月月考化学试题湖南省永州市东安县第一中学2019-2020学年高二上学期第一次月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二上学期9月月考化学试题贵州省思南中学2019-2020学年高二9月月考化学试题浙江省浙东北联盟(ZDB)2019-2020学年高二上学期期中考试化学试题人教版高中化学必修二第二单元《化学反应与能量》测试卷甘肃省酒泉市敦煌中学2020届高三上学期第二次调研考试化学试题2020届高三化学知识点强化训练—中和热四川省南充市阆中中学2020届高三化学选择题专项训练(22)山西省太原市山西省实验中学2019-2020学年高二上学期10月月考化学试题安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题(已下线)1.1.1 化学反应的反应热 内能变化 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1山东省滕州市第一中学2020-2021学年高二9月开学收心考试化学试题(已下线)1.1.2+热化学方程式-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)高一必修第二册(人教2019版)第六章 第一节 化学反应与能量变化 课时1 化学反应与能量变化鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 课时1 化学反应的反应热、内能变化与焓变陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第一节 反应热 课时1 反应热 焓变(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)河北省衡水市第十四中学2020-2021学年高二上学期期末考试化学试题宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题选择性必修1(SJ)专题1第一单元课时3 反应热的测定(已下线)1.1.2 反应热的测量与计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)辽宁省大连市第一中学2021-2022学年高二上学期学情反馈(一)化学试题浙江省金华市第八中学2021-2022学年高二上学期9月月考化学试题浙江省磐安县第二中学2021-2022学年高二10月份竞赛化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题湖南大学附属中学2021-2022学年高二上学期期中考试化学试题安徽省南陵中学2021-2022学年高二上学期9月月考化学试题(已下线)1.2.1 反应热的测量和热化学方程式-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)云南省丽江市第一高级中学2021-2022学年高二上学期元月考化学试题(已下线)第15讲 化学反应的热效应 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)1.1.2 反应热(二)-同步学习必备知识天津市天津中学2022-2023学年高二上学期期中测试化学试题河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期9月月考化学试题安徽省庐江县2021-2022学年高二上学期期末考试化学试题四川省宜宾市叙州区第一中学校2022-2023学年高二下学期开学考试化学试题安徽省安庆市怀宁县第二中学2022-2023学年高二上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期中考试化学(选考)试题5.3.1 化学变化中的能量变化(第1课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)宁夏六盘山高级中学2023-2024学年高二上学期第一次月考化学试题陕西省西安中学2023-2024学年高二上学期11月期中考试化学试题陕西省西安市 周至县第四中学2023-2024学年高二上学期10月份月考化学试题浙江省杭州市源清中学2023-2024学年高二上学期期末考试化学试题
名校
6 . 下列有关叙述中正确的是( )
| A.滴定管下端连有橡皮管的为酸式滴定管 |
| B.在滴定时,左手操作锥形瓶,右手操作滴定管开关 |
| C.滴定前应首先排除尖嘴部分的气泡 |
| D.滴定过程中两眼应注视滴定管内液面的变化 |
您最近一年使用:0次
2018-12-12更新
|
862次组卷
|
14卷引用:云南省玉溪市江川区第二中学2021-2022学年高二上学期12月考试化学试题
云南省玉溪市江川区第二中学2021-2022学年高二上学期12月考试化学试题宁夏回族自治区吴忠中学2018-2019学年高二上学期期末模拟化学试题云南省昭通市水富县第二中学2019-2020学年高二上学期期末考试化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题新疆吾尔自治区沙雅县第一中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第4节 离子反应 课时2 离子反应的应用——酸碱中和滴定海南省万宁市民族中学2019-2020学年度高二上学期期末考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)作业(十六) 酸碱中和滴定甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题
2018高二上·全国·专题练习
名校
解题方法
7 . 实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1〜4.4,石蕊:5.0〜8.0,酚酞:8.2〜10.0。用0.100 0 mol·L−1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时溶液呈碱性,下列叙述中正确的是
| A.可选用甲基橙或酚酞作指示剂 |
| B.只能选用石蕊作指示剂 |
| C.可选用石蕊或酚酞作指示剂 |
| D.只能选用酚酞作指示剂 |
您最近一年使用:0次
8 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol−1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×10−10,Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________ 中溶解,完全溶解后,全部转移至100 mL的_________ 中,加蒸馏水至____________ 。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O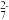 +6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O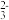 =S4O
=S4O +2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液__________ ,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________ %(保留1位小数)。
(1)已知:Ksp(BaSO4)=1.1×10−10,Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
| 实验步骤 | 现象 |
| ①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
| ③ | ④ |
| ⑤静置, | ⑥ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O
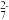 +6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O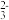 =S4O
=S4O +2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
您最近一年使用:0次
2018-06-09更新
|
10556次组卷
|
16卷引用:云南省玉溪市元江一中2019届高三第一次月考化学试题
云南省玉溪市元江一中2019届高三第一次月考化学试题2018年全国普通高等学校招生统一考试化学(新课标III卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题安徽省淮北地区2019届高三上学期入学摸底考试化学试题陕西省宝鸡中学2019届高三入学调研考化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第3讲 硫及其化合物 (教学案)【市级联考】广东省化州市2019年高三上学期第二次模拟考试理科综合化学试题【全国百强校】广西河池市高级中学2018-2019学年高二下学期第一次月考理综-化学试题(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略西藏拉萨中学2019-2020学年高二上学期第三次月考理综化学试题四川省雅安中学2020-2021学年高二下学期期中考试理综化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)广东省深圳市第七高级中学2022届高三上学期9月月考化学试题广西容县高级中学2021-2022学年高二下学期开学考试理科综合化学试题 鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)
名校
9 . 下列说法正确的是
| A.0.1 mol·L-1pH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-) |
B.如下图表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1 NaOH溶液时,溶液的pH随加入酸体积的变化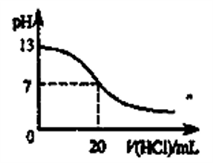 |
| C.在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-) |
D.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy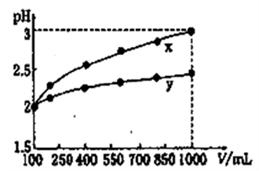 |
您最近一年使用:0次
2017-10-28更新
|
956次组卷
|
7卷引用:云南省峨山彝族自治县第一中学2018届高三第四次模拟考试化学试题
名校
解题方法
10 . 某化学小组设计了如图1所示的数字化实验装置,研究常温下,向1L 0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图2所示,则下列说法中不正确的是
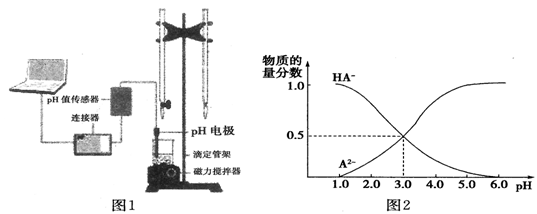

| A.pH=4.0时,图中n(HA-)约为0.0091mol |
| B.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂 |
| C.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 |
| D.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
您最近一年使用:0次
2016-12-09更新
|
299次组卷
|
7卷引用:云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题



