名校
1 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.0.1mol 含有电子数为 含有电子数为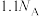 |
B.6.4gCu与0.1molS充分反应,转移电子数为 |
C.常温下,2.7g铝粉与足量浓硝酸反应,转移电子数为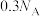 |
D.1L 氨水中含有 氨水中含有 和 和 的数目之和为 的数目之和为 |
您最近一年使用:0次
名校
2 . H2A为二元酸,其电离过程为:H2A⇌H++HA-、HA-⇌H++A2-。常温时,向10mL 0.1mol∙L-1H2A水溶液中逐滴滴加 0.1mol∙L-1NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
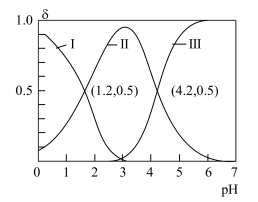
A.H2A的 的数量级为 的数量级为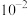 |
| B.当溶液中c(H2A)=c(A2-)时,pH=2.9 |
| C.当溶液中c(Na+)=2c(A2-)+c(HA-)时,加入V(NaOH溶液)>10mL |
D.向 的溶液中继续滴加NaOH溶液,水的电离程度减小 的溶液中继续滴加NaOH溶液,水的电离程度减小 |
您最近一年使用:0次
名校
解题方法
3 . 守恒是重要的科学原理,我们在学习化学的过程中接触过很多守恒:质量守恒、原子守恒、电子守恒、电荷守恒等。请回答以下问题:
(1)某溶液中只有 、
、 、
、 和
和 四种离子,已知
四种离子,已知 、
、 、
、 的物质的量浓度分别2mol/L、1mol/L、1mol/L,则
的物质的量浓度分别2mol/L、1mol/L、1mol/L,则 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(2)同温同压下,某集气瓶充满 时为116g,充满
时为116g,充满 时为122g,充满气体A时为114g,则A的相对分子质量为
时为122g,充满气体A时为114g,则A的相对分子质量为___________ 。
(3)在浓盐酸中 与
与 反应的离子方程式为:
反应的离子方程式为: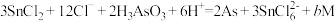 ,则b的数值为
,则b的数值为___________ 。
(4)在100mL 溶液中通入2.24L氯气(标准状况);溶液中有1/2的
溶液中通入2.24L氯气(标准状况);溶液中有1/2的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(5)已知:1mol 与一定浓度的
与一定浓度的 反应,生成
反应,生成 、
、 、NO和
、NO和 ,表现氧化性的硝酸的物质的量是
,表现氧化性的硝酸的物质的量是___________ mol。
(1)某溶液中只有
 、
、 、
、 和
和 四种离子,已知
四种离子,已知 、
、 、
、 的物质的量浓度分别2mol/L、1mol/L、1mol/L,则
的物质的量浓度分别2mol/L、1mol/L、1mol/L,则 的物质的量浓度为
的物质的量浓度为(2)同温同压下,某集气瓶充满
 时为116g,充满
时为116g,充满 时为122g,充满气体A时为114g,则A的相对分子质量为
时为122g,充满气体A时为114g,则A的相对分子质量为(3)在浓盐酸中
 与
与 反应的离子方程式为:
反应的离子方程式为: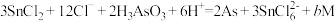 ,则b的数值为
,则b的数值为(4)在100mL
 溶液中通入2.24L氯气(标准状况);溶液中有1/2的
溶液中通入2.24L氯气(标准状况);溶液中有1/2的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为(5)已知:1mol
 与一定浓度的
与一定浓度的 反应,生成
反应,生成 、
、 、NO和
、NO和 ,表现氧化性的硝酸的物质的量是
,表现氧化性的硝酸的物质的量是
您最近一年使用:0次
4 . 25℃时,某一元弱酸HX的电离平衡常数Ka=1.0×10-5,则:
(1)0.1mol/L的HX溶液中HX的电离度约为_______ 。
(2)若1L0.1mol/L的HX溶液中加入1mL0.1mol/LAgNO3溶液生成了AgX沉淀,则该温度下Ksp(AgX)≤______ (假设混合后溶液总体积仍为1L,且忽略因稀释导致的HX溶液电离平衡的移动);
(3)0.1mol/L的NaX溶液的pH值约为_____ ,该溶液中水电离的c(OH-)为_______ mol/L;
(4)若用0.1mol/L的NaOH标准溶液来滴定锥形瓶中未知浓度的HX溶液应选择的指示剂为_______ (选填:甲基橙、酚酞或紫色石蕊),若滴入的NaOH溶液恰好中和了一半,那么此时溶液中存在微粒的浓度由大到小的次序是_______ 。
(1)0.1mol/L的HX溶液中HX的电离度约为
(2)若1L0.1mol/L的HX溶液中加入1mL0.1mol/LAgNO3溶液生成了AgX沉淀,则该温度下Ksp(AgX)≤
(3)0.1mol/L的NaX溶液的pH值约为
(4)若用0.1mol/L的NaOH标准溶液来滴定锥形瓶中未知浓度的HX溶液应选择的指示剂为
您最近一年使用:0次
名校
解题方法
5 . 常温下有浓度均为 的四种溶液:①
的四种溶液:① 溶液;②
溶液;② 溶液;③HCl溶液;④氨水
溶液;③HCl溶液;④氨水
(1)上述溶液中,溶质可发生水解的是___________ (填序号)。
(2)向④中加入少量氯化铵固体,此时氨水的电离平衡___________ 移动(填“向右”、“向左”、或“不”),溶液中 的值
的值___________ (填“增大”、“减小”或“不变”)。
(3)若将③和④混合后溶液恰好呈中性,则混合前③的体积___________ ④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是___________ 。
(4)取10mL③,加水稀释到500mL,则此时溶液中由水电离出的
___________ 。
(5)已知18℃时, 的
的 ,其饱和溶液中
,其饱和溶液中 的物质的量浓度是
的物质的量浓度是___________ 。
 的四种溶液:①
的四种溶液:① 溶液;②
溶液;② 溶液;③HCl溶液;④氨水
溶液;③HCl溶液;④氨水(1)上述溶液中,溶质可发生水解的是
(2)向④中加入少量氯化铵固体,此时氨水的电离平衡
 的值
的值(3)若将③和④混合后溶液恰好呈中性,则混合前③的体积
(4)取10mL③,加水稀释到500mL,则此时溶液中由水电离出的

(5)已知18℃时,
 的
的 ,其饱和溶液中
,其饱和溶液中 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
6 . 处理某铜冶金污水(含 、
、 、
、 、
、 )的部分流程如下:
)的部分流程如下:
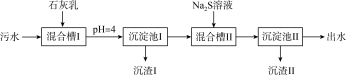
已知:①常温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②常温下, ,
, 。
。
下列说法错误的是
 、
、 、
、 、
、 )的部分流程如下:
)的部分流程如下:
已知:①常温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
物质 |
|
|
开始沉淀时的pH | 1.8 | 3.5 |
沉淀完全时 | 3 | 4.6 |
 ,
, 。
。下列说法错误的是
A.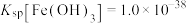 |
B. 溶液呈碱性,其主要原因是 溶液呈碱性,其主要原因是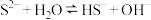 |
C.“沉淀池Ⅱ”中,当 和 和 完全沉淀时,溶液中 完全沉淀时,溶液中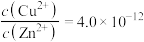 |
| D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水 |
您最近一年使用:0次
7 . 下列目的、方案设计、现象和结论都正确的是
选项 | 目的 | 方案设计 | 现象和结论 |
A | 探究温度对化学平衡的影响 | 将 的 的 溶液加热后置于冷水中,观察现象 溶液加热后置于冷水中,观察现象 | 若溶液由黄绿色变为蓝绿色,则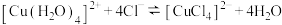  |
B | 比较 和 和 的酸性大小 的酸性大小 | 将 气体通入 气体通入 溶液中 溶液中 | 产生白色沉淀,则酸性: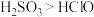 |
C | 探究浓度对化学平衡的影响 | 向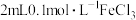 溶液中滴加 溶液中滴加 溶液,再加入少量 溶液,再加入少量 固体 固体 | 溶液变红,加入 固体后,红色变浅, 固体后,红色变浅, 的平衡逆向移动 的平衡逆向移动 |
D | 探究影响水电离的因素 | 常温下,用pH计测定 溶液的pH 溶液的pH | 测得 , , 溶液对水的电离程度无影响 溶液对水的电离程度无影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 柠檬酸是番茄中最常见的天然酸性物质,其分子结构简式为 (用
(用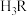 表示)。常温下,用
表示)。常温下,用 溶液滴定
溶液滴定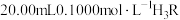 溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为:
溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为: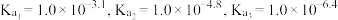 。下列叙述正确的是
。下列叙述正确的是

A.a点溶液中, |
B.b点溶液中, |
C.常温下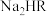 溶液加水稀释过程中, 溶液加水稀释过程中, 减小 减小 |
D.常温下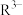 的水解常数为 的水解常数为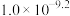 |
您最近一年使用:0次
2024-01-12更新
|
189次组卷
|
4卷引用:江西省宜春市宜丰中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
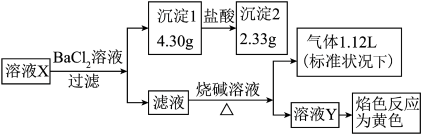
9 . 已知水溶液中Al3与CO 不能大量共存。某未知溶液X可能含有Al3、Na、NH
不能大量共存。某未知溶液X可能含有Al3、Na、NH 、Cl-、CO
、Cl-、CO 、SO
、SO 中的若干种,取该溶液进行如图实验,若实验过程中所加试剂均过量,产生的气体全部逸出。则下列说法正确的是
中的若干种,取该溶液进行如图实验,若实验过程中所加试剂均过量,产生的气体全部逸出。则下列说法正确的是
 不能大量共存。某未知溶液X可能含有Al3、Na、NH
不能大量共存。某未知溶液X可能含有Al3、Na、NH 、Cl-、CO
、Cl-、CO 、SO
、SO 中的若干种,取该溶液进行如图实验,若实验过程中所加试剂均过量,产生的气体全部逸出。则下列说法正确的是
中的若干种,取该溶液进行如图实验,若实验过程中所加试剂均过量,产生的气体全部逸出。则下列说法正确的是
A.原溶液中一定存在Na、NH 、CO 、CO 、SO 、SO ,可能存在Cl- ,可能存在Cl- |
| B.原溶液中可能存在Na,n(Cl-)≥0.01mol |
C.原溶液中一定存在CO 、SO 、SO 、NH 、NH ,浓度分别为0.01mol/L、0.01mol/L、0.05mol/L ,浓度分别为0.01mol/L、0.01mol/L、0.05mol/L |
| D.原溶液中一定不存在Al3、Cl- |
您最近一年使用:0次
名校
10 . 向一定量的 溶液中逐滴加入
溶液中逐滴加入 溶液,生成沉淀
溶液,生成沉淀 的量随
的量随 加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是

 溶液中逐滴加入
溶液中逐滴加入 溶液,生成沉淀
溶液,生成沉淀 的量随
的量随 加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
A.a点对应的溶液中: |
B.b点对应的溶液中: |
C.c点对应的溶液中: |
D.d点对应的溶液中: |
您最近一年使用:0次



 的pH
的pH

