名校
1 . 某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误 的是

A.该酸 |
B.某 的缓冲溶液, 的缓冲溶液, |
C.当该溶液的 时, 时, |
D.NaA的水解平衡常数 |
您最近一年使用:0次
2024-05-04更新
|
89次组卷
|
2卷引用:陕西省西安市第八十三中学2023-2024学年高二下学期第一次月考化学试题
2 . 盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示 FeCl3 可作净水剂的原因 :_______ 。
(2)常温下,在 pH=3 的硫酸与 pH =11 的 Na 2 S 溶液中,水电离出来的 c(OH- ) 之比为______
(3)物质的量浓度相等的下列溶液溶液 ①NH4Cl、②NH4HSO4、③(NH4)2SO4、④CH3COONH4 ⑤NH3·H2O ,溶液中c( ) 由大到小的顺是
) 由大到小的顺是 _______ ( 用序号表示)。
(4)已知 25 ℃ 时 Ksp[Mg(OH) 2 ]=1.8×10 -11 , Ksp[Cu(OH) 2 ] =2.2 ×10 -20 。25 ℃ 时,向浓度均为 0.1 mol/L 的 MgCl 2 和 CuCl 2 混合溶液中逐滴加入氨水,先生成_______ ( 填化学式)沉淀 ; 当体系中两种沉淀共存时,  =
= _______ 。
(1)用离子方程式表示 FeCl3 可作净水剂的原因 :
(2)常温下,在 pH=3 的硫酸与 pH =11 的 Na 2 S 溶液中,水电离出来的 c(OH- ) 之比为
(3)物质的量浓度相等的下列溶液溶液 ①NH4Cl、②NH4HSO4、③(NH4)2SO4、④CH3COONH4 ⑤NH3·H2O ,溶液中c(
 ) 由大到小的顺是
) 由大到小的顺是 (4)已知 25 ℃ 时 Ksp[Mg(OH) 2 ]=1.8×10 -11 , Ksp[Cu(OH) 2 ] =2.2 ×10 -20 。25 ℃ 时,向浓度均为 0.1 mol/L 的 MgCl 2 和 CuCl 2 混合溶液中逐滴加入氨水,先生成
 =
=
您最近一年使用:0次
3 . 常温下,用NaOH溶液调节H3AsO4溶液的pH,得到H3AsO4各形态的分布分数(δ)曲线随pH变化如图,下列说法不正确的是
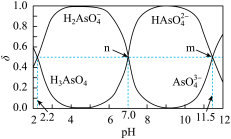

| A.H3AsO4的Ka2=10-7.0 |
B.m点有c(H+)=c(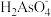 )+2c( )+2c(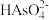 )+3c( )+3c( )+c(OH-) )+c(OH-) |
C.n点对应的溶液中,离子浓度的大小关系为c(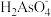 )=c( )=c(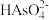 )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| D.m点水的电离程度大于n点水的电离程度 |
您最近一年使用:0次
4 . NaHCO3是重要的化工原料,在Na2CO3保护氛围下可制备Mg3N2。回答下列问题。
(1)常温下,NaHCO3水溶液显碱性的原因是___________ (用离子方程式表示):将NaHCO3水溶液中c(Na+),c( )、c(
)、c( ),c(H2CO3)按从大到小的顺序排列
),c(H2CO3)按从大到小的顺序排列_________ 。
(2)泡沫灭火器的原理是Al2(SO4)3溶液和NaHCO3溶液混合,请写出该反应的离子方程式______ 。
已知Ka1(H2CO3)=4.0×10-7,Ka2(H2CO3)=8.4×10-11,NaHCO3溶液中存在自耦电离:2 =H2CO3+
=H2CO3+ ,该反应平衡常数K=
,该反应平衡常数K=________ 。
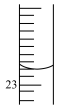
(3)可用碱式滴定管准确量取一定体积的NaHCO3溶液。如图所示滴定管读数为_____ 。
(4)酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。已知25℃时部分弱电解质的电离常数如后表:
①浓度相同的①NaCN②CH3COONa③Na2S三种溶液,其pH由大到小的顺序为________ (填序号)。
②已知次磷酸(H3PO2)是一种一元弱酸,向10mL H3PO2溶液中加入10mL筝物质的量浓度的NaOH溶液后,所得溶液中的阴离子有:___________ ;常温下,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填序号)。
A.c(H+) B.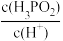 C.
C. D.
D.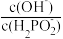
③25℃时,氨水与NH4Cl的混合溶液pH=8,该溶液中c( ):c(NH3·H2O)=
):c(NH3·H2O)=________ 。
④分析化学中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4作指示剂,利用Ag+与 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全(浓度等于1×10-5mol/L)时,溶液中c(
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全(浓度等于1×10-5mol/L)时,溶液中c( )=
)=_____ mol/L (结果保留两位有效数字,已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=1.8×10-10)
(1)常温下,NaHCO3水溶液显碱性的原因是
 )、c(
)、c( ),c(H2CO3)按从大到小的顺序排列
),c(H2CO3)按从大到小的顺序排列(2)泡沫灭火器的原理是Al2(SO4)3溶液和NaHCO3溶液混合,请写出该反应的离子方程式
已知Ka1(H2CO3)=4.0×10-7,Ka2(H2CO3)=8.4×10-11,NaHCO3溶液中存在自耦电离:2
 =H2CO3+
=H2CO3+ ,该反应平衡常数K=
,该反应平衡常数K=(3)可用碱式滴定管准确量取一定体积的NaHCO3溶液。如图所示滴定管读数为

(4)酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。已知25℃时部分弱电解质的电离常数如后表:
| 物质 | HCN | CH3COOH | H3PO2 | H2S | NH3·H2O |
| 电离常数 | Ka=4×10-10 | Ka=1.8×10-5 | Ka=5.9×10-2 | Ka1=1×10-7 Ka2=7×10-15 | Kb=1.8×10-5 |
②已知次磷酸(H3PO2)是一种一元弱酸,向10mL H3PO2溶液中加入10mL筝物质的量浓度的NaOH溶液后,所得溶液中的阴离子有:
A.c(H+) B.
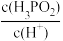 C.
C. D.
D.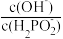
③25℃时,氨水与NH4Cl的混合溶液pH=8,该溶液中c(
 ):c(NH3·H2O)=
):c(NH3·H2O)=④分析化学中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4作指示剂,利用Ag+与
 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全(浓度等于1×10-5mol/L)时,溶液中c(
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全(浓度等于1×10-5mol/L)时,溶液中c( )=
)=
您最近一年使用:0次
5 . 请回答下列问题:25℃时,部分物质的电离平衡常数如表所示。
(1)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________ 。
a. b.
b. c.
c.
(2)在25℃时对氨水进行如下操作,请填写下列空白。
若向氨水中加入稀硫酸,使氨水恰好被中和,所得溶液的pH______ (填“>”“=”或“<”)7,用离子方程式表示其原因:_______ 。
(3)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为_______ 。
(4)25℃时NaHSO3的水解平衡常数Kb=_______ (结果保留1位有效数字)。向NaHSO3溶液滴加石蕊溶液后变红,则HSO 的电离程度
的电离程度_______ (其水解程度填“>”或“=”或“<”)。
| 化学式 | CH3COOH | NH3•H2O | H2CO3 | H2SO3 |
| 电离平衡常数 | 1.75×10-5 | 1.8×10-5 | K1=4.5×10-7 K2=4.7×10-11 | K1=1.4×10-2 K2=6.0×10-8 |
a.
 b.
b. c.
c.
(2)在25℃时对氨水进行如下操作,请填写下列空白。
若向氨水中加入稀硫酸,使氨水恰好被中和,所得溶液的pH
(3)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为
(4)25℃时NaHSO3的水解平衡常数Kb=
 的电离程度
的电离程度
您最近一年使用:0次
解题方法
6 . 回答下列问题:
(1)现有25℃时0.1mol•L-1的氨水,请回答以下问题:
①若向氨水中加入少量硫酸铵固体,此时溶液中
______ (填“增大”“减小”或“不变”)。
②若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH )=amol•L-1,则c(SO
)=amol•L-1,则c(SO )为
)为_______ 。
(2)泡沫灭火器原理(用离子方程式表示)______ 。
(3)已知NaHR溶液中c(H2R)<c(R2-),则该溶液中c(H+)_______ c(OH-)(填写“<”或“=”或“>”)。
(4)某温度(t℃)时,Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,若所得混合溶液为中性,则a:b=_______ 。
(5)已知Cu(OH)2的Ksp=c(Cu2+)[c(OH-)]2=2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。则①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH大于_______ 。
(6)在苏打溶液中存在的电荷守恒式为_______ ;质子守恒式为_______ 。
(1)现有25℃时0.1mol•L-1的氨水,请回答以下问题:
①若向氨水中加入少量硫酸铵固体,此时溶液中

②若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH
 )=amol•L-1,则c(SO
)=amol•L-1,则c(SO )为
)为(2)泡沫灭火器原理(用离子方程式表示)
(3)已知NaHR溶液中c(H2R)<c(R2-),则该溶液中c(H+)
(4)某温度(t℃)时,Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,若所得混合溶液为中性,则a:b=
(5)已知Cu(OH)2的Ksp=c(Cu2+)[c(OH-)]2=2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。则①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH大于
(6)在苏打溶液中存在的电荷守恒式为
您最近一年使用:0次
解题方法
7 . 下列选项中所列比值为1∶1的是
A.NaHSO3溶液中c(Na+)与c(HSO )之比 )之比 |
| B.CH3COONa溶液中c(Na+)与c(CH3COO-)之比 |
| C.相同温度下pH=3的CH3COOH溶液和pH=3的H2SO4溶液中的c(H+)之比 |
| D.等物质的量SO2和O2混合反应,达平衡时SO2和O2转化率之比 |
您最近一年使用:0次
解题方法
8 . 下列有关方程式正确的是
A.硫化钠水溶液呈碱性: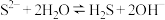 |
B.粗铜精炼的阳极反应式: |
C.氢氧燃料电池的负极反应式: |
D.铅酸蓄电池放电时负极反应式: |
您最近一年使用:0次
9 . 按要求完成下题。
(1)写出H2S的电离方程式:______ 。
(2)0.1mol/LNa2CO3溶液中各离子浓度大小顺序为______ 。
(3)pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液显______ 性。
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______ 。
(5)常温下,NaCN溶液的pH>7,原因是______ (离子反应方程式)。
(6)常温下,pH=10的CH3COONa溶液中,由水电离出的c(OH-)=______ mol/L。
(7)常温下,0.05mol/LH2SO4溶液的pH=______ 。
(1)写出H2S的电离方程式:
(2)0.1mol/LNa2CO3溶液中各离子浓度大小顺序为
(3)pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液显
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(5)常温下,NaCN溶液的pH>7,原因是
(6)常温下,pH=10的CH3COONa溶液中,由水电离出的c(OH-)=
(7)常温下,0.05mol/LH2SO4溶液的pH=
您最近一年使用:0次
解题方法
10 . AgCl溶液在下列四种情况下,其溶解度最小的是
| A.在纯水中 | B.在0.1mol•L-1的AgNO3溶液中 |
| C.在0.1mol•L-1的HCl中 | D.在0.1mol•L-1的CaCl2溶液中 |
您最近一年使用:0次



