名校
1 . 常温下,取三份浓度均为 体积均为20mL的醋酸钠溶液,分别向其中滴加浓度均为
体积均为20mL的醋酸钠溶液,分别向其中滴加浓度均为 的氯化铵溶液、醋酸铵溶液和盐酸,滴加过程中溶液的pOH变化曲线如图所示
的氯化铵溶液、醋酸铵溶液和盐酸,滴加过程中溶液的pOH变化曲线如图所示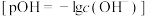 。
。
 体积均为20mL的醋酸钠溶液,分别向其中滴加浓度均为
体积均为20mL的醋酸钠溶液,分别向其中滴加浓度均为 的氯化铵溶液、醋酸铵溶液和盐酸,滴加过程中溶液的pOH变化曲线如图所示
的氯化铵溶液、醋酸铵溶液和盐酸,滴加过程中溶液的pOH变化曲线如图所示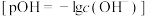 。
。
| A.曲线Ⅰ、Ⅱ、Ⅲ分别代表盐酸、氯化铵溶液和醋酸铵溶液 |
B.常温下 |
C.水的电离程度: |
D.d点存在: |
您最近一年使用:0次
7日内更新
|
67次组卷
|
2卷引用:河南省青桐鸣联考2023-2024学年高二下学期3月月考化学试题
2 . 用相关化学反应原理解释下列问题:
(1)已知 的键能分别为
的键能分别为 ,写出工业合成氨的热化学方程式
,写出工业合成氨的热化学方程式___________ 。
(2)硫化铝(Al2S3)不能通过水溶液中的离子反应制取,其原因是___________ (用离子方程式表示)。
(3) 可用来净水的原因是
可用来净水的原因是___________ (用离子方程式表示)。
(4)氯碱工业中电解饱和食盐水的化学方程式为___________ 。
(5)已知 溶液显酸性,则该溶液中各离子浓度从大到小的顺序为
溶液显酸性,则该溶液中各离子浓度从大到小的顺序为___________ 。
(1)已知
 的键能分别为
的键能分别为 ,写出工业合成氨的热化学方程式
,写出工业合成氨的热化学方程式(2)硫化铝(Al2S3)不能通过水溶液中的离子反应制取,其原因是
(3)
 可用来净水的原因是
可用来净水的原因是(4)氯碱工业中电解饱和食盐水的化学方程式为
(5)已知
 溶液显酸性,则该溶液中各离子浓度从大到小的顺序为
溶液显酸性,则该溶液中各离子浓度从大到小的顺序为
您最近一年使用:0次
3 . 乙酸是典型的有机酸,在生产、生活中有广泛的应用。
(1)能证明 是弱酸的事实是
是弱酸的事实是___________ 。
A. 易挥发
易挥发
B.常温下,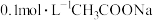 溶液的
溶液的 大于7
大于7
C.醋酸不易腐蚀衣服
D. 的
的 溶液稀释10倍,溶液
溶液稀释10倍,溶液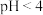
E.等体积等浓度的 溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
F.将一定量的 溶液加入
溶液加入 溶液中,有气泡产生
溶液中,有气泡产生
(2) 时,
时,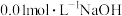 溶液的
溶液的 ,则该温度下,水的离子积
,则该温度下,水的离子积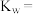
___________  ;该温度下,将
;该温度下,将 之和为13的
之和为13的 溶液和
溶液和 溶液等体积混合,所得溶液呈
溶液等体积混合,所得溶液呈___________ (填“酸”、“碱”或“中”)性。
(3)利用电催化还原 制备
制备 的装置如图所示。
的装置如图所示。___________ (填“正极”或“负极”);阴极的电极反应式为___________ 。
(4)常温下, 。
。
① 溶液中离子浓度大小关系为
溶液中离子浓度大小关系为___________ 。
②常温下,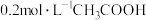 溶液和
溶液和 溶液等体积混合,所得混合溶液的
溶液等体积混合,所得混合溶液的
___________ 7(填“>”“<”或“=”)。
③某二元弱酸 的电离常数:
的电离常数: 。计算反应
。计算反应 的平衡常数为
的平衡常数为___________ (保留小数点后1位),由此说明该反应___________ (填“能发生”或“不能发生”)。
(1)能证明
 是弱酸的事实是
是弱酸的事实是A.
 易挥发
易挥发B.常温下,
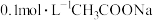 溶液的
溶液的 大于7
大于7C.醋酸不易腐蚀衣服
D.
 的
的 溶液稀释10倍,溶液
溶液稀释10倍,溶液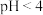
E.等体积等浓度的
 溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
溶液和盐酸,分别与足量镁粉反应,产生氢气一样多F.将一定量的
 溶液加入
溶液加入 溶液中,有气泡产生
溶液中,有气泡产生(2)
 时,
时,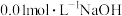 溶液的
溶液的 ,则该温度下,水的离子积
,则该温度下,水的离子积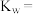
 ;该温度下,将
;该温度下,将 之和为13的
之和为13的 溶液和
溶液和 溶液等体积混合,所得溶液呈
溶液等体积混合,所得溶液呈(3)利用电催化还原
 制备
制备 的装置如图所示。
的装置如图所示。
(4)常温下,
 。
。①
 溶液中离子浓度大小关系为
溶液中离子浓度大小关系为②常温下,
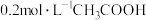 溶液和
溶液和 溶液等体积混合,所得混合溶液的
溶液等体积混合,所得混合溶液的
③某二元弱酸
 的电离常数:
的电离常数: 。计算反应
。计算反应 的平衡常数为
的平衡常数为
您最近一年使用:0次
4 . 常温下,浓度均为0.1mol/L的六种溶液:
① 溶液②
溶液② 溶液③盐酸④氨水⑤
溶液③盐酸④氨水⑤ ⑥
⑥
试回答下列问题:
(1)上述溶液中有水解反应发生的是___ (填编号,下同),溶液中溶质存在电离平衡的是_____ 。
(2)比较①、②溶液,pH值较大的是______ 。
(3)加热、蒸干、灼烧⑤后所得的产物是______ 。
(4)常温时,分别向20mL0.11mol/L⑥溶液和20mL0.1mol/L③中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。
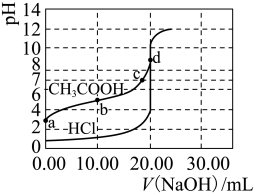
①a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为:______ 。
②a点对应的溶液中存在关系式:
______ 0.1mol/L(填“>”、“<”或“=”下同),b点对应的溶液中:
______  。
。
(5)相同条件下,下列五种溶液中 由大到小的顺序是
由大到小的顺序是______ 。
①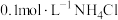 溶液②
溶液② 溶液③
溶液③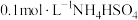 溶液④
溶液④ 氨水⑤
氨水⑤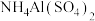 溶液
溶液
①
 溶液②
溶液② 溶液③盐酸④氨水⑤
溶液③盐酸④氨水⑤ ⑥
⑥
试回答下列问题:
(1)上述溶液中有水解反应发生的是
(2)比较①、②溶液,pH值较大的是
(3)加热、蒸干、灼烧⑤后所得的产物是
(4)常温时,分别向20mL0.11mol/L⑥溶液和20mL0.1mol/L③中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。

①a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为:
②a点对应的溶液中存在关系式:


 。
。(5)相同条件下,下列五种溶液中
 由大到小的顺序是
由大到小的顺序是①
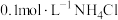 溶液②
溶液② 溶液③
溶液③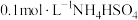 溶液④
溶液④ 氨水⑤
氨水⑤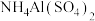 溶液
溶液
您最近一年使用:0次
5 . 下列实验探究方案能达到探究目的是
| 选项 | 探究方案 | 探究目的 |
| A | 分别用等体积 和 和 的 的 溶液与等浓度等体积的 溶液与等浓度等体积的 溶液反应 溶液反应 | 探究浓度对化学反应速率的影响 |
| B | 向2mLlmol/LNaOH溶液中滴加2滴0.1mol/L溶液,再滴加4滴0.1mol/L 溶液,观察沉淀的变化 溶液,观察沉淀的变化 | 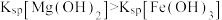 |
| C | 分别测浓度均为0.lmol/L的 和 和 溶液的pH值 溶液的pH值 | 比较 和 和 的水 的水解常数 |
| D | 用量筒量取50mL 的NaOH溶液迅速倒入盛有50mL 的NaOH溶液迅速倒入盛有50mL 盐酸的量热计内筒,立即盖上杯盖 盐酸的量热计内筒,立即盖上杯盖 | 测定中和热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 下列化学用语或图示表达不正确的是
A.砷原子的简化电子排布式为: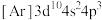 |
B. 的水解方程式: 的水解方程式: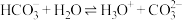 |
C.硫酸钡在水中的沉淀溶解平衡: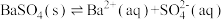 |
| D.一个电子从3p能级跃迁到3s能级,产生的原子光谱为发射光谱 |
您最近一年使用:0次
7 . 一定温度下, 水溶液中
水溶液中 、
、 、
、 的分布分数
的分布分数 与pH的关系如下图。例如
与pH的关系如下图。例如 。向0.5L浓度为0.10mol/L的氨水中通入
。向0.5L浓度为0.10mol/L的氨水中通入 气体。已知该温度下
气体。已知该温度下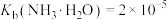 ,
, ,下列说法不正确的是
,下列说法不正确的是

 水溶液中
水溶液中 、
、 、
、 的分布分数
的分布分数 与pH的关系如下图。例如
与pH的关系如下图。例如 。向0.5L浓度为0.10mol/L的氨水中通入
。向0.5L浓度为0.10mol/L的氨水中通入 气体。已知该温度下
气体。已知该温度下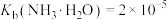 ,
, ,下列说法不正确的是
,下列说法不正确的是
A. 的电离常数: 的电离常数: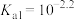 , , |
B.当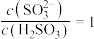 时, 时,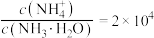 |
C.当pH=7.0时, |
D.通入0.05mol 时, 时, |
您最近一年使用:0次
名校
8 . 我国古代四大发明之一黑火药的爆炸反应为: 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.11.2 L  含有的原子数为 含有的原子数为 | B.0.1 mol  晶体中含离子数目为 晶体中含离子数目为 |
C.28g  ( ( )含的π键数目为 )含的π键数目为 | D.1 L 0.1 mol⋅L  溶液中含 溶液中含 数目为 数目为 |
您最近一年使用:0次
9 . 根据下列图示所得出的结论正确的是
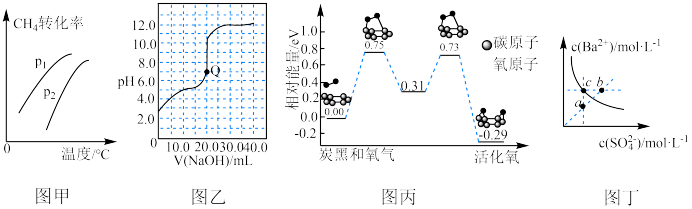
A.图甲表示密闭容器中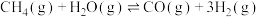 到达平衡时, 到达平衡时, 的转化率与压强、温度的变化关系曲线,说明 的转化率与压强、温度的变化关系曲线,说明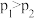 |
B.图乙是室温下用 NaOH溶液滴定20.00mL NaOH溶液滴定20.00mL 某一元酸HX的滴定曲线,说明HX是一元弱酸,Q点( 某一元酸HX的滴定曲线,说明HX是一元弱酸,Q点( ): ):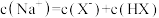 |
C.图丙表示炭黑作用下 生成活化氧过程中能量变化情况,说明活化氧分子时释放能量 生成活化氧过程中能量变化情况,说明活化氧分子时释放能量 |
D.图丁是室温下 在水中的沉淀溶解平衡曲线,若向a点加入 在水中的沉淀溶解平衡曲线,若向a点加入 固体,则溶液组成可实现b点状态 固体,则溶液组成可实现b点状态 |
您最近一年使用:0次
2024-03-21更新
|
76次组卷
|
2卷引用:河南省开封市五县联考2023-2024学年高二上学期12月月考化学试题
10 . 水溶液中的离子反应与我们的生产、生活等息息相关。回答下列问题:
(1) 时,
时, ,在该温度下,测得
,在该温度下,测得 的
的 溶液
溶液 。
。
① 在水溶液中的电离方程式为
在水溶液中的电离方程式为______ 。
②体积相等, 相同的盐酸与
相同的盐酸与 溶液分别与足量的
溶液分别与足量的 反应,与盐酸相比,
反应,与盐酸相比, 溶液产生的
溶液产生的
______ (填“多”“少”或“一样多”)。
(2)将 的
的 溶液与
溶液与 的
的 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中
溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中 。
。
①混合溶液中
______ (填“>”“<”或“=”,下同) 。
。
②混合溶液中
______  。
。
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
①写出 溶液与少量
溶液与少量 溶液反应的离子方程式:
溶液反应的离子方程式:______ 。
②若将体积相同,浓度均为 的盐酸和
的盐酸和 溶液,分别加水稀释10倍,溶液的
溶液,分别加水稀释10倍,溶液的 分别变为m,n,则m和n的大小关系为
分别变为m,n,则m和n的大小关系为______ 。
(4)已知常温下, ,向
,向 溶液中加入等体积
溶液中加入等体积 的稀盐酸,混合后溶液中的
的稀盐酸,混合后溶液中的
______  。
。
(1)
 时,
时, ,在该温度下,测得
,在该温度下,测得 的
的 溶液
溶液 。
。①
 在水溶液中的电离方程式为
在水溶液中的电离方程式为②体积相等,
 相同的盐酸与
相同的盐酸与 溶液分别与足量的
溶液分别与足量的 反应,与盐酸相比,
反应,与盐酸相比, 溶液产生的
溶液产生的
(2)将
 的
的 溶液与
溶液与 的
的 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中
溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中 。
。①混合溶液中

 。
。②混合溶液中

 。
。(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
弱酸 | HCOOH | H2C2O4 |
| 电离平衡常数K | 1.8×10-4 | Ka1=5.9×10-2,Ka26.4×10-5 |
 溶液与少量
溶液与少量 溶液反应的离子方程式:
溶液反应的离子方程式:②若将体积相同,浓度均为
 的盐酸和
的盐酸和 溶液,分别加水稀释10倍,溶液的
溶液,分别加水稀释10倍,溶液的 分别变为m,n,则m和n的大小关系为
分别变为m,n,则m和n的大小关系为(4)已知常温下,
 ,向
,向 溶液中加入等体积
溶液中加入等体积 的稀盐酸,混合后溶液中的
的稀盐酸,混合后溶液中的
 。
。
您最近一年使用:0次



