解题方法
1 . 已知:25℃时,二元弱酸 的
的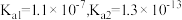 ;氢氧化铁的
;氢氧化铁的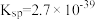 、氢氧化锌的
、氢氧化锌的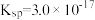 、硫化锌的
、硫化锌的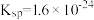 。下列有关说法正确的是
。下列有关说法正确的是
 的
的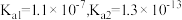 ;氢氧化铁的
;氢氧化铁的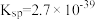 、氢氧化锌的
、氢氧化锌的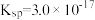 、硫化锌的
、硫化锌的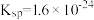 。下列有关说法正确的是
。下列有关说法正确的是A. 溶液中 溶液中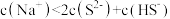 |
B. 饱和溶液中的 饱和溶液中的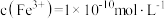 |
C.分别向等体积等浓度的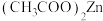 、 、 溶液中通入等物质的量的 溶液中通入等物质的量的 沉淀 沉淀 后,前者 后,前者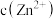 更大 更大 |
D.向等物质的量浓度的 与 与 混合液中逐滴加入 混合液中逐滴加入 溶液,先产生 溶液,先产生 沉淀 沉淀 |
您最近一年使用:0次
2 . 类推是化学学习和研究中常用的思维方法,下列推测不合理的是
| 选项 | 事实 | 推测 |
| A | 乳酸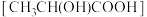 分子有对映异构体 分子有对映异构体 | 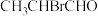 也有对映异构体 也有对映异构体 |
| B | 键角大小: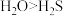 | 键角大小: |
| C | 第一电离能大小: | 第一电离能大小: |
| D | 在相同条件下,水解能力: | 在相同条件下,水解能力: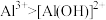 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 根据下列实验目的,对应的实验操作、实验现象和结论都正确的是
| 选项 | 实验目的 | 实验操作 | 实验现象和结论 |
| A | 探究钠在氧气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入 蒸馏水 蒸馏水 | 若无气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 |
| B | 探究浓硫酸的性质 | 加热浓硫酸、 固体与 固体与 固体的混合物 固体的混合物 | 有黄绿色气体产生,证明浓硫酸具有强氧化性 |
| C | 探究麦芽糖的水解情况 | 向麦芽糖溶液中滴加稀硫酸,水浴加热,再加入 溶液至碱性,加入新制的 溶液至碱性,加入新制的 悬浊液,加热 悬浊液,加热 | 有砖红色沉淀产生,则可说明麦芽糖已发生水解 |
| D | 验证 和 和 的水解能力 的水解能力 | 将 液体和 液体和 固体分别暴露在潮湿空气中 固体分别暴露在潮湿空气中 | 只有前者会冒“白烟”,则水解能力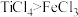 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论正确的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 比较 与 与 结合 结合 的能力 的能力 | 室温下,用pH计测相同物质的量浓度的 溶液和NaClO溶液的pH 溶液和NaClO溶液的pH | NaClO溶液的pH大 |  结合 结合 的能力比 的能力比 强 强 |
| B | 验证 消去生成乙烯 消去生成乙烯 | 乙醇与浓硫酸混合迅速加热至170℃,产生的气体通入酸性 溶液中 溶液中 |  溶液褪色 溶液褪色 | 生成了乙烯 |
| C | 探究CO还原 的固体产物 的固体产物 | 往 还原 还原 所得固体产物中先加稀盐酸,再滴加KSCN溶液 所得固体产物中先加稀盐酸,再滴加KSCN溶液 | 溶液不变红 | 固体产物为Fe |
| D | 探究反应物浓度和反应速率的关系 | 往各盛有4mL  酸性 酸性 溶液的a、b两试管中分别加入2mL 溶液的a、b两试管中分别加入2mL  、 、 的草酸溶液 的草酸溶液 | b试管溶液颜色比a浅 | 反应物浓度越大,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确的是
实验目的 | 方案设计 | 现象 | 结论 | |
A | 验证NaCl、Na2SO4混合溶液中的Cl- | 取少量混合溶液于试管中,加入过量Ba(NO3)2溶液,静置,向上层清液中滴加稀硝酸酸化AgNO3溶液 | 若上层清液变浑浊 | 则混合溶液中含有Cl- |
B | 探究CF2Cl2分子的极性与非极性 | 用毛皮摩擦过的带电橡胶棒靠近CF2Cl2液流 | 液流方向改变 | CF2Cl2是极性分子 |
C | 比较HCOOH和H2S的酸性 | 分别测等物质的量浓度的HCOONH4和(NH4)2S溶液的pH | 前者的pH小 | 酸性:HCOOH>H2S |
D | 探究SO2和Fe3+的反应{已知[Fe(SO2)6]3+呈红棕色} | 将SO2气体通入FeCl3溶液中 | 溶液先变为红棕色,过一段时间又变成浅绿色 | SO2和Fe3+络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 下列说法正确的是
A.Al2Cl6的结构式为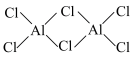 ,1mol该分子中含配位键的数目为4NA ,1mol该分子中含配位键的数目为4NA |
| B.NaClO溶液中加水,ClO-的水解程度增大,溶液碱性减弱 |
C.反应2BaO2(s) 2BaO(s)+O2(g)达到平衡后压缩体积,达到新平衡后c(O2)变大 2BaO(s)+O2(g)达到平衡后压缩体积,达到新平衡后c(O2)变大 |
| D.被保护的钢铁设备作阴极,用Zn电极作辅助阳极,该方法为外加电流法 |
您最近一年使用:0次
7 . 常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合(溶液混合体积变化忽略不计),两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?___________ 。
(2)根据乙组数据,可计算得出此温度下HA的电离常数为___________ (计算结果要求化简)。
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是___________ 。此溶液c(A-)+c(HA)=___________ 。(写精确值)
(4)据丁组实验数据,写出该混合溶液中下列算式的列式结果:
c(Na+)-c(A-)=___________ mol/L。
(5)现用0.1000mol/LNaOH溶液滴定未知浓度的HA溶液,
①在滴定步骤前,要进行一系列操作,按正确顺序排列___________ 。
a.向碱式滴定管中装入标准液至“0”刻度以上2~3mL处
b.用蒸馏水洗涤滴定管
c.将滴定管内装满水,直立于滴定管夹上约2min
d.用标准溶液润洗滴定管
e.将滴定管直立于滴定管夹上,静置1min左右,准确读取读数
f.将滴定管垂直固定在滴定管夹上,右手将乳胶管弯曲,并挤压玻璃球
②在滴定过程中,下列实验中,由于错误操作导致滴定实验结果一定偏高的是___________ 。
A.配制NaOH标准溶液定容时仰视刻度线,用此溶液去滴定HA溶液
B.滴定时盛放待测液的锥形瓶没有干燥,所测得待测液的浓度
C.选用甲基橙作指示剂
D.滴定管(装标准溶液)滴定前尖嘴处有气泡,滴定后无气泡
| 实验编号 | c(HA)/mol·L-1 | c([NaOH)/mol·L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | =m |
| 乙 | 0.12 | 0.1 | =7 |
| 丙 | 0.2 | 0.1 | <7 |
| 丁 | 0.1 | 0.1 | =11 |
(2)根据乙组数据,可计算得出此温度下HA的电离常数为
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)据丁组实验数据,写出该混合溶液中下列算式的列式结果:
c(Na+)-c(A-)=
(5)现用0.1000mol/LNaOH溶液滴定未知浓度的HA溶液,
①在滴定步骤前,要进行一系列操作,按正确顺序排列
a.向碱式滴定管中装入标准液至“0”刻度以上2~3mL处
b.用蒸馏水洗涤滴定管
c.将滴定管内装满水,直立于滴定管夹上约2min
d.用标准溶液润洗滴定管
e.将滴定管直立于滴定管夹上,静置1min左右,准确读取读数
f.将滴定管垂直固定在滴定管夹上,右手将乳胶管弯曲,并挤压玻璃球
②在滴定过程中,下列实验中,由于错误操作导致滴定实验结果一定偏高的是
A.配制NaOH标准溶液定容时仰视刻度线,用此溶液去滴定HA溶液
B.滴定时盛放待测液的锥形瓶没有干燥,所测得待测液的浓度
C.选用甲基橙作指示剂
D.滴定管(装标准溶液)滴定前尖嘴处有气泡,滴定后无气泡
您最近一年使用:0次
8 . 常温下,向0.40mol/LH2SO3(不考虑H2SO3不稳定分解生成SO2)溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如图所示。用Ka1、Ka2分别表示H2SO3一级与二级电离平衡常数。已知
)与溶液pH的关系如图所示。用Ka1、Ka2分别表示H2SO3一级与二级电离平衡常数。已知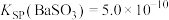 。下列说法
。下列说法不正确 的是
 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如图所示。用Ka1、Ka2分别表示H2SO3一级与二级电离平衡常数。已知
)与溶液pH的关系如图所示。用Ka1、Ka2分别表示H2SO3一级与二级电离平衡常数。已知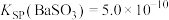 。下列说法
。下列说法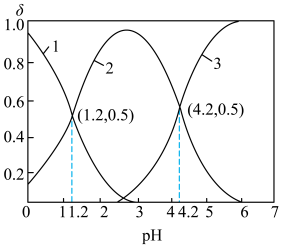
A.曲线2表示的微粒是 , ,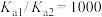 |
B.当 时,溶液中 时,溶液中 , , 时,溶液中 时,溶液中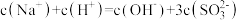 |
C.将0.40mol/LH2SO3溶液稀释至0.20mol/L,溶液中 几乎不变 几乎不变 |
D.0.40mol/LH2SO3溶液与0.40mol/LBaCl2溶液等体积混合,不会出现 沉淀 沉淀 |
您最近一年使用:0次
解题方法
9 . 25°C时,向2ml0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液。滴加过程中溶液含碳微粒物质的量与溶液pH的关系如图所示(CO2因逸出未画出)。下列说法不正确的是


A.②表示 物质的量的变化情况 物质的量的变化情况 |
| B.由b点可计算得出Ka2(H2CO3)=10-10.3 |
| C.a点由水电离产生的c(OH-)=10-11.6mol/L |
| D.a、b、c四点溶液中含碳微粒物质的量守恒,d点因有气体逸出而不守恒 |
您最近一年使用:0次
解题方法
10 . 设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为10-13NA |
B.1L0.1mol/L的NaHCO3溶液中N( )+N( )+N( )+N(H2CO3)=0.1NA )+N(H2CO3)=0.1NA |
C.3H2(g)+N2(g) 2NH3(g) 2NH3(g)  =-akJ/mol,则每NA个H2(g)与足量的N2(g)反应生成NH3放出的热量等于 =-akJ/mol,则每NA个H2(g)与足量的N2(g)反应生成NH3放出的热量等于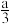 kJ kJ |
| D.4℃时,9mlH2O(l)含有的电子数约为5NA |
您最近一年使用:0次



