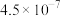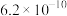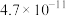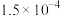名校
1 . 下列实验现象不能得出结论的是

A.装置甲:I中溶液变蓝色,II中有黄色沉淀,证明 与水的反应为可逆反应 与水的反应为可逆反应 |
B.装置乙:I中析出沉淀的量多于II中,证明 |
C.装置丙:悬浊液变澄清,说明 与氢氧化镁反应生成了配合物 与氢氧化镁反应生成了配合物 |
D.装置丁:振荡后分层,上层紫色变为浅红,下层呈棕黄色,证明 在浓KI溶液中更易溶解 在浓KI溶液中更易溶解 |
您最近一年使用:0次
名校
2 . 锑(Sb)可用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、MgO、
、MgO、 等)为原料提取锑的工艺如下:
等)为原料提取锑的工艺如下:
回答下列问题:
(1)“溶浸”时氧化产物是S, 被氧化的化学方程式为
被氧化的化学方程式为________ 。
(2)“还原”时加入Sb的目的是将________ 还原,提高产物的纯度。
(3)“水解”时需控制溶液pH=2.5。
① 发生水解的离子方程式为
发生水解的离子方程式为________ 。
②下列能促进该水解反应的措施有________ (填字母)。
A.升高温度 B.增大 C.增大
C.增大 D.加入
D.加入 粉末
粉末
③为避免水解产物中混入 ,
, 浓度应小于
浓度应小于________  (已知
(已知 )。
)。
(4)向“滤液”中通入足量 ,再将滤液pH调至3.5,可析出
,再将滤液pH调至3.5,可析出 沉淀。将沉淀溶于浓盐酸后,产物可返回
沉淀。将沉淀溶于浓盐酸后,产物可返回________ 工序循环使用。
(5)Sb可由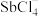 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为________ 。
 ,还含有
,还含有 、
、 、MgO、
、MgO、 等)为原料提取锑的工艺如下:
等)为原料提取锑的工艺如下: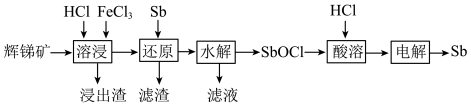
| 金属离子 |
|
|
|
|
开始沉淀时( )的pH )的pH | 2.2 | 3.7 | 7.5 | 9.6 |
完全沉淀时( )的pH )的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)“溶浸”时氧化产物是S,
 被氧化的化学方程式为
被氧化的化学方程式为(2)“还原”时加入Sb的目的是将
(3)“水解”时需控制溶液pH=2.5。
①
 发生水解的离子方程式为
发生水解的离子方程式为②下列能促进该水解反应的措施有
A.升高温度 B.增大
 C.增大
C.增大 D.加入
D.加入 粉末
粉末③为避免水解产物中混入
 ,
, 浓度应小于
浓度应小于 (已知
(已知 )。
)。(4)向“滤液”中通入足量
 ,再将滤液pH调至3.5,可析出
,再将滤液pH调至3.5,可析出 沉淀。将沉淀溶于浓盐酸后,产物可返回
沉淀。将沉淀溶于浓盐酸后,产物可返回(5)Sb可由
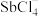 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
您最近一年使用:0次
名校
3 . 2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:
i.

ii.
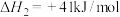
(1)研究表明,CO与 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:________ 。
(2)其他条件相同,当仅改变容器体积时,实验测得CO的平衡产率随着压强的增加而________ 。(填“增大”、“减小”或“不变”)
(3)在催化剂作用下,将 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性Y(
选择性Y( )的影响如下。
)的影响如下。
240℃体系达到平衡时用时为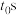 ,则
,则
________  。
。
240℃时反应i的化学平衡常数为________ (列出计算式即可,数据用小数表示)
(4)已知25℃时, 、
、 、HCN的电离平衡常数如下表。
、HCN的电离平衡常数如下表。
①25℃时,某 溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是
溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是________ 。
A.
B.
C.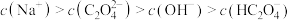
②将少量 溶液加入KCN溶液中,发生反应的离子方程式为
溶液加入KCN溶液中,发生反应的离子方程式为________ 。
(5) 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: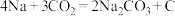 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式________ 。
 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:i.


ii.

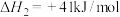
(1)研究表明,CO与
 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(2)其他条件相同,当仅改变容器体积时,实验测得CO的平衡产率随着压强的增加而
(3)在催化剂作用下,将
 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性Y(
选择性Y( )的影响如下。
)的影响如下。

240℃体系达到平衡时用时为
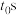 ,则
,则
 。
。240℃时反应i的化学平衡常数为
(4)已知25℃时,
 、
、 、HCN的电离平衡常数如下表。
、HCN的电离平衡常数如下表。
|
| HCN | |
|
|
|
|
|
|
| — |
 溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是
溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是A.

B.

C.
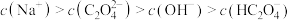
②将少量
 溶液加入KCN溶液中,发生反应的离子方程式为
溶液加入KCN溶液中,发生反应的离子方程式为(5)
 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: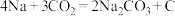 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
您最近一年使用:0次
4 . 下列实验操作、现象和结论均正确的是
| A.向蛋白质溶液中加入饱和Na2SO4溶液,有沉淀出现:蛋白质发生了变性 |
| B.将一定量的SO3加入水玻璃中,产生白色胶状沉淀:非金属性:S>Si |
| C.室温下,用pH试纸测定浓度均为0.1mol/L的NaClO溶液、CH3COONa溶液的pH,NaClO溶液的pH较大。酸性:HClO>CH3COOH |
| D.向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀:Fe(OH)3的溶解度小于Mg(OH)2的溶解度 |
您最近一年使用:0次
解题方法
5 . Ⅰ.25°C时,有关物质的电离平衡常数如下:
回答下列问题。
(1)常温下,醋酸钠的溶液呈___________ 性(填“酸”“中”或“碱”),原因是___________ (写离子方程式)。
(2)物质的量浓度为 的下列四种溶液,pH由大到小的顺序是___________(填编号)。
的下列四种溶液,pH由大到小的顺序是___________(填编号)。
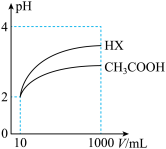
(3)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数___________ (填“大于”、“等于”或“小于”)醋酸的电离平衡常数:HX是___________ 酸(填“强”或“弱”),理由是___________ 。 ,将所得的
,将所得的 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到 ,原理如图所示(电极材料为石墨)。
,原理如图所示(电极材料为石墨)。___________ (填“正”或“负”)极,C口流出的物质是___________ 。
(5) 放电的电极反应式为
放电的电极反应式为___________ 。
| 化学式 |  |  |  |
| 电离平衡常数 | 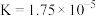 |   | 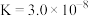 |
(1)常温下,醋酸钠的溶液呈
(2)物质的量浓度为
 的下列四种溶液,pH由大到小的顺序是___________(填编号)。
的下列四种溶液,pH由大到小的顺序是___________(填编号)。A. | B. | C. | D. |
(3)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数
 ,将所得的
,将所得的 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到 ,原理如图所示(电极材料为石墨)。
,原理如图所示(电极材料为石墨)。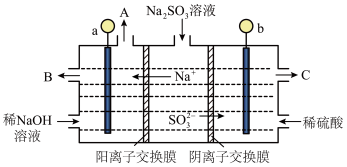
(5)
 放电的电极反应式为
放电的电极反应式为
您最近一年使用:0次
6 . 常温下,下列关于 的
的 溶液说法正确的是
溶液说法正确的是
 的
的 溶液说法正确的是
溶液说法正确的是A.将 的 的 溶液稀释10倍,溶液的 溶液稀释10倍,溶液的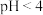 |
B.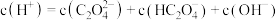 |
C.与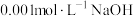 溶液等体积混合后,溶液呈碱性 溶液等体积混合后,溶液呈碱性 |
D.加水稀释时,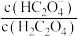 逐渐减小 逐渐减小 |
您最近一年使用:0次
7 . 为证明某可溶性一元酸(HX)是弱酸,设计如下实验得出的结论:HX是弱酸。其中不合理的是
A.室温下,测得 溶液的 溶液的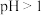 |
B.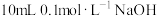 溶液与 溶液与 溶液恰好中和 溶液恰好中和 |
C.室温下,测得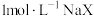 溶液的 溶液的 |
D.在相同条件下,对 的盐酸和 的盐酸和 的HX溶液进行导电性实验,HX溶液灯泡较暗 的HX溶液进行导电性实验,HX溶液灯泡较暗 |
您最近一年使用:0次
8 .  时,
时, 的
的 ,
,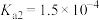 。
。
(1)常温下, 加水稀释,稀释过程中,溶液的导电能力
加水稀释,稀释过程中,溶液的导电能力___________ (填“增强”或“减弱”);
(2) 溶液显酸性的原因是
溶液显酸性的原因是___________ 。
(3)利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。
实验流程:取血样 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的
]溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的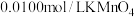 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。
① 标准溶液应用滴定管
标准溶液应用滴定管___________ (填“酸式”或“碱式”)盛装,注入 ,标准溶液之前,滴定管需要
,标准溶液之前,滴定管需要___________ 、洗涤和润洗。
②请写出滴定过程中发生的离子反应方程式:___________ 。
③判断达到滴定终点的依据是___________ 。血液样品中 浓度为
浓度为___________  (保留2位有效数字)。
(保留2位有效数字)。
④下列操作会使测得的血液中钙离子的浓度偏高的是___________ 。
A.滴定前因装液较多,测量同学坐着没有起身,抬头读数
B.滴定过程中用蒸馏水将锥形瓶内壁上黏附的溶液冲下
C.若未等滴定管液面稳定就读数
D.酸式滴定管在滴定前有气泡,滴定后气泡消失
 时,
时, 的
的 ,
,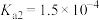 。
。(1)常温下,
 加水稀释,稀释过程中,溶液的导电能力
加水稀释,稀释过程中,溶液的导电能力(2)
 溶液显酸性的原因是
溶液显酸性的原因是(3)利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。
实验流程:取血样
 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的
]溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的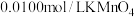 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。①
 标准溶液应用滴定管
标准溶液应用滴定管 ,标准溶液之前,滴定管需要
,标准溶液之前,滴定管需要②请写出滴定过程中发生的离子反应方程式:
③判断达到滴定终点的依据是
 浓度为
浓度为 (保留2位有效数字)。
(保留2位有效数字)。④下列操作会使测得的血液中钙离子的浓度偏高的是
A.滴定前因装液较多,测量同学坐着没有起身,抬头读数
B.滴定过程中用蒸馏水将锥形瓶内壁上黏附的溶液冲下
C.若未等滴定管液面稳定就读数
D.酸式滴定管在滴定前有气泡,滴定后气泡消失
您最近一年使用:0次
解题方法
9 . 回答下列问题
(1)已知: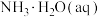 与
与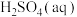 反应生成
反应生成 正盐的
正盐的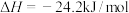 ;强酸、强碱的稀溶液反应的中和热的
;强酸、强碱的稀溶液反应的中和热的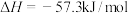 。请写出
。请写出 在水溶液中电离的热化学方程式
在水溶液中电离的热化学方程式___________
(2)25℃, 的电离常数
的电离常数 为
为 ,
, 的电常数
的电常数 为
为 。
。 溶液中
溶液中
___________  (填“等于”或“小于”或“大于”)
(填“等于”或“小于”或“大于”)
(3)某小组探究外界因素对 水解程度的影响。
水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为 )
)
ⅰ.实验1和2,探究加入 对
对 水解程度的影响;
水解程度的影响;
ⅱ.实验1和3,探究温度对 水解程度的影响。
水解程度的影响。
①根据甲同学的实验方案,补充数据:a=___________ 。
②实验测得 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据___________ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
③已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测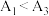 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是___________ 。
④小组通过测定不同温度下 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。
查阅资料: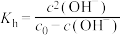 ,
, 为
为 溶液起始浓度。
溶液起始浓度。
试剂: 溶液、
溶液、 盐酸、
盐酸、 计。
计。
实验:测定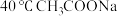 水解常数
水解常数 ,完成下表中序号6的实验。
,完成下表中序号6的实验。
在 和
和 下重复上述实验。
下重复上述实验。
数据处理:用含V、b、c的计算式表示 的
的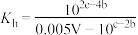
实验结论:通过___________ ,可以说明温度升高,促进 水解。
水解。
(1)已知:
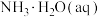 与
与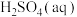 反应生成
反应生成 正盐的
正盐的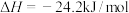 ;强酸、强碱的稀溶液反应的中和热的
;强酸、强碱的稀溶液反应的中和热的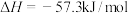 。请写出
。请写出 在水溶液中电离的热化学方程式
在水溶液中电离的热化学方程式(2)25℃,
 的电离常数
的电离常数 为
为 ,
, 的电常数
的电常数 为
为 。
。 溶液中
溶液中
 (填“等于”或“小于”或“大于”)
(填“等于”或“小于”或“大于”)(3)某小组探究外界因素对
 水解程度的影响。
水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为
 )
)ⅰ.实验1和2,探究加入
 对
对 水解程度的影响;
水解程度的影响;ⅱ.实验1和3,探究温度对
 水解程度的影响。
水解程度的影响。| 序号 | 温度 |  |  | 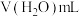 |  |
| 1 |  | 40.0 | 0 | 0 |  |
| 2 |  | 20.0 | 10.0 | a |  |
| 3 |  | 40.0 | 0 | 0 |  |
②实验测得
 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。③已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测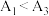 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是④小组通过测定不同温度下
 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。查阅资料:
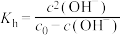 ,
, 为
为 溶液起始浓度。
溶液起始浓度。试剂:
 溶液、
溶液、 盐酸、
盐酸、 计。
计。实验:测定
 水解常数
水解常数 ,完成下表中序号6的实验。
,完成下表中序号6的实验。| 序号 | 实验 | 记录的数据 |
| 4 | 取 溶液,用 溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 消耗盐酸体积为VmL |
| 5 | 测 纯水的pH 纯水的pH | b |
| 6 | c |
 和
和 下重复上述实验。
下重复上述实验。数据处理:用含V、b、c的计算式表示
 的
的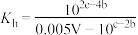
实验结论:通过
 水解。
水解。
您最近一年使用:0次
解题方法
10 . 根据下列实验操作和现象所得出的结论正确的题
| 选项 | 实验操作和现象 | 结论 |
| A | 用 试纸测得: 试纸测得: 溶液的 溶液的 约为9, 约为9, 溶液的 溶液的 约为8 约为8 |  电离出 电离出 的能力比 的能力比 的强 的强 |
| B | 向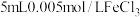 溶液中加入 溶液中加入 溶液,溶液呈红色,再滴加几滴 溶液,溶液呈红色,再滴加几滴 的 的 溶液,溶液颜色变浅 溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
| C | 大小相同的铝片分别加入同温同体积且 都为 都为 的盐酸、硫酸中,铝与盐酸反应产生气泡速率较快 的盐酸、硫酸中,铝与盐酸反应产生气泡速率较快 | 可能是 对该反应起到促进作用 对该反应起到促进作用 |
| D | 两支试管中分别加入 草酸溶液和 草酸溶液和 草酸溶液,同时加入 草酸溶液,同时加入 酸性高锰酸钾溶液,加入 酸性高锰酸钾溶液,加入 草酸溶液的试管中,高锰酸钾溶液褪色更快 草酸溶液的试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次