名校
解题方法
1 . 亚硫酸钠( )常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
)常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
实验(一)探究 水解的影响因素。
水解的影响因素。
I.配制250 mL 0.1 mol⋅L
 溶液。
溶液。
(1)称取 固体的质量为
固体的质量为______ g。
(2)配制该溶液不需要选择下列仪器中的______ (填标号)。
(3)实验①④_______ (填“能”或“不能”)得出单一变量对实验结果的影响规律。
(4)实验①和②的目的是___________ 。
(5)某同学预测 ,实验测得
,实验测得 ,
,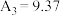 ,理论预测与实际矛盾的原因可能是
,理论预测与实际矛盾的原因可能是_______ (答1条);将实验③的溶液降温至25℃(标记为⑤),测得溶液pH为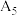 (9.25),小于
(9.25),小于 (9.66),请你猜想可能的原因:
(9.66),请你猜想可能的原因:_______ ,设计实验证明你的猜想:________ ,猜想成立。
实验(二)测定样品纯度。
称取w g 样品溶于水配制成100 mL溶液,准确量取25.00 mL制得的溶液于锥形瓶中,滴加2滴淀粉溶液,用标准c mol⋅L
 溶液滴定至终点,消耗滴定液的体积为V mL。
溶液滴定至终点,消耗滴定液的体积为V mL。
(6)该 样品纯度为
样品纯度为______ %,若滴定前仰视读数,滴定终点俯视读数,则测得的结果______ (填“偏高”“偏低”或“无影响”)。
 )常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
)常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:实验(一)探究
 水解的影响因素。
水解的影响因素。I.配制250 mL 0.1 mol⋅L

 溶液。
溶液。(1)称取
 固体的质量为
固体的质量为(2)配制该溶液不需要选择下列仪器中的
A. B.
B. C.
C.
| 序号 | 0.1 mol⋅L  溶液 /mL 溶液 /mL | 水/mL | 水浴温度/℃ | 测得pH |
| ① | 10.0 | 0 | 25 | 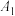 |
| ② | 5.0 | 5 | 25 | 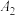 |
| ③ | 10.0 | 0 | 40 |  |
| ④ | 8.0 | 2 | 35 |  |
(3)实验①④
(4)实验①和②的目的是
(5)某同学预测
 ,实验测得
,实验测得 ,
,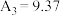 ,理论预测与实际矛盾的原因可能是
,理论预测与实际矛盾的原因可能是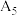 (9.25),小于
(9.25),小于 (9.66),请你猜想可能的原因:
(9.66),请你猜想可能的原因:实验(二)测定样品纯度。
称取w g 样品溶于水配制成100 mL溶液,准确量取25.00 mL制得的溶液于锥形瓶中,滴加2滴淀粉溶液,用标准c mol⋅L

 溶液滴定至终点,消耗滴定液的体积为V mL。
溶液滴定至终点,消耗滴定液的体积为V mL。(6)该
 样品纯度为
样品纯度为
您最近一年使用:0次
2024-02-03更新
|
120次组卷
|
4卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题
2 . 优化的NaFePO4复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是FeS2,含少量SiO2等杂质)为原料制备NaFePO4的流程如图所示。
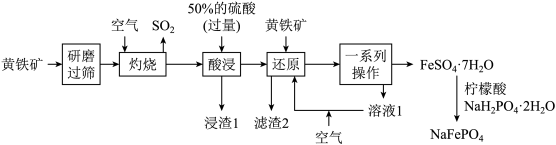
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全,lg4=0.6)
回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为_______ (填一种)。
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为_______ (答一条即可)。
(4)“浸渣1”的主要成分是_______ (填化学式) 。
(5)“还原”中FeS2与Fe3+反应的离子方程式为_______ ;通入空气的条件下, “溶液1”可在“还原”步骤中循环利用,则通入空气的目的是_______ 。
(6)“一系列操作”包括_______ 、_______ 、过滤、 洗涤和低温干燥。
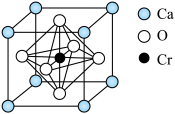
(7)铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。晶体的化学式为_______ ;与Cr最近的氧原子的个数为_______ ;Ca 和Cr的最近距离为a nm,设NA为阿伏加德常数的值,则该晶体密度为_______ (填含 a、NA的表达式)g· cm-3。

已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全,lg4=0.6)
| 离子 | Fe2+ | Fe3+ |
| Ksp | 8×10-16 | 4×0-38 |
(1)“研磨”的目的是
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为
(4)“浸渣1”的主要成分是
(5)“还原”中FeS2与Fe3+反应的离子方程式为
(6)“一系列操作”包括
(7)铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。晶体的化学式为

您最近一年使用:0次
名校
解题方法
3 . 锑白( )在工业上有广泛的用途,用于油漆的着色和帆布、纸张、涂料等的阻燃剂。从铅锑冶炼废渣(主要成分是
)在工业上有广泛的用途,用于油漆的着色和帆布、纸张、涂料等的阻燃剂。从铅锑冶炼废渣(主要成分是 、
、 ,含有CuO、
,含有CuO、 和
和 等杂质)中制取锑白的一种工业流程如图所示。
等杂质)中制取锑白的一种工业流程如图所示。
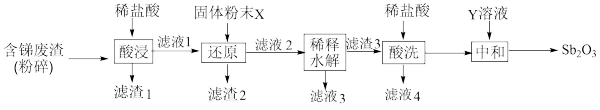
已知:① 是两性氧化物 ②“滤渣3”的成分是SbOCl
是两性氧化物 ②“滤渣3”的成分是SbOCl
回答下列问题:
(1)“固体粉末X”和“Y溶液”最好分别是_______ ;_______ 。
(2)将“含锑废渣”粉碎的目的是_______ 。
(3)“稀释水解”主要反应的离子反应方程式为_______ 。
(4)“酸洗”后检验沉淀是否洗净的试剂是_______ 。
(5)用平衡移动原理说明“中和”操作加入少量“Y溶液”操作的作用_______ 。
(6)在上述操作过程中多次用到过滤,该操作用到的玻璃仪器有_______ (至少写两种)。
 )在工业上有广泛的用途,用于油漆的着色和帆布、纸张、涂料等的阻燃剂。从铅锑冶炼废渣(主要成分是
)在工业上有广泛的用途,用于油漆的着色和帆布、纸张、涂料等的阻燃剂。从铅锑冶炼废渣(主要成分是 、
、 ,含有CuO、
,含有CuO、 和
和 等杂质)中制取锑白的一种工业流程如图所示。
等杂质)中制取锑白的一种工业流程如图所示。
已知:①
 是两性氧化物 ②“滤渣3”的成分是SbOCl
是两性氧化物 ②“滤渣3”的成分是SbOCl回答下列问题:
(1)“固体粉末X”和“Y溶液”最好分别是
(2)将“含锑废渣”粉碎的目的是
(3)“稀释水解”主要反应的离子反应方程式为
(4)“酸洗”后检验沉淀是否洗净的试剂是
(5)用平衡移动原理说明“中和”操作加入少量“Y溶液”操作的作用
(6)在上述操作过程中多次用到过滤,该操作用到的玻璃仪器有
您最近一年使用:0次
2023-05-06更新
|
553次组卷
|
2卷引用:辽宁省2023届高三第二次全省统考化学试题
4 . 氯化铁在工农业生产中有着广泛的应用,某化学小组在实验室进行有关 的实验探究。
的实验探究。
【查阅资料】 加热易升华,熔点为306℃,沸点为315℃,易溶于水,有强烈的吸水性,易潮解,在水溶液中
加热易升华,熔点为306℃,沸点为315℃,易溶于水,有强烈的吸水性,易潮解,在水溶液中 和
和 能发生络合反应:
能发生络合反应: 。
。
Ⅰ.用以下装置制取 晶体:
晶体:

(1)装浓盐酸的仪器名称是___________ 。
(2)装置接口的连接顺序为:a、___________ (填仪器接口的字母编号)。
Ⅱ.为探究 水解的影响因素,学习小组用pH传感器采集以下溶液的pH:
水解的影响因素,学习小组用pH传感器采集以下溶液的pH:
对照溶液的配制方法如下:在0.3mol/LKCl溶液中滴加盐酸,使其pH与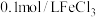 溶液pH一致,得X溶液,将X溶液稀释10倍,得Y溶液。
溶液pH一致,得X溶液,将X溶液稀释10倍,得Y溶液。
(3)实验②和③是为了探究___________ 对水解的影响,根据表格数据a___________ c(填“>”或“<”)等可说明稀释使 水解平衡正向移动。
水解平衡正向移动。
Ⅲ.为探究盐酸对 平衡的影响,将
平衡的影响,将 溶液(接近无色)和
溶液(接近无色)和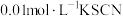 溶液等体积混合,得到红色溶液。取2mL红色溶液,滴加5滴
溶液等体积混合,得到红色溶液。取2mL红色溶液,滴加5滴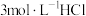 溶液,观察到现象Ⅲ:溶液颜色变浅,呈橙色。为探究原因,设计如下实验:
溶液,观察到现象Ⅲ:溶液颜色变浅,呈橙色。为探究原因,设计如下实验:
(4)实验⑥的目的是排除稀释使溶液颜色变化的干扰,则⑥中向2mL红色溶液中进行的操作是___________ 。
(5)根据实验⑤和实验①的结果,从平衡移动角度解释现象Ⅲ:___________
Ⅳ.可用碘量法测定无水氯化铁的质量分数:称取m克无水 样品,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;取出10mL,加入稍过量的KI溶液(
样品,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;取出10mL,加入稍过量的KI溶液( ),充分反应后,用
),充分反应后,用 的
的 溶液进行滴定(已知:
溶液进行滴定(已知: ),终点时消耗
),终点时消耗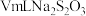 溶液。
溶液。
(6)该样品中氯化铁的质量分数为___________ (已知 ,用含c、V、m的代数式表示)。
,用含c、V、m的代数式表示)。
 的实验探究。
的实验探究。【查阅资料】
 加热易升华,熔点为306℃,沸点为315℃,易溶于水,有强烈的吸水性,易潮解,在水溶液中
加热易升华,熔点为306℃,沸点为315℃,易溶于水,有强烈的吸水性,易潮解,在水溶液中 和
和 能发生络合反应:
能发生络合反应: 。
。Ⅰ.用以下装置制取
 晶体:
晶体:
(1)装浓盐酸的仪器名称是
(2)装置接口的连接顺序为:a、
Ⅱ.为探究
 水解的影响因素,学习小组用pH传感器采集以下溶液的pH:
水解的影响因素,学习小组用pH传感器采集以下溶液的pH:| 编号 | 待测溶液/50mL | 溶液温度/℃ | pH |
| ① | 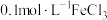 溶液 溶液 | 25 | 1.9 |
| ② |  溶液 溶液 | 25 | a |
| ③ |  溶液 溶液 | 35 | b |
| ④ | 对照溶液X | 25 | 1.9 |
| ⑤ | 对照溶液Y | 25 | c |
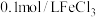 溶液pH一致,得X溶液,将X溶液稀释10倍,得Y溶液。
溶液pH一致,得X溶液,将X溶液稀释10倍,得Y溶液。(3)实验②和③是为了探究
 水解平衡正向移动。
水解平衡正向移动。Ⅲ.为探究盐酸对
 平衡的影响,将
平衡的影响,将 溶液(接近无色)和
溶液(接近无色)和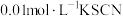 溶液等体积混合,得到红色溶液。取2mL红色溶液,滴加5滴
溶液等体积混合,得到红色溶液。取2mL红色溶液,滴加5滴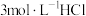 溶液,观察到现象Ⅲ:溶液颜色变浅,呈橙色。为探究原因,设计如下实验:
溶液,观察到现象Ⅲ:溶液颜色变浅,呈橙色。为探究原因,设计如下实验:| 编号 | 操作 | 现象 |
| ⑥ | 向2mL红色溶液中___________ | 溶液颜色无明显变化 |
| ⑦ | 向2mL红色溶液中滴加5滴 溶液 溶液 | 溶液颜色变浅,呈橙色 |
(5)根据实验⑤和实验①的结果,从平衡移动角度解释现象Ⅲ:
Ⅳ.可用碘量法测定无水氯化铁的质量分数:称取m克无水
 样品,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;取出10mL,加入稍过量的KI溶液(
样品,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;取出10mL,加入稍过量的KI溶液( ),充分反应后,用
),充分反应后,用 的
的 溶液进行滴定(已知:
溶液进行滴定(已知: ),终点时消耗
),终点时消耗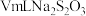 溶液。
溶液。(6)该样品中氯化铁的质量分数为
 ,用含c、V、m的代数式表示)。
,用含c、V、m的代数式表示)。
您最近一年使用:0次
5 . 以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2 (SO4)3为原料可以制备脱硫剂ZnFe2O4。该脱硫剂的制备硫化、再生过程可表示为
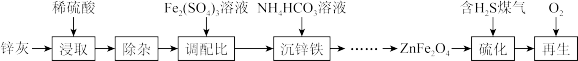
回答下列问题:
(1)“浸取”时为加快浸取速率,可以采取的措施有___________ (任写一条)。
(2)“除杂”包括加适量锌粉、过滤、加H2O2氧化等步骤。“加入H2O2氧化”的目的是___________ ,除Pb2+和Cu2+外,与锌粉反应的离子还有___________ (填离子符号)。
(3)“沉锌铁”时反应体系温度不能过高,可能的原因是___________ 。
(4)400 °C时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有脱硫剂ZnFe2O4的硫化反应器。
①硫化过程中,ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为___________ 。
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,但反应前后ZnS的质量不变, ZnS的作用是___________ ,生成COS的总反应化学方程式为___________ 。
(5)将硫化后的固体在V(N2) : V(O2) =95 : 5的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400 °C范围内,固体质量增加的主要原因可能是___________ 。


回答下列问题:
(1)“浸取”时为加快浸取速率,可以采取的措施有
(2)“除杂”包括加适量锌粉、过滤、加H2O2氧化等步骤。“加入H2O2氧化”的目的是
(3)“沉锌铁”时反应体系温度不能过高,可能的原因是
(4)400 °C时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有脱硫剂ZnFe2O4的硫化反应器。
①硫化过程中,ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,但反应前后ZnS的质量不变, ZnS的作用是
(5)将硫化后的固体在V(N2) : V(O2) =95 : 5的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400 °C范围内,固体质量增加的主要原因可能是

您最近一年使用:0次
6 . 超细碳酸锶是重要的无机化工产品。利用锶渣(主要成分SrSO4,含少量CaCO3、Fe2O3、Al2O3、MgCO3等杂质)制备超细碳酸锶的工艺如下:
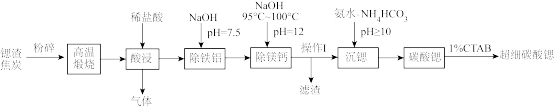
已知:①“高温煅烧”过程中发生的主要反应为:SrSO4+4C SrS+4CO↑
SrS+4CO↑
②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
回答下列问题:
(1)“粉碎”的目的是_______
(2)“酸浸”过程中主要反应的化学方程式为_______
(3)“除铁铝”过程中温度控制在75℃左右,适宜的加热方式为_______
(4)“操作I”为_______
(5)①写出“沉锶”的离子方程式_______
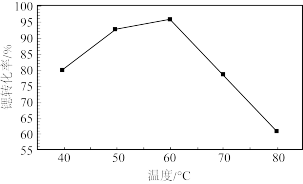
②反应温度对锶转化率的影响如图,温度高于60℃时,“锶转化率”降低的原因为_______ 。
③从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因_______ 。

已知:①“高温煅烧”过程中发生的主要反应为:SrSO4+4C
 SrS+4CO↑
SrS+4CO↑②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
| 氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | 0.07 |
| 氢氧化锶 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 | 91.20 |
回答下列问题:
(1)“粉碎”的目的是
(2)“酸浸”过程中主要反应的化学方程式为
(3)“除铁铝”过程中温度控制在75℃左右,适宜的加热方式为
(4)“操作I”为
(5)①写出“沉锶”的离子方程式
②反应温度对锶转化率的影响如图,温度高于60℃时,“锶转化率”降低的原因为

③从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因
您最近一年使用:0次
2022-04-11更新
|
379次组卷
|
2卷引用:安徽省马鞍山市2022届高三第二次教学质量检测理综化学试题
名校
解题方法
7 . 钛白粉(纳米级)广泛应用于功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料。是白色颜料中着色力最强的一种,具有优良的遮盖力和着色牢度,适用于不透明的白色制品。制备原料钛铁矿( )中往往含有
)中往往含有 、
、 、
、 、
、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )生产工艺如下:
)生产工艺如下:
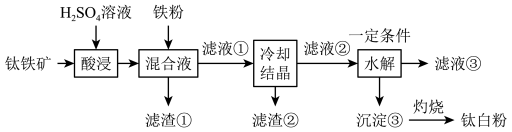
已知:①酸浸后,钛主要以 形式存在;
形式存在;
②强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。
③ 不溶于水和稀酸。
不溶于水和稀酸。
(1)要提高酸浸速率,可采取的措施是___________ (写出一条即可)。
(2)滤渣①中除铁粉外,还可能含有的成分是___________ 。
(3)酸浸过程中, 发生反应的离子方程式
发生反应的离子方程式___________ 。
(4)加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。
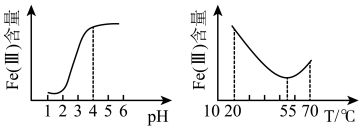
①在其它条件不变的情况下,体系中 (Ⅲ)[指
(Ⅲ)[指 和
和 等含正三价铁元素的微粒]含量随
等含正三价铁元素的微粒]含量随 变化如图1,试分析,在
变化如图1,试分析,在 介于4~6之间时,
介于4~6之间时, (Ⅲ)主要以
(Ⅲ)主要以___________ (填微粒化学式)形式存在。
②保持其它条件不变,体系中 (Ⅲ)含量随温度变化如图2,请从化学平衡原理角度分析,55℃后,
(Ⅲ)含量随温度变化如图2,请从化学平衡原理角度分析,55℃后, (Ⅲ)含量增大的原因是
(Ⅲ)含量增大的原因是___________ 。
(5)“水解”过程中得到的沉淀③的化学式为___________ 。
 )中往往含有
)中往往含有 、
、 、
、 、
、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )生产工艺如下:
)生产工艺如下:
已知:①酸浸后,钛主要以
 形式存在;
形式存在;②强电解质
 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。③
 不溶于水和稀酸。
不溶于水和稀酸。(1)要提高酸浸速率,可采取的措施是
(2)滤渣①中除铁粉外,还可能含有的成分是
(3)酸浸过程中,
 发生反应的离子方程式
发生反应的离子方程式(4)加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。①在其它条件不变的情况下,体系中
 (Ⅲ)[指
(Ⅲ)[指 和
和 等含正三价铁元素的微粒]含量随
等含正三价铁元素的微粒]含量随 变化如图1,试分析,在
变化如图1,试分析,在 介于4~6之间时,
介于4~6之间时, (Ⅲ)主要以
(Ⅲ)主要以②保持其它条件不变,体系中
 (Ⅲ)含量随温度变化如图2,请从化学平衡原理角度分析,55℃后,
(Ⅲ)含量随温度变化如图2,请从化学平衡原理角度分析,55℃后, (Ⅲ)含量增大的原因是
(Ⅲ)含量增大的原因是
(5)“水解”过程中得到的沉淀③的化学式为
您最近一年使用:0次
2022-01-21更新
|
460次组卷
|
4卷引用:湖南省长沙市2021-2022学年高三新高考适应性考试化学试题
名校
解题方法
8 . 以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料制备磷酸铁(FePO4)。
(1)酸浸。将一定量焙烧后的硫铁矿粉末加入到三颈瓶中,恒温50~60℃加热(装置见图1),通过滴液漏斗缓慢滴加一定浓度的稀硫酸,充分反应,过滤。温度不宜过高的原因是_____ 。

(2)还原。向滤液中加入FeS固体,充分搅拌至溶液中Fe3+全部被还原。检验Fe3+全部被还原的实验方法是_____ 。
(3)除铝。向还原后的溶液中加入FeO固体,不断搅拌,使Al3+完全转化为Al(OH)3,过滤,得FeSO4溶液。加入FeO后发生反应的离子方程式为_____ 。
(4)制备Na2HPO4。在搅拌下向100mL1mol·L-1H3PO4溶液中缓慢滴加1mol·L-1NaOH溶液,至溶液的pH约为10即可得到Na2HPO4溶液。需加入NaOH溶液的体积约为_____ 。
(5)制备FePO4。反应原理为Fe2(SO4)3+2Na2HPO4=2FePO4↓+2Na2SO4+H2SO4,纯净的FePO4为白色沉淀,不同pH对磷酸铁沉淀的影响如图2所示。为了得到较纯净的FePO4,请补充完整以除铝后的FeSO4溶液制备FePO4的实验方案:取一定量除铝后的FeSO4溶液,_____ ,固体干燥,得到FePO4。
(可选用的试剂:1mol·L-1Na2HPO4溶液、3%H2O2溶液、BaCl2溶液)

(1)酸浸。将一定量焙烧后的硫铁矿粉末加入到三颈瓶中,恒温50~60℃加热(装置见图1),通过滴液漏斗缓慢滴加一定浓度的稀硫酸,充分反应,过滤。温度不宜过高的原因是

(2)还原。向滤液中加入FeS固体,充分搅拌至溶液中Fe3+全部被还原。检验Fe3+全部被还原的实验方法是
(3)除铝。向还原后的溶液中加入FeO固体,不断搅拌,使Al3+完全转化为Al(OH)3,过滤,得FeSO4溶液。加入FeO后发生反应的离子方程式为
(4)制备Na2HPO4。在搅拌下向100mL1mol·L-1H3PO4溶液中缓慢滴加1mol·L-1NaOH溶液,至溶液的pH约为10即可得到Na2HPO4溶液。需加入NaOH溶液的体积约为
(5)制备FePO4。反应原理为Fe2(SO4)3+2Na2HPO4=2FePO4↓+2Na2SO4+H2SO4,纯净的FePO4为白色沉淀,不同pH对磷酸铁沉淀的影响如图2所示。为了得到较纯净的FePO4,请补充完整以除铝后的FeSO4溶液制备FePO4的实验方案:取一定量除铝后的FeSO4溶液,
(可选用的试剂:1mol·L-1Na2HPO4溶液、3%H2O2溶液、BaCl2溶液)

您最近一年使用:0次
2022-01-20更新
|
645次组卷
|
5卷引用:江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题
解题方法
9 . 镉可用于制造体积小和电容量大的电池,可利用铜镉渣[主要成分为镉,还含有少量锌、铜、铁、钴( )等杂质]来制备,工艺流程如图1。
)等杂质]来制备,工艺流程如图1。
回答下列问题:
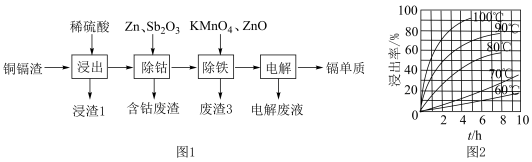
(1)酸浸中,镉的浸出率结果如图2所示。由图2可知,当镉的浸出率为80%时,所采用的实验条件为__ 。
(2)滤渣1是____ (填名称),滤渣3的主要成分是____ (填化学式)和 。
。
(3)除钴过程中,含 的浸出液中需要加入
的浸出液中需要加入 、
、 产生合金
产生合金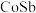 ,该反应的离子方程式为
,该反应的离子方程式为__ ,若设计成原电池,则锌在____ 极发生反应。
(4)除铁时先加入适量的 溶液,其目的是
溶液,其目的是____ ;再加入 ,调节溶液的
,调节溶液的 至
至____ 。
相关金属离子[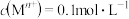 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表。
范围如表。
(5)已知室温下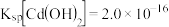 。若采用生石灰处理含镉电解废液,当测得室温下溶液的
。若采用生石灰处理含镉电解废液,当测得室温下溶液的 为10时,溶液中的
为10时,溶液中的 浓度是
浓度是____ 。
 )等杂质]来制备,工艺流程如图1。
)等杂质]来制备,工艺流程如图1。
回答下列问题:
(1)酸浸中,镉的浸出率结果如图2所示。由图2可知,当镉的浸出率为80%时,所采用的实验条件为
(2)滤渣1是
 。
。(3)除钴过程中,含
 的浸出液中需要加入
的浸出液中需要加入 、
、 产生合金
产生合金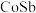 ,该反应的离子方程式为
,该反应的离子方程式为(4)除铁时先加入适量的
 溶液,其目的是
溶液,其目的是 ,调节溶液的
,调节溶液的 至
至相关金属离子[
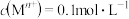 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表。
范围如表。| 金属离子 |  |  |  |
开始沉淀的 | 1.5 | 6.3 | 7.2 |
沉淀完全的 | 2.8 | 8.3 | 9.5 |
 。若采用生石灰处理含镉电解废液,当测得室温下溶液的
。若采用生石灰处理含镉电解废液,当测得室温下溶液的 为10时,溶液中的
为10时,溶液中的 浓度是
浓度是
您最近一年使用:0次
名校
解题方法
10 . 在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
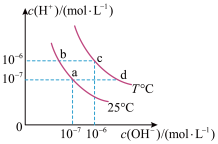

| A.向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) |
| B.25℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化 |
| C.T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显酸性 |
D.b点对应的溶液中大量存在:K+、Ba2+、 、I- 、I- |
您最近一年使用:0次



