1 . 盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
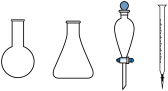
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示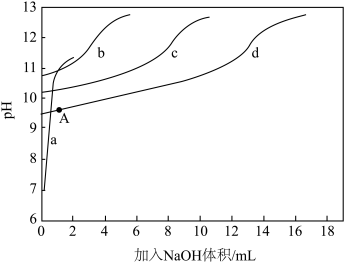
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
您最近半年使用:0次
名校
解题方法
2 . R是一种亲氯有机物,属于非电解质,易溶于水,在含Cl-的溶液中能发生如下反应。
反应I: R(aq)+Cl-(aq) RCl-(aq)
RCl-(aq)
反应II:RCl-(aq)+Cl-(aq) RCl
RCl (aq)
(aq)
回答下列问题:
(1)R的分子结构可表示为M-COOH,M为有机分子部分结构。补充完整方程式__________
R+CH3CH2OH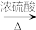 H2O +___________。
H2O +___________。
(2)常温下,向NaCl溶液中加入R,15s末测得c(RC1-)=0.07mol/L,c(RCl )=0.04mol/L。
)=0.04mol/L。
①0~15s内,Cl-的平均消耗速率v(C1-)=___________ 。
②待反应充分进行,达到平衡状态时溶液的体积为V0,加蒸馏水稀释至溶液体积为V,达到新平衡时,Cl-的物质的量浓度为c平(Cl-),RCl 的物质的量浓度为c平(RCl
的物质的量浓度为c平(RCl )。写出反应I平衡常数的表达式KI=
)。写出反应I平衡常数的表达式KI=___________ ,稀释过程中平衡常数KI的值___________ (填“变大”、“变小”或“不变”),请在答题卡坐标内 画出 随1g
随1g 的变化趋势曲线
的变化趋势曲线___________ 。
(3)室温下,向Cl-初始浓度c0(Cl-)=amol/L的NaCl溶液中加入不同量的R,用数据传感器测得平衡时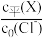 (X表示Cl-、RCl-,RCl
(X表示Cl-、RCl-,RCl 随
随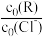 变化的数据,记录如表所示(b和d代表数字,忽略溶液体积变化):
变化的数据,记录如表所示(b和d代表数字,忽略溶液体积变化):
①从表格中数据可看出关系式: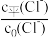 +
+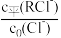 +2×
+2×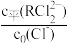 =1,则d=
=1,则d=___________ ;此关系式也可从理论上推导,下列理论依据中,可推导该关系式的有___________ (填选项序号)。
A.能量守恒定律 B.电荷守恒定律 C.质量守恒定律
D.氧化还原反应遵循还原剂失去的电子总数和氧化剂得到的电子总数相等的规律
②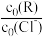 =0.50时,R的转化率为
=0.50时,R的转化率为___________ 。
反应I: R(aq)+Cl-(aq)
 RCl-(aq)
RCl-(aq)反应II:RCl-(aq)+Cl-(aq)
 RCl
RCl (aq)
(aq)回答下列问题:
(1)R的分子结构可表示为M-COOH,M为有机分子部分结构。补充完整方程式
R+CH3CH2OH
 H2O +___________。
H2O +___________。(2)常温下,向NaCl溶液中加入R,15s末测得c(RC1-)=0.07mol/L,c(RCl
 )=0.04mol/L。
)=0.04mol/L。①0~15s内,Cl-的平均消耗速率v(C1-)=
②待反应充分进行,达到平衡状态时溶液的体积为V0,加蒸馏水稀释至溶液体积为V,达到新平衡时,Cl-的物质的量浓度为c平(Cl-),RCl
 的物质的量浓度为c平(RCl
的物质的量浓度为c平(RCl )。写出反应I平衡常数的表达式KI=
)。写出反应I平衡常数的表达式KI= 随1g
随1g 的变化趋势曲线
的变化趋势曲线(3)室温下,向Cl-初始浓度c0(Cl-)=amol/L的NaCl溶液中加入不同量的R,用数据传感器测得平衡时
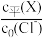 (X表示Cl-、RCl-,RCl
(X表示Cl-、RCl-,RCl 随
随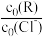 变化的数据,记录如表所示(b和d代表数字,忽略溶液体积变化):
变化的数据,记录如表所示(b和d代表数字,忽略溶液体积变化):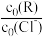 | 0 | 0.25 | 0.50 | 0.75 | 1.00 | |
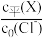 | Cl- | 1.00 | 0.79 | 0.64 | 0.54 | 0.46 |
| RCl- | 0 | 0.09 | 0.16 | 0.22 | 0.28 | |
| RCl22- | 0 | 0.06 | b | d | 0.13 | |
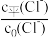 +
+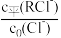 +2×
+2×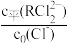 =1,则d=
=1,则d=A.能量守恒定律 B.电荷守恒定律 C.质量守恒定律
D.氧化还原反应遵循还原剂失去的电子总数和氧化剂得到的电子总数相等的规律
②
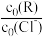 =0.50时,R的转化率为
=0.50时,R的转化率为
您最近半年使用:0次
名校
3 . 25℃时,用浓度均为0.1mol·L-1的NaOH 溶液和盐酸分别滴定体积均为20mL,浓度均为0.1mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是
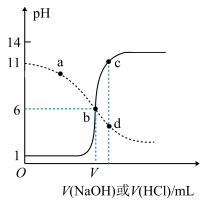

| A.HA为弱酸,BOH为强碱 |
| B.a点时,溶液中粒子浓度存在关系:c(B+)>c(Cl-)>c(OH-)>c(BOH) |
| C.b点时两种溶液中水的电离程度相同,且V=20 |
| D.c、d两点溶液混合后微粒之间存在关系:c(H+)= c(OH-)+c(BOH) |
您最近半年使用:0次
名校
解题方法
4 . 将Cl2缓慢通入1L0.1mol·L-1Na2CO3溶液中,反应过程中无CO2逸出,用数字传感器测得溶液中pH与c(HClO)的变化如图所示。已知Ka1(H2CO3)=10-6.3,Ka2(H2CO3)=10-10.3。下列说法错误的是

| A.曲线①表示溶液中pH的变化 |
| B.整个过程中,水的电离程度逐渐减小 |
C.a点溶液中:c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
D.pH=10.3时:c(Na+)>3c( )+2c(ClO-)+c(HClO) )+2c(ClO-)+c(HClO) |
您最近半年使用:0次
2023-04-06更新
|
1301次组卷
|
2卷引用:广东省汕头市金山中学2023届高三下学期一模化学试题
5 . 难溶盐 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中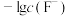 或
或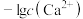 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中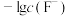 或
或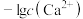 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.M代表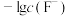 与 与 的变化曲线 的变化曲线 |
B.难溶盐 的溶度积常数 的溶度积常数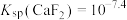 |
C.Y点的溶液中存在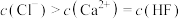 |
D.Z点的溶液中存在 |
您最近半年使用:0次
2023-02-18更新
|
1928次组卷
|
9卷引用:广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题
广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题湖南省百校2023届高三开年摸底联考化学试题浙江省杭州学军中学2022-2023学年高三下学期阶段性测试化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)先机卷 04 -【热题狂飙】2023年高考化学样卷(全国卷专用)山东省蒙阴第一中学等5校2023届高三开学摸底联考化学试题四川省绵阳市南山中学实验学校2022-2023学年高三下学期3月月考理科综合化学试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)选择题11-15
22-23高二上·重庆沙坪坝·期中
6 . 均苯三甲酸是一种重要的有机三元弱酸,可表示为 。向
。向 的
的 溶液中加入
溶液中加入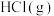 或
或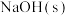 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:
已知:①[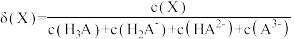 ,X为
,X为 、
、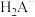 、
、 或
或 ]
]
②(
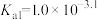 、
、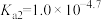 、
、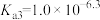 )
)
 。向
。向 的
的 溶液中加入
溶液中加入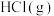 或
或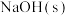 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:已知:①[
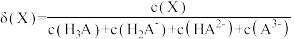 ,X为
,X为 、
、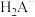 、
、 或
或 ]
]②(

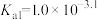 、
、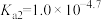 、
、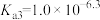 )
)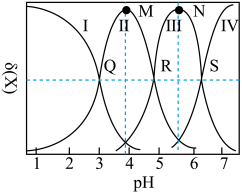
A.若用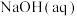 滴定 滴定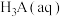 至恰好生成 至恰好生成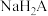 ,可选甲基橙做指示剂 ,可选甲基橙做指示剂 |
B.N点的 |
C.常温下,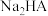 的水解常数 的水解常数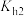 的数量级为 的数量级为 |
D.R点满足: |
您最近半年使用:0次
2022-11-25更新
|
1534次组卷
|
6卷引用:广东省深圳市2022-2023学年高三第一次调研考试变式题(选择题1-16)
名校
解题方法
7 . 氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获利缓释肥料磷酸镁铵( ),过程如下。
),过程如下。
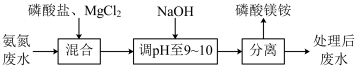
资料:
i.氧氮废水中氮元素主要以 形式存在;
形式存在;
ii. 、
、 ,难溶于水;
,难溶于水;
iii.当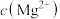 和
和 为1
为1 时,生成
时,生成 沉淀所需的
沉淀所需的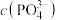 约为
约为 ,生成
,生成 沉淀所需的
沉淀所需的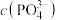 约为
约为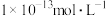 。
。
(1)检验溶液中 的操作是
的操作是_______ 。
(2)经处理后,分离磷酸镁铵所用的方法是_______ 。
(3)磷酸盐若选择 混合后会产生大量
混合后会产生大量 沉淀,反应的离子方程式为,氨氮去除率将
沉淀,反应的离子方程式为,氨氮去除率将_______ (填“提高”“降低”或“不变”)。
(4)含磷微粒的物质的量分数与pH的关系如下图所示。
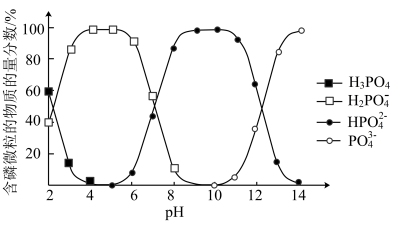
下列说法正确的是_______ (填序号)。
a. 溶液呈酸性
溶液呈酸性
b. 和
和 溶液中,微粒的种类相同
溶液中,微粒的种类相同
c.等浓度的 和
和 溶液中,
溶液中, 相等
相等
(5)处理氨氮废水时,磷酸盐可选用 。
。
①pH在9~10之间,主要生成 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为_______ 。
②pH过大会降低废水中氨氮的去除率,可能的原因是_______ 。
③对于 较低的氨氮废水,上述磷酸铵镁沉淀法的处理效果不佳,且无法通过地加
较低的氨氮废水,上述磷酸铵镁沉淀法的处理效果不佳,且无法通过地加 和
和 的用量来改善,原因是
的用量来改善,原因是_______ 。
 ),过程如下。
),过程如下。
资料:
i.氧氮废水中氮元素主要以
 形式存在;
形式存在;ii.
 、
、 ,难溶于水;
,难溶于水;iii.当
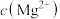 和
和 为1
为1 时,生成
时,生成 沉淀所需的
沉淀所需的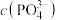 约为
约为 ,生成
,生成 沉淀所需的
沉淀所需的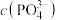 约为
约为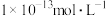 。
。(1)检验溶液中
 的操作是
的操作是(2)经处理后,分离磷酸镁铵所用的方法是
(3)磷酸盐若选择
 混合后会产生大量
混合后会产生大量 沉淀,反应的离子方程式为,氨氮去除率将
沉淀,反应的离子方程式为,氨氮去除率将(4)含磷微粒的物质的量分数与pH的关系如下图所示。

下列说法正确的是
a.
 溶液呈酸性
溶液呈酸性b.
 和
和 溶液中,微粒的种类相同
溶液中,微粒的种类相同c.等浓度的
 和
和 溶液中,
溶液中, 相等
相等(5)处理氨氮废水时,磷酸盐可选用
 。
。①pH在9~10之间,主要生成
 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为②pH过大会降低废水中氨氮的去除率,可能的原因是
③对于
 较低的氨氮废水,上述磷酸铵镁沉淀法的处理效果不佳,且无法通过地加
较低的氨氮废水,上述磷酸铵镁沉淀法的处理效果不佳,且无法通过地加 和
和 的用量来改善,原因是
的用量来改善,原因是
您最近半年使用:0次
2022-09-01更新
|
680次组卷
|
4卷引用:广东省华南师范大学附属中学2022届高三下学期押题预测(一)化学试题
名校
8 . 常温下,将 溶液滴加到20mL
溶液滴加到20mL 二元弱酸
二元弱酸 溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是
溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是
 溶液滴加到20mL
溶液滴加到20mL 二元弱酸
二元弱酸 溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是
溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是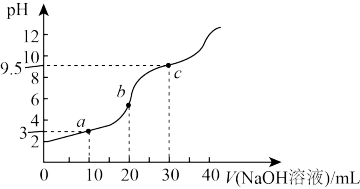
A.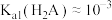 |
B.b点时溶液中存在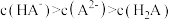 |
C.c点时溶液中存在 |
| D.溶液中水的电离程度:c>b>a |
您最近半年使用:0次
2022-08-28更新
|
2443次组卷
|
8卷引用:广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题
广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题广东省珠海市第一中学2022-2023学年高三上学期11月份阶段考试化学试题(已下线)化学(广东B卷)-学易金卷:2023年高考第一次模拟考试卷广东省深圳市福田区福田中学2023-2024学年高三上学期12月月考化学考试湖南省湘潭凤凰中学2022-2023学年高二上学期10月月考化学试题(已下线)易错点25 盐类水解-备战2023年高考化学考试易错题(已下线)2022年河北省高考真题变式题(1-9)江西省南昌市第十九中学2022-2023学年高三上学期(10月)第三次月考化学试卷
9 . 常温下,向一定浓度的NaA溶液中加适量强酸或强碱(忽略溶液体积变化),溶液中 、
、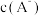 、
、 、
、 的负对数
的负对数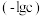 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是

 、
、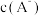 、
、 、
、 的负对数
的负对数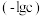 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是
A.曲线①表示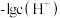 随溶液pH的变化情况 随溶液pH的变化情况 |
B.曲线①和曲线②的交点对应的溶液中存在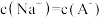 |
C.常温下,将A点对应溶液加水稀释,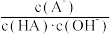 不变 不变 |
D.等物质的量浓度、等体积的NaA溶液与HA溶液混合后: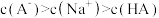 |
您最近半年使用:0次
2022-03-31更新
|
2736次组卷
|
6卷引用:广东省2021-2022学年高三下学期一模化学试题
广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)(已下线)必刷卷02-2022年高考化学考前信息必刷卷(全国甲卷)湖北省2022届高三5月联考化学试题(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题
名校
解题方法
10 . 若用AG表示溶液的酸度,AG 的定义为 ,室温下实验室中用0.01 mol.L-1 的氢氧化钠溶液滴定20.00 mL 0.01 mol.L-1 醋酸,滴定过程如图所示,下列叙述正确的是
,室温下实验室中用0.01 mol.L-1 的氢氧化钠溶液滴定20.00 mL 0.01 mol.L-1 醋酸,滴定过程如图所示,下列叙述正确的是
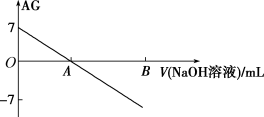
 ,室温下实验室中用0.01 mol.L-1 的氢氧化钠溶液滴定20.00 mL 0.01 mol.L-1 醋酸,滴定过程如图所示,下列叙述正确的是
,室温下实验室中用0.01 mol.L-1 的氢氧化钠溶液滴定20.00 mL 0.01 mol.L-1 醋酸,滴定过程如图所示,下列叙述正确的是
| A.室温下,醋酸的电离常数约为10-5 |
| B.A点时加入氢氧化钠溶液的体积为20.00mL |
| C.若B点为40 mL,所得溶液中:2c(Na+)=c(CH3COO-)+c(CH3COOH) |
| D.滴定过程中一定存在:0.01 mol/L+c(OH-)=c(Na+)+c(H+)+c(CH3COOH) |
您最近半年使用:0次
2020-12-29更新
|
1290次组卷
|
2卷引用:广东省广州市执信中学(广雅,执信,二中联考)2019-2020学年高二上学期期末考试化学试题



