名校
1 . 已知联氨( )为二元弱碱,常温下联氨的水溶液中有:
)为二元弱碱,常温下联氨的水溶液中有: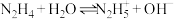
 ;
;
 。常温下向10mL
。常温下向10mL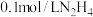 的水溶液中滴加0.1mol/L盐酸溶液,混合溶液中微粒的物质的量分数
的水溶液中滴加0.1mol/L盐酸溶液,混合溶液中微粒的物质的量分数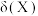 随
随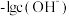 变化的关系如下图所示下列叙述正确的是
变化的关系如下图所示下列叙述正确的是
 )为二元弱碱,常温下联氨的水溶液中有:
)为二元弱碱,常温下联氨的水溶液中有: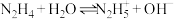
 ;
;
 。常温下向10mL
。常温下向10mL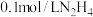 的水溶液中滴加0.1mol/L盐酸溶液,混合溶液中微粒的物质的量分数
的水溶液中滴加0.1mol/L盐酸溶液,混合溶液中微粒的物质的量分数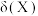 随
随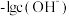 变化的关系如下图所示下列叙述正确的是
变化的关系如下图所示下列叙述正确的是
A.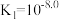 |
| B.常温下滴加5mL盐酸溶液时,混合溶液pH=8 |
C.混合溶液中 时,滴加盐酸溶液体积小于10mL 时,滴加盐酸溶液体积小于10mL |
D.常温下,当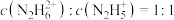 时,溶液中 时,溶液中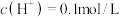 |
您最近一年使用:0次
2022-02-05更新
|
501次组卷
|
4卷引用:广东省华南师范大学附属中学2022届高三下学期押题预测(三)化学试题
2 . 草酸(H2C2O4)及其化合物在医药、印染、塑料等方面扮演着重要角色,同时广泛应用于化学实验中。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁( )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:
Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量 溶液,使其充分反应。
溶液,使其充分反应。
Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用___________ (填“酸式”或“碱式”)滴定管盛装,达到滴定终点的现象是___________ 。
②下列关于实验误差的说法正确的是___________ (填标号)。
A.步骤Ⅰ中,若加入的 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高
B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的 含量偏低
含量偏低
C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的 含量偏低
含量偏低
D.步骤Ⅱ中,过滤时间过长,可能导致测得的 含量偏低
含量偏低
③0.50g该样品中 的质量分数为
的质量分数为___________ (不考虑损耗)。
(2)常温下,改变0.1mol/L的 溶液的pH,溶液中
溶液的pH,溶液中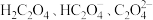 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
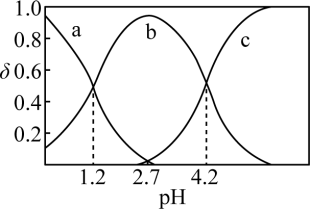
①曲线___________ (填“a”、“b”或“c”)代表 ,
, 时,溶液中
时,溶液中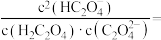
___________ 。
②pH从1.2增大至4.2的过程中,水的电离程度___________ (填“增大”、“减小”或“不变”)。
③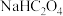 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为___________ 。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁(
 )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量
 溶液,使其充分反应。
溶液,使其充分反应。Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用
②下列关于实验误差的说法正确的是
A.步骤Ⅰ中,若加入的
 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的
 含量偏低
含量偏低C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的
 含量偏低
含量偏低D.步骤Ⅱ中,过滤时间过长,可能导致测得的
 含量偏低
含量偏低③0.50g该样品中
 的质量分数为
的质量分数为(2)常温下,改变0.1mol/L的
 溶液的pH,溶液中
溶液的pH,溶液中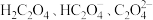 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
①曲线
 ,
, 时,溶液中
时,溶液中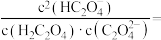
②pH从1.2增大至4.2的过程中,水的电离程度
③
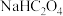 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为
您最近一年使用:0次
2022-01-21更新
|
129次组卷
|
3卷引用:广东省湛江市2021-2022学年高二上学期期末调研考试化学试题
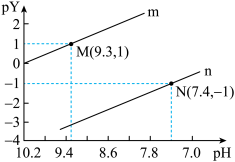
3 . 常温下,向二元弱酸H2A溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列说法错误的是
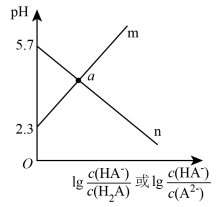

A.曲线n表示pH与lg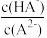 |
| B.Ka1(H2A)=10-2.3 |
| C.交点a的溶液中:c(H2A)>c(A2-) |
| D.NaHA溶液中:c(HA-)>c(A2-)>c(H2A) |
您最近一年使用:0次
2021-09-18更新
|
754次组卷
|
8卷引用:广东省清远市第一中学2021-2022学年高二上学期期中调研考试化学试题
4 . 氮及其化合物在生产、生活与环境中有着重要研究和应用价值。根据要求回答问题:
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=_______ kJ·mol-1
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)_______ (填“增大”、“不变”或“减小”)
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=_______ mol/(L·s)
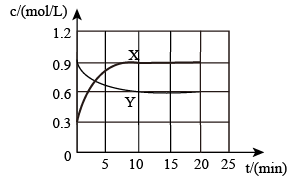
③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)=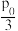 ,则该温度下该反应平衡转化率α(N2O4)=
,则该温度下该反应平衡转化率α(N2O4)=_______ ,保持温度不变,再向密闭容器中充入nmolN2O4,维持总压强为2p0,则在该温度下该反应的压强平衡常数(Kp)=_______ (用各气体物质的分压代替浓度的平衡常数叫压强平衡常数(Kp)。分压=总压×物质的量分数)
(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
①pH=9时溶液中c(N )
)_______ c(R+)(填“>”、“=”或“<”),pH=a时溶液中c(HN3)_______ c(N )(填“大于”“等于”或“小于”)
)(填“大于”“等于”或“小于”)
②HN3的Ka=_______ (精确值)
(4)N2O5是一种新型硝化剂。其制备装置如图所示。
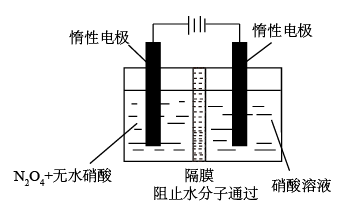
透过隔膜的粒子是_______ ,制取N2O5的电极反应式为_______
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=

③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)=
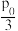 ,则该温度下该反应平衡转化率α(N2O4)=
,则该温度下该反应平衡转化率α(N2O4)=(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
| V(HN3)/mL | 0 | 12.50 | 12.75 | 25.00 |
| pH | 13 | 9 | 7 | a |
 )
) )(填“大于”“等于”或“小于”)
)(填“大于”“等于”或“小于”)②HN3的Ka=
(4)N2O5是一种新型硝化剂。其制备装置如图所示。

透过隔膜的粒子是
您最近一年使用:0次
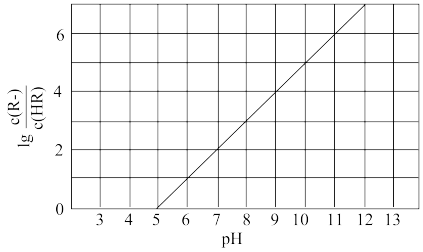
5 . 常温下,向1L0.1mol·L-1—酸HR溶液中缓慢通氨气[已知常温下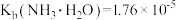 ],假设溶液温度和体积保持不变,混合溶液的pH与
],假设溶液温度和体积保持不变,混合溶液的pH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
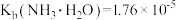 ],假设溶液温度和体积保持不变,混合溶液的pH与
],假设溶液温度和体积保持不变,混合溶液的pH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
A. 的HR溶液的pH约为3 的HR溶液的pH约为3 |
B.HR为弱酸,常温时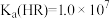 |
C.当通入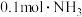 时,溶液中 时,溶液中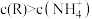 |
D.当溶液呈中性时,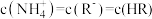 |
您最近一年使用:0次
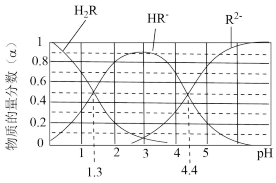
6 . 已知:常温下,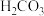 的
的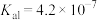 ,
,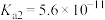 ;某二元酸
;某二元酸 及其钠盐的溶液中,
及其钠盐的溶液中, 、
、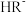 、
、 分别所占的物质的量分数(α)随溶液pH变化关系如图所示。下列叙述错误的是
分别所占的物质的量分数(α)随溶液pH变化关系如图所示。下列叙述错误的是
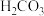 的
的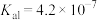 ,
,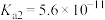 ;某二元酸
;某二元酸 及其钠盐的溶液中,
及其钠盐的溶液中, 、
、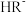 、
、 分别所占的物质的量分数(α)随溶液pH变化关系如图所示。下列叙述错误的是
分别所占的物质的量分数(α)随溶液pH变化关系如图所示。下列叙述错误的是
A.在 的溶液中: 的溶液中: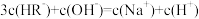 |
| B.等体积等浓度的NaOH溶液与H2R溶液混合,所得溶液中水的电离程度比纯水小 |
C.向 溶液中加入少量H2R溶液,发生反应: 溶液中加入少量H2R溶液,发生反应: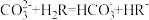 |
D.在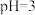 的溶液中,三种微粒的浓度满足关系: 的溶液中,三种微粒的浓度满足关系: |
您最近一年使用:0次
名校
解题方法
7 . 室温下,改变 邻苯二甲酸氢钾(KHA)溶液的pH,溶液中
邻苯二甲酸氢钾(KHA)溶液的pH,溶液中 、
、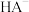 、
、 的物质的量分数
的物质的量分数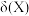 随pH的变化如图所示。下列叙述错误的是[已知
随pH的变化如图所示。下列叙述错误的是[已知 ]
]

 邻苯二甲酸氢钾(KHA)溶液的pH,溶液中
邻苯二甲酸氢钾(KHA)溶液的pH,溶液中 、
、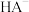 、
、 的物质的量分数
的物质的量分数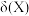 随pH的变化如图所示。下列叙述错误的是[已知
随pH的变化如图所示。下列叙述错误的是[已知 ]
]
A.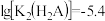 |
B. 时, 时,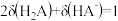 |
C.KHA溶液中: |
D. 时, 时,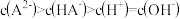 |
您最近一年使用:0次
2021-04-26更新
|
1157次组卷
|
4卷引用:广东省广州市2021届普通高中毕业班综合测试(二)化学试题
广东省广州市2021届普通高中毕业班综合测试(二)化学试题广东省广州市2021届高三下学期二模考试化学试题(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)辽宁省凤城市第一中学2023-2024学年高二上学期10月月考化学试题
8 . 焦磷酸盐(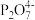 )常用于洗涤剂、软水剂和电镀工业,焦磷酸(H4P2O7)为两分子磷酸脱水而成的多元酸,不同型体的分布分数(δ)与pH的关系如图所示。下列说法正确的是
)常用于洗涤剂、软水剂和电镀工业,焦磷酸(H4P2O7)为两分子磷酸脱水而成的多元酸,不同型体的分布分数(δ)与pH的关系如图所示。下列说法正确的是

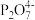 )常用于洗涤剂、软水剂和电镀工业,焦磷酸(H4P2O7)为两分子磷酸脱水而成的多元酸,不同型体的分布分数(δ)与pH的关系如图所示。下列说法正确的是
)常用于洗涤剂、软水剂和电镀工业,焦磷酸(H4P2O7)为两分子磷酸脱水而成的多元酸,不同型体的分布分数(δ)与pH的关系如图所示。下列说法正确的是
A.③代表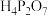 的分布分数曲线 的分布分数曲线 |
B.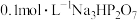 溶液中: 溶液中: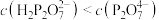 |
C.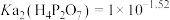 |
D.反应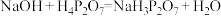 趋于完全 趋于完全 |
您最近一年使用:0次
名校
9 . 化学上常用AG表示溶液中的 。25℃时,用0.100
。25℃时,用0.100 的NaOH溶液滴定20.00mL 0.100
的NaOH溶液滴定20.00mL 0.100 HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
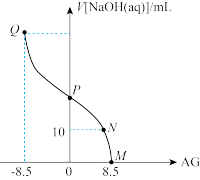
 。25℃时,用0.100
。25℃时,用0.100 的NaOH溶液滴定20.00mL 0.100
的NaOH溶液滴定20.00mL 0.100 HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
A.Q点时,溶液中 为 为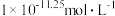 |
B.N点时, |
| C.P点时,加入NaOH溶液的体积为20.00mL |
D.25℃时,HNO2的电离常数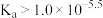 |
您最近一年使用:0次
2021-03-26更新
|
569次组卷
|
3卷引用:广东省汕头市金山中学2020-2021学年高二下学期期中考试化学试题
名校
10 . 常温下,向一定浓度的Na2R溶液中滴入稀硫酸,粒子浓度与混合溶液pH的变化关系如下图所示。已知:H2R是二元弱酸,Y表示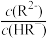 或
或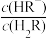 ,pY=-lg Y,题中涉及浓度的单位为mol•L-1。下列叙述错误的是
,pY=-lg Y,题中涉及浓度的单位为mol•L-1。下列叙述错误的是
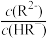 或
或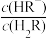 ,pY=-lg Y,题中涉及浓度的单位为mol•L-1。下列叙述错误的是
,pY=-lg Y,题中涉及浓度的单位为mol•L-1。下列叙述错误的是
A.曲线m表示p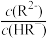 与混合溶液pH的变化关系 与混合溶液pH的变化关系 |
B.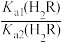 =103.9 =103.9 |
| C.NaHR溶液中存在:c(Na+)<c(HR-)+2c(R2-) |
D.滴加稀硫酸的过程中,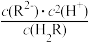 保持不变 保持不变 |
您最近一年使用:0次
2021-03-07更新
|
1806次组卷
|
11卷引用:2021年高考化学押题预测卷(广东卷)(02)
(已下线)2021年高考化学押题预测卷(广东卷)(02)重庆市强基联合体2021届高三下学期质量检测化学试题河南省鹤壁市高中2020-2021学年高二下学期第三次段考化学试题河南省洛阳市2021届高三5月第三次统一考试理综化学试题(已下线)【浙江新东方】高中化学20210621-010【2021】【高三下】(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)专题十三水溶液中的离子平衡(已下线)专题10 溶液中离子浓度的关系(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练



