名校
1 . 某小组同学实验验证“ ”为可逆反应。
”为可逆反应。
(1)实验验证
实验Ⅰ:将含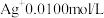 的溶液与
的溶液与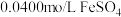 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。
)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入 溶液(
溶液( ),固体完全溶解。
),固体完全溶解。
①取Ⅰ中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:___________ 。
②Ⅱ中溶液选用 ,不选用
,不选用 的原因为
的原因为___________ 。
综合上述实验,证实“ ”为可逆反应。
”为可逆反应。
(2)采用电化学装置进行验证。
小组同学设计如图电化学装置进行实验:

①按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为___________ 溶液;b为___________ 溶液;(写a、b化学式)
②再向左侧烧杯中滴加较浓的___________ 溶液(填化学式),产生的现象为___________ ,表明“ ”为可逆反应。
”为可逆反应。
 ”为可逆反应。
”为可逆反应。(1)实验验证
实验Ⅰ:将含
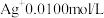 的溶液与
的溶液与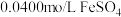 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。
)等体积混合,产生灰黑色沉淀,溶液呈黄色。实验Ⅱ:向少量Ag粉中加入
 溶液(
溶液( ),固体完全溶解。
),固体完全溶解。①取Ⅰ中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:
②Ⅱ中溶液选用
 ,不选用
,不选用 的原因为
的原因为综合上述实验,证实“
 ”为可逆反应。
”为可逆反应。(2)采用电化学装置进行验证。
小组同学设计如图电化学装置进行实验:

①按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为
②再向左侧烧杯中滴加较浓的
 ”为可逆反应。
”为可逆反应。
您最近半年使用:0次
名校
解题方法
2 . 砷及其化合物是实验研究热点物质。某小组开展对砷的化学物研究。
实验1:资料显示,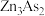 可与稀硫酸反应生成
可与稀硫酸反应生成 。设计如图装置探究
。设计如图装置探究 的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
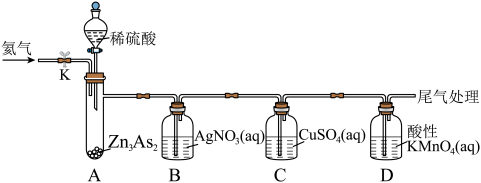
(1)A装置中盛装稀硫酸的仪器名称是___________ 。B装置中发生氧化还原反应,生成一种由过滤元素组成的黑色固体单质,该固体单质的化学式为___________ 。
(2)已知:C装置中反应生成砷化亚铜固体、一种常见的最高价含氧酸和一种固体单质,则该反应的化学方程式为___________ 。
(3)D装置中溶液由紫红色变为无色,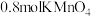 恰好氧化
恰好氧化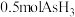 ,则氧化产物中砷元素的化合价为
,则氧化产物中砷元素的化合价为___________ 。
实验2:查阅资料发现, 和
和 的氧化性差异不大。推测在一定条件下
的氧化性差异不大。推测在一定条件下 和
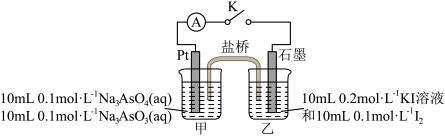
和 反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
(4)根据步骤Ⅲ中电流表读数 ,可以确定上述反应是可逆反应,则读数
,可以确定上述反应是可逆反应,则读数
___________ 0(填“>”或“<”)。请具体说明如何根据电流表读数 可判断此反应是可逆反应:
可判断此反应是可逆反应:___________ 。
(5)根据上述探究, 和
和 能否发生反应与
能否发生反应与___________ 有关(填序号)。
①浓度 ②温度 ③pH ④催化剂
向甲烧杯中滴加稀硫酸后,装置中发生的总反应的离子方程式为___________ 。
实验1:资料显示,
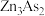 可与稀硫酸反应生成
可与稀硫酸反应生成 。设计如图装置探究
。设计如图装置探究 的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
(1)A装置中盛装稀硫酸的仪器名称是
(2)已知:C装置中反应生成砷化亚铜固体、一种常见的最高价含氧酸和一种固体单质,则该反应的化学方程式为
(3)D装置中溶液由紫红色变为无色,
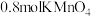 恰好氧化
恰好氧化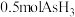 ,则氧化产物中砷元素的化合价为
,则氧化产物中砷元素的化合价为实验2:查阅资料发现,
 和
和 的氧化性差异不大。推测在一定条件下
的氧化性差异不大。推测在一定条件下 和
和 反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
| 序号 | 实验步骤 | 电流表读数(A) |
| Ⅰ | 按图2所示连接装置并加入药品,闭合开关K。向甲烧杯中滴加浓NaOH溶液,电流表指针偏转,乙烧杯中溶液颜色变浅,读出电流表读数为 |  |
| Ⅱ | 充分反应一段时间后,读出电流表读数为 | 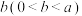 |
| Ⅲ | 当电流表读数为0时,向甲烧杯中缓缓加入稀硫酸,读出电流表读数为 |  |
 ,可以确定上述反应是可逆反应,则读数
,可以确定上述反应是可逆反应,则读数
 可判断此反应是可逆反应:
可判断此反应是可逆反应:(5)根据上述探究,
 和
和 能否发生反应与
能否发生反应与①浓度 ②温度 ③pH ④催化剂
向甲烧杯中滴加稀硫酸后,装置中发生的总反应的离子方程式为
您最近半年使用:0次
2023-10-09更新
|
122次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
解题方法
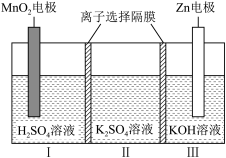
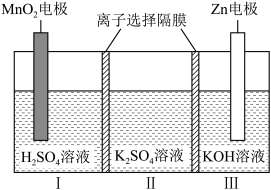
3 . 一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[已知:氧化能力:MnO2>H+;KOH溶液中,Zn2+以 存在]。电池放电时,下列叙述正确的是
存在]。电池放电时,下列叙述正确的是
 存在]。电池放电时,下列叙述正确的是
存在]。电池放电时,下列叙述正确的是
| A.Ⅰ区和Ⅱ区之间的离子选择隔膜为阳离子选择隔膜 |
B.Ⅱ区的 通过隔膜向Ⅰ区迁移 通过隔膜向Ⅰ区迁移 |
C.MnO2电极反应: |
D.电池总反应: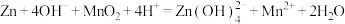 |
您最近半年使用:0次
4 . 亚硫酸氢钠在染料、造纸制革、化学合成等工业中可用作还原剂。
(一)制备NaHSO3(装置如图所示)。
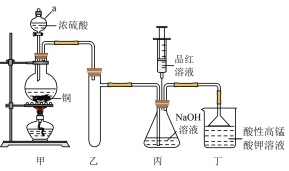
(1)装置丁的作用有①___________ ;②___________ ;③吸收尾气,防止环境污染。
(2)将丙中针筒内品红溶液推进锥形瓶中,若发现___________ ,则说明NaOH已完全转化为NaHSO3。
(二)小组同学欲探究NaHSO3与 的反应,经查阅资料后提出假设,并进行实验验证。
的反应,经查阅资料后提出假设,并进行实验验证。
已知:氯化亚铜(CuCl)是不溶于水的白色沉淀
假设1: 与
与 仅发生双水解反应
仅发生双水解反应
假设2: 可以还原
可以还原
设计实验如下:
①向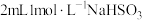 溶液中加入
溶液中加入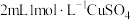 溶液,得到绿色溶液,放置一段时间无明显变化。
溶液,得到绿色溶液,放置一段时间无明显变化。
②向①所得绿色溶液中加入适量NaCl固体,开始无明显变化,30s后有无色气体和白色沉淀生成,同时上层溶液颜色变浅。
(3)实验证实假设___________ 合理,实验①发生的离子方程式为___________ 。
(4)甲、乙同学经查阅资料得知,两电极之间的电势差E越大,反应进行的程度越大,电势差 [其中
[其中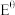 (标准电极电势)、R(气体常数)、T(温度)、F(法拉第常数)固定不变],为进一步验证上述结论,设计如下实验:
(标准电极电势)、R(气体常数)、T(温度)、F(法拉第常数)固定不变],为进一步验证上述结论,设计如下实验:
①根据上述实验结论,对比甲、乙两实验,写出乙同学实验现象为___________ (写出两条即可)。
②根据相关资料,解释产生上述现象的原因为___________ 。
(一)制备NaHSO3(装置如图所示)。

(1)装置丁的作用有①
(2)将丙中针筒内品红溶液推进锥形瓶中,若发现
(二)小组同学欲探究NaHSO3与
 的反应,经查阅资料后提出假设,并进行实验验证。
的反应,经查阅资料后提出假设,并进行实验验证。已知:氯化亚铜(CuCl)是不溶于水的白色沉淀
假设1:
 与
与 仅发生双水解反应
仅发生双水解反应假设2:
 可以还原
可以还原
设计实验如下:
①向
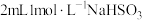 溶液中加入
溶液中加入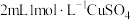 溶液,得到绿色溶液,放置一段时间无明显变化。
溶液,得到绿色溶液,放置一段时间无明显变化。②向①所得绿色溶液中加入适量NaCl固体,开始无明显变化,30s后有无色气体和白色沉淀生成,同时上层溶液颜色变浅。
(3)实验证实假设
(4)甲、乙同学经查阅资料得知,两电极之间的电势差E越大,反应进行的程度越大,电势差
 [其中
[其中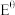 (标准电极电势)、R(气体常数)、T(温度)、F(法拉第常数)固定不变],为进一步验证上述结论,设计如下实验:
(标准电极电势)、R(气体常数)、T(温度)、F(法拉第常数)固定不变],为进一步验证上述结论,设计如下实验:| 编号 | 甲 | 乙 |
| 实验 |  |  |
②根据相关资料,解释产生上述现象的原因为
您最近半年使用:0次
名校
解题方法
5 . 一种水性电解液 离子选择双隔膜电池如图所示(
离子选择双隔膜电池如图所示( 溶液中,
溶液中, 以
以 存在)。电池放电时,下列叙述正确的是
存在)。电池放电时,下列叙述正确的是
 离子选择双隔膜电池如图所示(
离子选择双隔膜电池如图所示( 溶液中,
溶液中, 以
以 存在)。电池放电时,下列叙述正确的是
存在)。电池放电时,下列叙述正确的是
A.Ⅱ区的 通过隔膜向Ⅲ区迁移 通过隔膜向Ⅲ区迁移 |
B.电子由 电极经外电路流向Zn电极 电极经外电路流向Zn电极 |
C. 电极反应: 电极反应: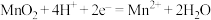 |
| D.Zn电极为负极,发生还原反应 |
您最近半年使用:0次
6 . 高电压水系锌﹣有机混合液流电池的装置如图所示。下列说法错误的是


| A.充电时,中性电解质NaCl的浓度增大 |
B.放电时,负极反应式为 |
| C.充电时,1molFQH2转化为FQ转移2mol电子 |
| D.放电时,正极区溶液的pH减小 |
您最近半年使用:0次
名校
7 . 汽车的启动电源常用铅酸蓄电池,该电池在放电时的总反应为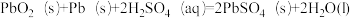 。
。
下列说法正确的是
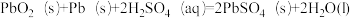 。
。
下列说法正确的是
| A.该铅酸蓄电池属于一次电池 |
B.负极的电极反应式为 |
| C.铅酸蓄电池放电时,每转移0.2mol电子消耗0.4molH2SO4 |
| D.电池放电时,两电极质量均增加,且每转移1mol电子,电池正极质量增加32g |
您最近半年使用:0次
8 . 下图是飞船和空间站中利用Sabatier反应再生氧气的大体流程。
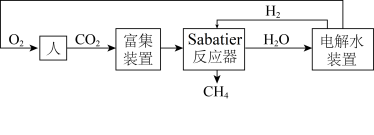
(1)已知:2H2(g)+O2(g) 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
则Sabatier反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=___________ 。
(2)二氧化碳的富集装置如图所示。
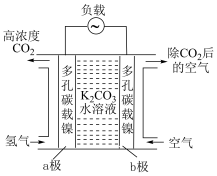
①该富集法采用___________ 原理(填“原电池”或“电解池”)。当a极上消耗1molH2,并保持电解液溶质不变时,b极上除去的CO2在标准状况下的体积为___________ 。
②工作一段时间后,K2CO3溶液的pH___________ (填“变大”“变小”或“不变”)。
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是___________ 。
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是___________ 。
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=___________ (用P0表示)。已知Kp是以分压表示的平衡常数,分压=总压×物质的量分数。
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为___________ (填化学式)。

(1)已知:2H2(g)+O2(g)
 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1则Sabatier反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=(2)二氧化碳的富集装置如图所示。

①该富集法采用
②工作一段时间后,K2CO3溶液的pH
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为
| 离子种类 | H+ | OH- |  SO SO | Cl- |  CO CO | K+ | Na+ |
| 摩尔电导率×104(S·m2·mol-1) | 349.82 | 198.0 | 79.8 | 76.34 | 72.0 | 73.52 | 50.11 |
您最近半年使用:0次
名校
解题方法
9 . 2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
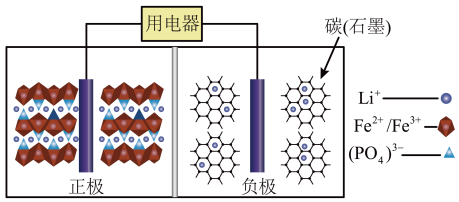
原理如下:(1-x)LiFePO4+xFePO4+LixCn LiFePO4+nC。下列说法不正确的是
LiFePO4+nC。下列说法不正确的是

原理如下:(1-x)LiFePO4+xFePO4+LixCn
 LiFePO4+nC。下列说法不正确的是
LiFePO4+nC。下列说法不正确的是| A.放电时,电子由负极经导线、用电器、导线到正极 |
| B.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4 |
| C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn |
| D.充电时,Li+向右移动,为了提高放电效率可用氯化锂溶液代替中间聚合物 |
您最近半年使用:0次
2023-10-03更新
|
473次组卷
|
3卷引用:云南省昆明市2023届高三下学期第二次摸底考试理综化学试题
解题方法
10 . 2016年7月美国康奈尔大学的研究人员瓦迪·阿尔·萨达特和林登·阿彻在发表于《科学进展》(ScienceAdvances)上的一篇论文中,描述了一种能够捕捉二氧化碳的电化学电池的设计方案。其简易结构如下图。下列说法错误的是
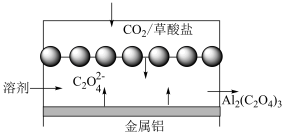

| A.金属铝作为还原剂参与负极的氧化反应 |
B.该装置除了吸收 之外还可得到化工产品 之外还可得到化工产品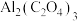 |
C.该装置每消耗27kg的金属铝,可以吸收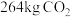 |
D.该装置的正极反应方程式为: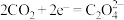 |
您最近半年使用:0次



