1 . 已知四氨合铜离子的模型如图甲,CaF2晶体的晶胞如图乙,阿伏加德罗常数的值用NA表示。下列有关说法正确的是
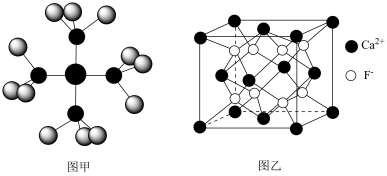

| A.基态Cu的电子排布式为[Ar]3d84s1 |
| B.四氨合铜离子中存在极性共价键、配位键、离子键 |
| C.距离Ca2+最近且等距离的F-有6个 |
D.若CaF2晶胞的棱长为acm,CaF2的密度为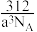 g/cm3 g/cm3 |
您最近一年使用:0次
名校
2 . 下列有关化学用语或图示表达正确的是
A.HCl分子中σ键的形成为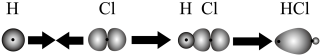 |
B.HClO的电子式为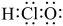 |
C.三氧化硫的VSEPR模型: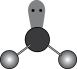 |
D.基态铜原子的价层电子轨道表示式为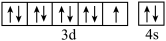 |
您最近一年使用:0次
2024-04-04更新
|
493次组卷
|
6卷引用:云南省曲靖市第一中学2024届高三下学期第八次月考理综试题-高中化学
云南省曲靖市第一中学2024届高三下学期第八次月考理综试题-高中化学北京市第一六一中学2023-2024学年高三下学期一模适应性训练化学试题(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)化学(北京卷03)-2024年高考押题预测卷(已下线)北京市通州区2024届高三下学期三模化学试题(已下线)湖南省岳阳市湘阴县第一中学2023-2024学年高三下学期5月期中考试化学试题
解题方法
3 . 硒、碲广泛应用于传感、光学器件、红外探测等领域。以下是利用碲碱渣(主要含Na2TeO3、Na2SeO3,还有微量的Cu2+、Pb2+及部分不溶性杂质)为原料分离硒、回收碲的流程图:
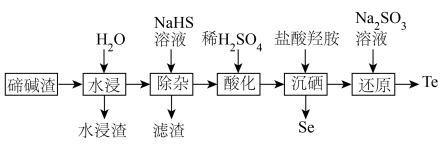
已知:① 时溶度积常数:
时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为 离子已经沉淀完全
离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
(1)基态硒原子的价电子排布式为___________ ,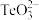 的中心原子的孤电子对数为
的中心原子的孤电子对数为___________ 。
(2)当 完全沉淀时,
完全沉淀时, 的浓度≤
的浓度≤___________ mol/L。
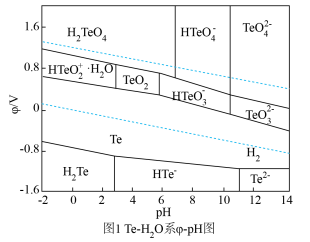
(3)下图是Te—H2O系电位( )—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
)—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以___________ 形式存在,Te(Ⅳ)可被氧化形成相应的高价Te(Ⅵ)离子,氧化电位随pH值的变化规律为___________ 。
(4)“沉硒”步骤中加入盐酸羟胺,反应的化学方程式为___________ 。
(5)工业上可用电解法制备高纯碲,同时回收工业造纸废液中的NaOH,工作原理如图所示,装置中采用___________ 离子交换膜(填“阳”或“阴”),写出B电极的电极反应式___________ ,若电解8小时,获得1.28吨高纯碲,则电流强度I=___________ C·h-1(已知:一个电子的电荷量e=1.6×10-19C,用含NA的式子表示)。


已知:①
 时溶度积常数:
时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为
 离子已经沉淀完全
离子已经沉淀完全③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是

回答下列问题:
(1)基态硒原子的价电子排布式为
 的中心原子的孤电子对数为
的中心原子的孤电子对数为(2)当
 完全沉淀时,
完全沉淀时, 的浓度≤
的浓度≤(3)下图是Te—H2O系电位(
 )—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
)—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
(4)“沉硒”步骤中加入盐酸羟胺,反应的化学方程式为
(5)工业上可用电解法制备高纯碲,同时回收工业造纸废液中的NaOH,工作原理如图所示,装置中采用

您最近一年使用:0次
名校
解题方法
4 . 元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的价电子排布式为nsn-1npn+1,则下列说法不正确的是
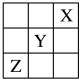
| A.Y元素原子的价电子排布式为4s24p4 |
| B.Y元素在元素周期表的第三周期VIA族 |
| C.X元素所在周期中所含非金属元素最多 |
| D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
您最近一年使用:0次
2024-04-04更新
|
202次组卷
|
46卷引用:云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题
云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题(已下线)考向36 原子结构与性质-备战2022年高考化学一轮复习考点微专题2014-2015福建省宁德市五校教学联合体高二下学期期中化学试卷2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷2016-2017学年四川省资阳市高二上学期期末化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第1课时黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题人教化学选修3第一章第二节课时1课时2 核外电子排布与元素周期表、原子半径——A学习区 夯实基础(鲁科版选修3)四川省越西中学2019-2020学年高二5月月考化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题山西省太原市山西大学附属中学2019-2020学年高二下学期5月化学试题山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题宁夏大学附属中学2020-2021学年高二上学期期中考试化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题河南省驻马店市2020-2021学年高二上学期期终考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时1 原子结构与元素周期表(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第2课时 核外电子排布与元素周期表(已下线)1.1 原子结构(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)(已下线)1.2.2 核外电子排布与元素周期表-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)新疆乌苏市第一中学2020-2021学年高二3月月考化学(4-21班)试题四川省邻水实验学校2020-2021学年高二下学期第一次月考化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题四川省广安市第二中学2021-2022学年高二下学期第一次月考化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题陕西省宝鸡市金台区2021-2022学年高二下学期期中考试化学试题第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表吉林省长春外国语学校2021-2022学年高二下学期阶段测试化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题浙江省绍兴蕺山外国语学校2021-2022学年高二下学期第一次月考化学试题天津市静海区四校2022-2023学年高二下学期3月阶段性检测化学试题四川省南充市嘉陵第一中学2022-2023学年高二下学期6月月考化学试题河北省张家口市宣化第一中学2022-2023学年高二下学期6月月考化学试题江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷安徽省蚌埠第二中学2023-2024学年高二下学期3月月考化学试题江苏省镇江市句容高级中学2023-2024学年高二下学期3月考试化学试题四川省成都市简阳实验学校2023-2024学年高二下学期3月月考化学试题名校期末好题汇编-原子结构与性质(选择题)(已下线)清单01 原子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
5 . 五氧化二钒(V2O5)广泛用于冶金、化工等行业,一种以富钒炉渣(其中钒以FeO•V2O3、V2O5的形式存在,还有少量的SiO2、Al2O3等)为原料制备V2O5的流程如图所示:
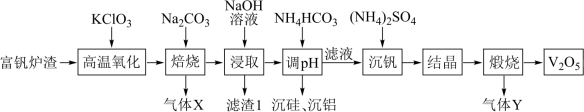
已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为 。
。
回答下列问题:
(1)基态V原子的价电子轨道表示式为_______ 。
(2)“滤渣1”的主要成分是一种红色固体,它的用途是_______ (写出一种即可)。
(3)“高温氧化”发生反应的化学方程式为_______ 。
(4)“调pH”步骤得到含铝沉淀的离子方程式为_______ 。
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为_______ 。
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和_______ 。
(7)钒的一种配合物的结构简式为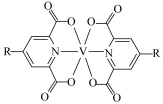 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为_______ (NA为阿伏加德罗常数的值)。

已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为
 。
。回答下列问题:
(1)基态V原子的价电子轨道表示式为
(2)“滤渣1”的主要成分是一种红色固体,它的用途是
(3)“高温氧化”发生反应的化学方程式为
(4)“调pH”步骤得到含铝沉淀的离子方程式为
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和
(7)钒的一种配合物的结构简式为
 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为
您最近一年使用:0次
名校
6 . 我国科学家在研究点击化学过程中,意外发现一种新化合物,其结构式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,Y与W是同一主族元素。下列说法正确的是


A.第一电离能: |
| B.X的氢化物中只存在极性键 |
| C.电解Z的简单氢化物的水溶液可制得Z单质 |
| D.W的最高价含氧酸根的空间构型为三角锥形 |
您最近一年使用:0次
2024-04-03更新
|
175次组卷
|
2卷引用:2024届云南省曲靖市高三上学期第一次复习检测理综试卷-高中化学
7 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: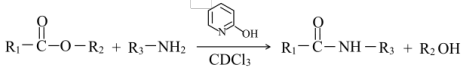 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近一年使用:0次
解题方法
8 . 我国科学家在嫦娥五号月壤样品中发现一种新矿物“嫦娥石”,其中含有原子序数依次增大的短周期主族元素X、Y、Z、R。X在地壳中含量最多,Y的电子层数是其最外层电子数的3倍,基态Z原子无未成对电子,基态R原子的p轨道半充满。下列说法错误的是
| A.Y的简单离子半径比Z的简单离子半径大 |
| B.R的简单氢化物的VSEPR模型为三角锥形 |
| C.Z的第一电离能大于同周期相邻元素 |
| D.X、R的简单氢化物的稳定性前者强于后者 |
您最近一年使用:0次
9 . 某种双核钴配合物阳离子的结构如图。X的第一电离能在第二周期主族元素中位居第二,Y的核外电子只有一种运动状态,Z的一种同素异形体是极性分子。下列说法错误的是
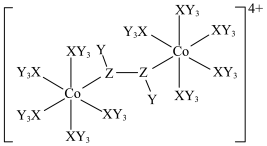
| A.简单氢化物的稳定性:Z>X |
| B.电负性:Z>X>Y |
| C.Co位于元素周期表ds区,在该阳离子中呈+2价 |
| D.从结构推测该配合物阳离子不稳定,且具有一定的氧化性 |
您最近一年使用:0次
2024-04-02更新
|
609次组卷
|
4卷引用:2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
解题方法
10 . 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种新型超分子,其分子结构如下图所示(Y和Y之间重复单元的W、X未全部标出),W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素,下列说法正确的是


A.简单气态氢化物的沸点: |
B.第一电离能: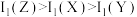 |
C.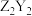 只含有离子键 只含有离子键 |
D.原子半径: |
您最近一年使用:0次



