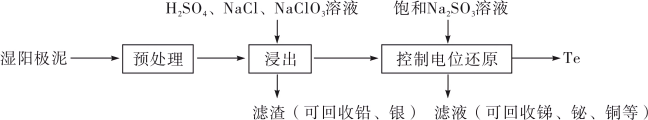
1 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)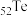 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、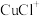 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为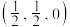 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 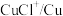 | 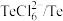 | 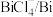 | 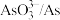 | 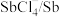 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
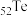 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、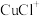 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
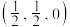 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。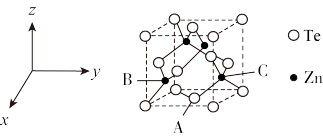
您最近一年使用:0次
名校
解题方法
2 . 长周期元素M的一种配合物对某些有机反应具有优良的催化性能,其结构可用下图表示,其中W、X、Y、Z为原子序数依次增加的短周期元素,M和Z的简单离子的电子层结构相同,下列叙述错误的是
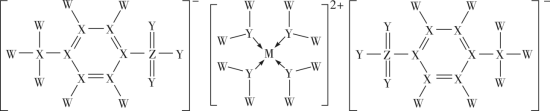
| A.简单离子半径:Z>M |
| B.电负性:Y>X>W>M |
| C.W、X、Y、Z均为元素周期表中p区元素 |
D.该配合物中X原子的轨道杂化类型为 、 、 |
您最近一年使用:0次
2024·云南昆明·三模
3 . 碘化亚铜(CuI)是一种白色粉末,不溶于水,能被 氧化,可用作有机合成催化剂。实验室制备碘化亚铜的装置如图所示(部分夹持及加热装置已略去):
氧化,可用作有机合成催化剂。实验室制备碘化亚铜的装置如图所示(部分夹持及加热装置已略去):
(1)仪器X的名称为___________ ,新制NaI溶液中需溶入少量 ,其目的是
,其目的是___________ 。
(2)实验中应该先打开活塞___________ (填“a”或“b”),单向阀的作用是___________ 。
(3)装置B中 参与反应生成CuI的离子方程式为
参与反应生成CuI的离子方程式为___________ 。
(4)已知荧光强度比值与 在一定浓度范围内的关系如图甲所示。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为
在一定浓度范围内的关系如图甲所示。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为 并定容至1L。取样1mL测得荧光强度比值为10.6,则产品中CuI的纯度为
并定容至1L。取样1mL测得荧光强度比值为10.6,则产品中CuI的纯度为___________ %。 的N能层中有
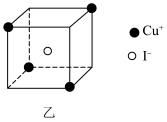
的N能层中有___________ 个空轨道;CuI晶胞包含8个小立方体,其中一种小立方体的结构如图乙所示。则1个CuI晶胞中含___________ 个 。
。
 氧化,可用作有机合成催化剂。实验室制备碘化亚铜的装置如图所示(部分夹持及加热装置已略去):
氧化,可用作有机合成催化剂。实验室制备碘化亚铜的装置如图所示(部分夹持及加热装置已略去):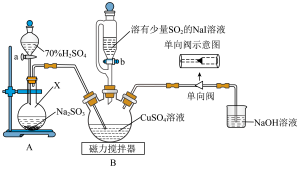
(1)仪器X的名称为
 ,其目的是
,其目的是(2)实验中应该先打开活塞
(3)装置B中
 参与反应生成CuI的离子方程式为
参与反应生成CuI的离子方程式为(4)已知荧光强度比值与
 在一定浓度范围内的关系如图甲所示。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为
在一定浓度范围内的关系如图甲所示。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为 并定容至1L。取样1mL测得荧光强度比值为10.6,则产品中CuI的纯度为
并定容至1L。取样1mL测得荧光强度比值为10.6,则产品中CuI的纯度为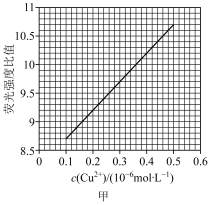
 的N能层中有
的N能层中有 。
。
您最近一年使用:0次
4 . 废弃电脑的CPU中含有贵重金属Cu、Ag、Au,可回收利用,部分流程如下:

(1)铜元素在周期表中位于______ ,基态铜原子的核外电子排布式为______ 。
(2)电脑CPU在使用时会涂抹一层散热硅脂(一种液体橡胶,主要成分为聚二甲基硅氧烷和聚甲基硅氧烷),可用______洗去;
(3)用Zn粉还原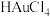 的化学反应方程式为
的化学反应方程式为______ ;
(4)试剂1为______ (填名称,下同),试剂2为______ ;
(5)加入过其铁粉的原因是______ ;
(6)滤渣2溶于试剂2的原因是______ ;(用离子反应方程式表示)
(7)金属铜的晶胞结构如图所示,铜原子之间的最小距离为apm,则铜晶胞的密度为______  (
( 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。

(1)铜元素在周期表中位于
(2)电脑CPU在使用时会涂抹一层散热硅脂(一种液体橡胶,主要成分为聚二甲基硅氧烷和聚甲基硅氧烷),可用______洗去;
| A.NaOH溶液 | B.纯碱溶液 | C.稀硫酸 | D.酒精 |
(3)用Zn粉还原
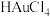 的化学反应方程式为
的化学反应方程式为(4)试剂1为
(5)加入过其铁粉的原因是
(6)滤渣2溶于试剂2的原因是
(7)金属铜的晶胞结构如图所示,铜原子之间的最小距离为apm,则铜晶胞的密度为
 (
( 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
5 . 黄铵铁矾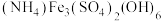 和
和 常用作净水剂。
常用作净水剂。
已知: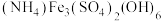 热分解过程发生的反应如下:
热分解过程发生的反应如下:
①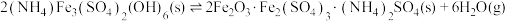
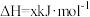
②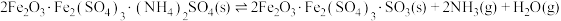
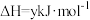
③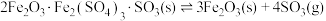
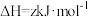
回答下列问题:
(1)基态 的M层电子排布式为
的M层电子排布式为_______ , 中N原子的
中N原子的_______ 轨道与H原子的s轨道重叠形成σ键。
(2) 的
的
_______  。
。
(3)一定温度下,在恒容密闭容器中加入一定量的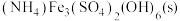 ,只发生反应:
,只发生反应: ,下列可判断该反应达到平衡状态的是_______(填序号)。
,下列可判断该反应达到平衡状态的是_______(填序号)。
(4)500℃时,在体积可变的密闭容器中加入一定量的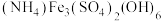 固体,只发生反应:
固体,只发生反应: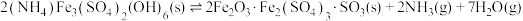 ,达到平衡时测得
,达到平衡时测得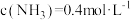 。保持温度不变,将容器体积变为原来的一半,达到新平衡时
。保持温度不变,将容器体积变为原来的一半,达到新平衡时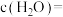
_______  。
。
(5)一定温度下,总压强恒定时,向体积可变的密闭容器中加入一定量的 和
和 氩气,仅发生反应②。测得平衡状态下
氩气,仅发生反应②。测得平衡状态下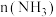 与
与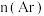 的关系如下图所示。随着通入的
的关系如下图所示。随着通入的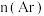 增大,
增大,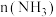 也增大的原因是
也增大的原因是_______ 。 的分解过程会发生下列反应:
的分解过程会发生下列反应:
主反应:

副反应: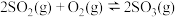
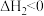
两个反应的平衡常数比值 随反应温度升高而
随反应温度升高而_______ (填“增大”“减小”或“不变”);若平衡时总压为25kPa, 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
_______ 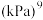 。
。
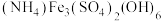 和
和 常用作净水剂。
常用作净水剂。已知:
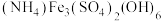 热分解过程发生的反应如下:
热分解过程发生的反应如下:①
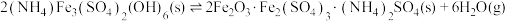
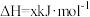
②
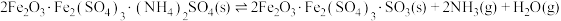
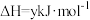
③
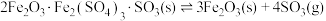
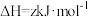
回答下列问题:
(1)基态
 的M层电子排布式为
的M层电子排布式为 中N原子的
中N原子的(2)
 的
的
 。
。(3)一定温度下,在恒容密闭容器中加入一定量的
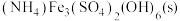 ,只发生反应:
,只发生反应: ,下列可判断该反应达到平衡状态的是_______(填序号)。
,下列可判断该反应达到平衡状态的是_______(填序号)。A. 质量不随时间变化 质量不随时间变化 | B. 体积分数不随时间变化 体积分数不随时间变化 |
| C.混合气体密度不随时间变化 | D.气体平均摩尔质量不随时间变化 |
(4)500℃时,在体积可变的密闭容器中加入一定量的
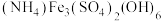 固体,只发生反应:
固体,只发生反应: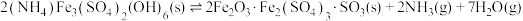 ,达到平衡时测得
,达到平衡时测得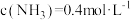 。保持温度不变,将容器体积变为原来的一半,达到新平衡时
。保持温度不变,将容器体积变为原来的一半,达到新平衡时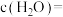
 。
。(5)一定温度下,总压强恒定时,向体积可变的密闭容器中加入一定量的
 和
和 氩气,仅发生反应②。测得平衡状态下
氩气,仅发生反应②。测得平衡状态下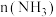 与
与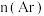 的关系如下图所示。随着通入的
的关系如下图所示。随着通入的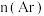 增大,
增大,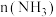 也增大的原因是
也增大的原因是
 的分解过程会发生下列反应:
的分解过程会发生下列反应:主反应:


副反应:
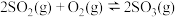
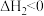
两个反应的平衡常数比值
 随反应温度升高而
随反应温度升高而 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
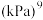 。
。
您最近一年使用:0次
2024-04-18更新
|
110次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
解题方法
6 . 尿素 可与正烷烃形成超分子,原理如图所示。下列说法错误的是
可与正烷烃形成超分子,原理如图所示。下列说法错误的是
 可与正烷烃形成超分子,原理如图所示。下列说法错误的是
可与正烷烃形成超分子,原理如图所示。下列说法错误的是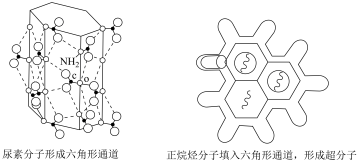
| A.尿素分子中各元素的电负性:O>N>C>H |
| B.尿素分子通过分子间氢键形成六角形通道结构 |
| C.依据分子直径的大小差异可分离同碳数正烷烃和支链烷烃 |
| D.该超分子能稳定存在的原因是尿素分子和正烷烃分子通过共价键结合使能量降低、熵减小 |
您最近一年使用:0次
2024-04-18更新
|
167次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
7 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
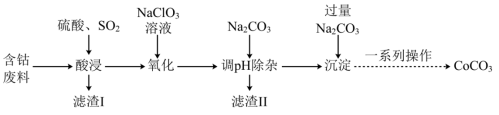
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
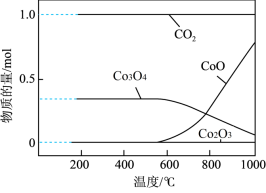
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
8 . 一种工业洗涤剂中间体的结构如图,其中 、
、 、
、 、
、 、
、 原子序数依次增大且分属三个短周期。
原子序数依次增大且分属三个短周期。 、
、 元素的基态原子中均有两个未成对电子,下列说法正确的是
元素的基态原子中均有两个未成对电子,下列说法正确的是
 、
、 、
、 、
、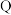 、
、 原子序数依次增大且分属三个短周期。
原子序数依次增大且分属三个短周期。 、
、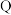 元素的基态原子中均有两个未成对电子,下列说法正确的是
元素的基态原子中均有两个未成对电子,下列说法正确的是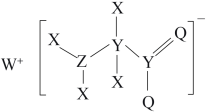
A.电负性大小: |
B.简单离子半径: |
C.简单氢化物的沸点: |
D.阴离子中各原子都满足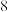 电子稳定结构 电子稳定结构 |
您最近一年使用:0次
2024-04-08更新
|
96次组卷
|
14卷引用:2024届高考化学考点剖析精创专题卷——专题七 物质结构 元素周期律
2024届高考化学考点剖析精创专题卷——专题七 物质结构 元素周期律云南省大理州实验中学2021-2022学年高二下学期化学期中考试题山东省德州市2020-2021学年高二下学期期末考试化学试题福建省三明市五县2021-2022学年高二下学期联合质检考试(期中)化学试题厦门外国语学校2021-2022学年高二下学期期中考试化学试题湖北省黄冈市麻城市第二中学2021-2022学年高二下学期3月月考化学试题 吉林省吉林第一中学2022-2023学年高二上学期11月月考化学试题陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题广西钦州市第四中学2022-2023学年高二下学期2月考试化学试题福建省龙岩市一级校联盟2022-2023学年高二下学期4月期中考试化学试题福建省三明第一中学2022-2023学年高二下学期期中考试化学试题福建省厦门市湖滨中学2022-2023学年高二下学期期中考试化学试题四川省达州市万源中学2023-2024学年高二下学期4月月考化学试题河南省郑州市十校2023-2024学年高二下学期期中联考化学试卷
解题方法
9 . X、Y、Z、W、R为五种短周期主族元素,原子序数依次增大。X原子半径最小,Y、Z处于同一周期,Y与X形成的简单化合物键角约为107°,基态Z原子有两个未成对电子。W是地壳中含量最高的金属元素,R的最高价氧化物对应的水化物是酸性最强的无机含氧酸。下列说法正确的是
| A.简单离子半径大小:R>W>Y>Z>X |
| B.基态原子第一电离能:Y>Z |
C.实验室可电解熔融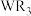 获得W的单质 获得W的单质 |
| D.X、Y、Z形成的化合物既含有离子键又含有共价键 |
您最近一年使用:0次
10 . 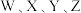 为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由
为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由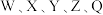 形成的一种化合物结构如图所示。
形成的一种化合物结构如图所示。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
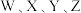 为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由
为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由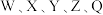 形成的一种化合物结构如图所示。
形成的一种化合物结构如图所示。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是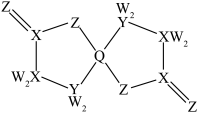
A.第一电离能: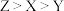 | B.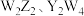 均为非极性分子 均为非极性分子 |
C. 该化合物中含 该化合物中含 键的数目为 键的数目为 | D.Q的基态原子价层电子排布式为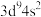 |
您最近一年使用:0次
2024-04-07更新
|
172次组卷
|
2卷引用:云南省昆明市2024届高三“三诊一模”教学质量检测(二模)理综-化学试题



