名校
1 . 铬、钛、钴都属于过渡元素。
(1)铬元素属于周期表的___________ 区,基态Cr原子有___________ 个未成对电子。同周期的基态原子中,与Cr最高能层电子数相同的还有___________ (写元素符号)。
(2)钛元素形成的钛酸钡晶体的晶胞结构如图所示,该晶体经X射线分析得出,重复单元为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。___________ 。
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的___________ 位置。
③Ti4+的氧配位数和Ba2+的氧配位数分别为___________ 。
(3)钴的某种配合物的化学式为[Co(H2O)6]F2,该配合物的立方晶胞如图所示,其晶胞参数为apm。___________ 个。
②设阿伏加德罗常数的值为NA,则[Co(H2O)6]F2晶体的密度为___________ g·cm-3。
(1)铬元素属于周期表的
(2)钛元素形成的钛酸钡晶体的晶胞结构如图所示,该晶体经X射线分析得出,重复单元为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。
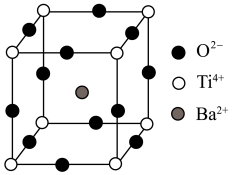
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的
③Ti4+的氧配位数和Ba2+的氧配位数分别为
(3)钴的某种配合物的化学式为[Co(H2O)6]F2,该配合物的立方晶胞如图所示,其晶胞参数为apm。
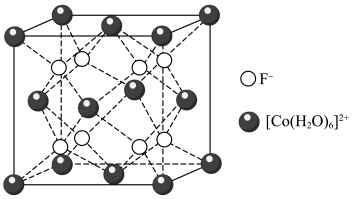
②设阿伏加德罗常数的值为NA,则[Co(H2O)6]F2晶体的密度为
您最近一年使用:0次
2 . 下列说法正确的是
| A.气态Mn2+再失去一个电子比气态Fe2+再失去一个电子容易 |
| B.离子半径Na+>Mg2+>O2- |
C.基态硫原子的电子排布式若写成 违背了洪特规则 违背了洪特规则 |
| D.两个p轨道之间只能形成π键,不能形成σ键 |
您最近一年使用:0次
解题方法
3 . X、Y、Z、W、R为五种短周期主族元素,原子序数依次增大。X原子半径最小,Y、Z处于同一周期,Y与X形成的简单化合物键角约为107°,基态Z原子有两个未成对电子。W是地壳中含量最高的金属元素,R的最高价氧化物对应的水化物是酸性最强的无机含氧酸。下列说法正确的是
| A.简单离子半径大小:R>W>Y>Z>X |
| B.基态原子第一电离能:Y>Z |
C.实验室可电解熔融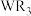 获得W的单质 获得W的单质 |
| D.X、Y、Z形成的化合物既含有离子键又含有共价键 |
您最近一年使用:0次
4 . 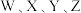 为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由
为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由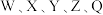 形成的一种化合物结构如图所示。
形成的一种化合物结构如图所示。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
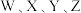 为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由
为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由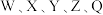 形成的一种化合物结构如图所示。
形成的一种化合物结构如图所示。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是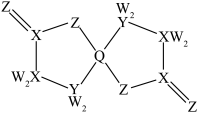
A.第一电离能: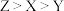 | B.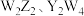 均为非极性分子 均为非极性分子 |
C. 该化合物中含 该化合物中含 键的数目为 键的数目为 | D.Q的基态原子价层电子排布式为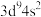 |
您最近一年使用:0次
2024-04-07更新
|
172次组卷
|
2卷引用:云南省昆明市2024届高三“三诊一模”教学质量检测(二模)理综-化学试题
5 . 已知四氨合铜离子的模型如图甲,CaF2晶体的晶胞如图乙,阿伏加德罗常数的值用NA表示。下列有关说法正确的是
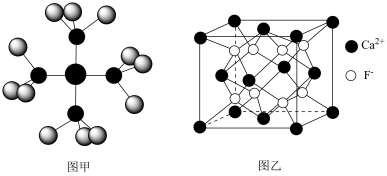

| A.基态Cu的电子排布式为[Ar]3d84s1 |
| B.四氨合铜离子中存在极性共价键、配位键、离子键 |
| C.距离Ca2+最近且等距离的F-有6个 |
D.若CaF2晶胞的棱长为acm,CaF2的密度为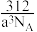 g/cm3 g/cm3 |
您最近一年使用:0次
名校
6 . 下列有关化学用语或图示表达正确的是
A.HCl分子中σ键的形成为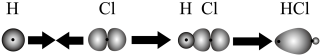 |
B.HClO的电子式为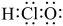 |
C.三氧化硫的VSEPR模型: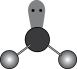 |
D.基态铜原子的价层电子轨道表示式为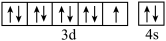 |
您最近一年使用:0次
2024-04-04更新
|
487次组卷
|
6卷引用:云南省曲靖市第一中学2024届高三下学期第八次月考理综试题-高中化学
云南省曲靖市第一中学2024届高三下学期第八次月考理综试题-高中化学北京市第一六一中学2023-2024学年高三下学期一模适应性训练化学试题(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)化学(北京卷03)-2024年高考押题预测卷(已下线)北京市通州区2024届高三下学期三模化学试题(已下线)湖南省岳阳市湘阴县第一中学2023-2024学年高三下学期5月期中考试化学试题
解题方法
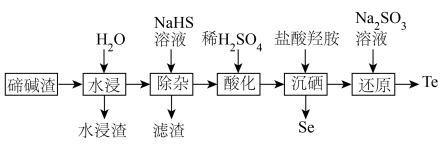
7 . 硒、碲广泛应用于传感、光学器件、红外探测等领域。以下是利用碲碱渣(主要含Na2TeO3、Na2SeO3,还有微量的Cu2+、Pb2+及部分不溶性杂质)为原料分离硒、回收碲的流程图:
已知:① 时溶度积常数:
时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为 离子已经沉淀完全
离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
(1)基态硒原子的价电子排布式为___________ ,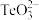 的中心原子的孤电子对数为
的中心原子的孤电子对数为___________ 。
(2)当 完全沉淀时,
完全沉淀时, 的浓度≤
的浓度≤___________ mol/L。
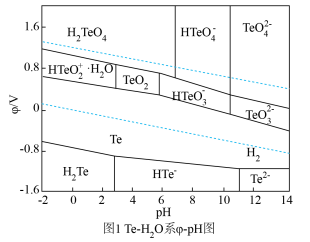
(3)下图是Te—H2O系电位( )—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
)—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以___________ 形式存在,Te(Ⅳ)可被氧化形成相应的高价Te(Ⅵ)离子,氧化电位随pH值的变化规律为___________ 。
(4)“沉硒”步骤中加入盐酸羟胺,反应的化学方程式为___________ 。
(5)工业上可用电解法制备高纯碲,同时回收工业造纸废液中的NaOH,工作原理如图所示,装置中采用___________ 离子交换膜(填“阳”或“阴”),写出B电极的电极反应式___________ ,若电解8小时,获得1.28吨高纯碲,则电流强度I=___________ C·h-1(已知:一个电子的电荷量e=1.6×10-19C,用含NA的式子表示)。


已知:①
 时溶度积常数:
时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为
 离子已经沉淀完全
离子已经沉淀完全③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是

回答下列问题:
(1)基态硒原子的价电子排布式为
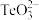 的中心原子的孤电子对数为
的中心原子的孤电子对数为(2)当
 完全沉淀时,
完全沉淀时, 的浓度≤
的浓度≤(3)下图是Te—H2O系电位(
 )—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
)—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
(4)“沉硒”步骤中加入盐酸羟胺,反应的化学方程式为
(5)工业上可用电解法制备高纯碲,同时回收工业造纸废液中的NaOH,工作原理如图所示,装置中采用

您最近一年使用:0次
名校
解题方法
8 . 氮元素是重要的非金属元素,可形成多种铵盐、氮化物、叠氮化物及配合物等。
(1)基态氮原子价电子的轨道表示式(价电子排布图)为___________ ;第二周期元素原子中第一电离能大于氮原子的有___________ 种, 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(2)C、N、O、S四种元素中,电负性最大的是___________ 。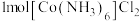 中含有σ键的数目为
中含有σ键的数目为___________ ;已知 比
比 的沸点低得多,试解释原因
的沸点低得多,试解释原因___________ 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有
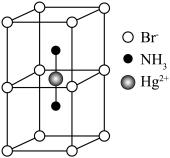
配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有___________ mol。 作简单立方堆积,两个立方体共用的面中心存在一个
作简单立方堆积,两个立方体共用的面中心存在一个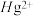 ,
, 位于立方体的体心,相邻的
位于立方体的体心,相邻的 的距离均为apm,阿伏加德罗常数的值为
的距离均为apm,阿伏加德罗常数的值为 ,该物质的化学式为
,该物质的化学式为___________ ,该晶体的密度为___________  。
。 可以与
可以与 、
、 等形成配合物。与
等形成配合物。与 互为等电子体且为非极性分子的化学式为
互为等电子体且为非极性分子的化学式为___________ 。在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为___________ ,两种晶体中空间利用率较高的是___________ 。(填“图1”或“图2”)
(1)基态氮原子价电子的轨道表示式(价电子排布图)为
 中阴离子的空间构型为
中阴离子的空间构型为(2)C、N、O、S四种元素中,电负性最大的是
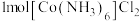 中含有σ键的数目为
中含有σ键的数目为 比
比 的沸点低得多,试解释原因
的沸点低得多,试解释原因(3)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有
配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有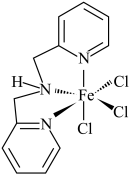
 作简单立方堆积,两个立方体共用的面中心存在一个
作简单立方堆积,两个立方体共用的面中心存在一个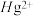 ,
, 位于立方体的体心,相邻的
位于立方体的体心,相邻的 的距离均为apm,阿伏加德罗常数的值为
的距离均为apm,阿伏加德罗常数的值为 ,该物质的化学式为
,该物质的化学式为 。
。
 可以与
可以与 、
、 等形成配合物。与
等形成配合物。与 互为等电子体且为非极性分子的化学式为
互为等电子体且为非极性分子的化学式为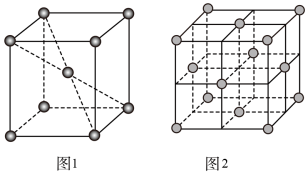
您最近一年使用:0次
名校
9 . 五氧化二钒(V2O5)广泛用于冶金、化工等行业,一种以富钒炉渣(其中钒以FeO•V2O3、V2O5的形式存在,还有少量的SiO2、Al2O3等)为原料制备V2O5的流程如图所示:
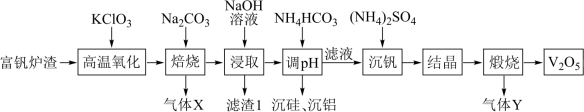
已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为 。
。
回答下列问题:
(1)基态V原子的价电子轨道表示式为_______ 。
(2)“滤渣1”的主要成分是一种红色固体,它的用途是_______ (写出一种即可)。
(3)“高温氧化”发生反应的化学方程式为_______ 。
(4)“调pH”步骤得到含铝沉淀的离子方程式为_______ 。
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为_______ 。
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和_______ 。
(7)钒的一种配合物的结构简式为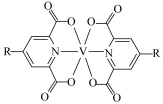 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为_______ (NA为阿伏加德罗常数的值)。

已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为
 。
。回答下列问题:
(1)基态V原子的价电子轨道表示式为
(2)“滤渣1”的主要成分是一种红色固体,它的用途是
(3)“高温氧化”发生反应的化学方程式为
(4)“调pH”步骤得到含铝沉淀的离子方程式为
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和
(7)钒的一种配合物的结构简式为
 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为
您最近一年使用:0次
名校
10 . 我国科学家在研究点击化学过程中,意外发现一种新化合物,其结构式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,Y与W是同一主族元素。下列说法正确的是


A.第一电离能: |
| B.X的氢化物中只存在极性键 |
| C.电解Z的简单氢化物的水溶液可制得Z单质 |
| D.W的最高价含氧酸根的空间构型为三角锥形 |
您最近一年使用:0次
2024-04-03更新
|
175次组卷
|
2卷引用:2024届云南省曲靖市高三上学期第一次复习检测理综试卷-高中化学



