名校
解题方法
1 . 下列化学用语或图示表达正确的是
| A.基态25Mn的价电子3d44s2 |
| B.PCl3分子的空间结构模型:正四面体 |
C.2pz的电子云轮廓图: |
D.基态氧原子的轨道表示式: 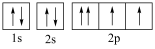 |
您最近一年使用:0次
名校
2 . 黑火药的主要成分为木炭(C)、硫黄(S)和火硝(KNO3).请回答下列问题。
(1)基态碳原子的电子占据最高能级的电子云轮廓图为___________ 形。
(2)原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为___________ 。
(3)C、N、O、K四种元素的第一电离能由大到小的顺序为___________ 。
(4)O、S、Se、Te同主族元素,Te位于第五周期
①基态Te原子价电子排布式为___________ ;
②H2Se的中心原子杂化类型是:___________ , SeO32-的立体构型是___________ ;
③比较H2S与H2O沸点高低,并说明原因:___________ 。
(1)基态碳原子的电子占据最高能级的电子云轮廓图为
(2)原子核外电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为(3)C、N、O、K四种元素的第一电离能由大到小的顺序为
(4)O、S、Se、Te同主族元素,Te位于第五周期
①基态Te原子价电子排布式为
②H2Se的中心原子杂化类型是:
③比较H2S与H2O沸点高低,并说明原因:
您最近一年使用:0次
3 . 黄铵铁矾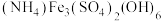 和
和 常用作净水剂。
常用作净水剂。
已知: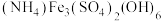 热分解过程发生的反应如下:
热分解过程发生的反应如下:
①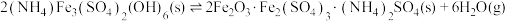
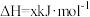
②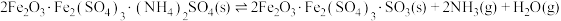
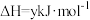
③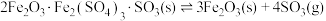
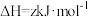
回答下列问题:
(1)基态 的M层电子排布式为
的M层电子排布式为_______ , 中N原子的
中N原子的_______ 轨道与H原子的s轨道重叠形成σ键。
(2) 的
的
_______  。
。
(3)一定温度下,在恒容密闭容器中加入一定量的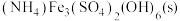 ,只发生反应:
,只发生反应: ,下列可判断该反应达到平衡状态的是_______(填序号)。
,下列可判断该反应达到平衡状态的是_______(填序号)。
(4)500℃时,在体积可变的密闭容器中加入一定量的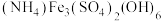 固体,只发生反应:
固体,只发生反应: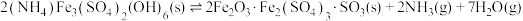 ,达到平衡时测得
,达到平衡时测得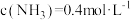 。保持温度不变,将容器体积变为原来的一半,达到新平衡时
。保持温度不变,将容器体积变为原来的一半,达到新平衡时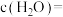
_______  。
。
(5)一定温度下,总压强恒定时,向体积可变的密闭容器中加入一定量的 和
和 氩气,仅发生反应②。测得平衡状态下
氩气,仅发生反应②。测得平衡状态下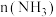 与
与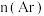 的关系如下图所示。随着通入的
的关系如下图所示。随着通入的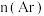 增大,
增大,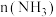 也增大的原因是
也增大的原因是_______ 。 的分解过程会发生下列反应:
的分解过程会发生下列反应:
主反应:

副反应: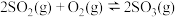
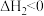
两个反应的平衡常数比值 随反应温度升高而
随反应温度升高而_______ (填“增大”“减小”或“不变”);若平衡时总压为25kPa, 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
_______ 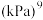 。
。
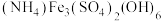 和
和 常用作净水剂。
常用作净水剂。已知:
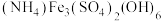 热分解过程发生的反应如下:
热分解过程发生的反应如下:①
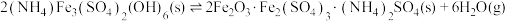
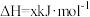
②
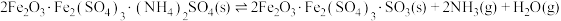
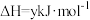
③
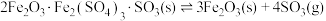
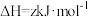
回答下列问题:
(1)基态
 的M层电子排布式为
的M层电子排布式为 中N原子的
中N原子的(2)
 的
的
 。
。(3)一定温度下,在恒容密闭容器中加入一定量的
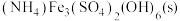 ,只发生反应:
,只发生反应: ,下列可判断该反应达到平衡状态的是_______(填序号)。
,下列可判断该反应达到平衡状态的是_______(填序号)。A. 质量不随时间变化 质量不随时间变化 | B. 体积分数不随时间变化 体积分数不随时间变化 |
| C.混合气体密度不随时间变化 | D.气体平均摩尔质量不随时间变化 |
(4)500℃时,在体积可变的密闭容器中加入一定量的
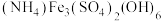 固体,只发生反应:
固体,只发生反应: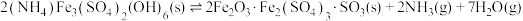 ,达到平衡时测得
,达到平衡时测得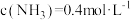 。保持温度不变,将容器体积变为原来的一半,达到新平衡时
。保持温度不变,将容器体积变为原来的一半,达到新平衡时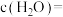
 。
。(5)一定温度下,总压强恒定时,向体积可变的密闭容器中加入一定量的
 和
和 氩气,仅发生反应②。测得平衡状态下
氩气,仅发生反应②。测得平衡状态下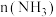 与
与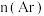 的关系如下图所示。随着通入的
的关系如下图所示。随着通入的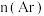 增大,
增大,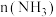 也增大的原因是
也增大的原因是
 的分解过程会发生下列反应:
的分解过程会发生下列反应:主反应:


副反应:
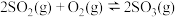
两个反应的平衡常数比值
 随反应温度升高而
随反应温度升高而 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
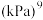 。
。
您最近一年使用:0次
2024-04-18更新
|
110次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
解题方法
4 . 尿素 可与正烷烃形成超分子,原理如图所示。下列说法错误的是
可与正烷烃形成超分子,原理如图所示。下列说法错误的是
 可与正烷烃形成超分子,原理如图所示。下列说法错误的是
可与正烷烃形成超分子,原理如图所示。下列说法错误的是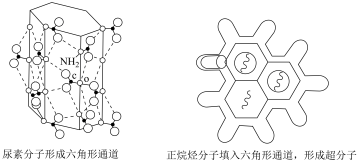
| A.尿素分子中各元素的电负性:O>N>C>H |
| B.尿素分子通过分子间氢键形成六角形通道结构 |
| C.依据分子直径的大小差异可分离同碳数正烷烃和支链烷烃 |
| D.该超分子能稳定存在的原因是尿素分子和正烷烃分子通过共价键结合使能量降低、熵减小 |
您最近一年使用:0次
2024-04-18更新
|
167次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
名校
解题方法
5 . 现有A、B、C、D、E、F六种元素,均为前4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1)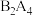 的电子式为
的电子式为___________ (用元素符号表示,下同)。
(2)C元素的原子核外共有___________ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈___________ 形。
(3)某同学推断D元素基态原子的轨道表示式为: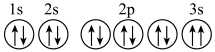 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了___________ (填序号)。
a.泡利不相容原理 b.洪特规则
(4)C、D、E三种元素的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(5)其中五种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如下图所示)。阳离子中存在的化学键类型有___________ (填序号)。
该化合物加热时阳离子首先失去的组分是___________ (填化学式),判断理由是___________ 。
(6)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是___________ (填标号)。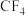 b.
b. c.
c. d.
d.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素基态原子的核外p电子数比s电子数少1 |
| C元素基态原子的核外p轨道中有两个未成对电子 |
D元素的气态基态原子的第一至第四电离能分别是: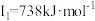 , ,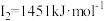 , ,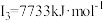 , ,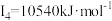 |
| E元素的主族序数比周期数大3 |
| F元素位于元素周期表中的第11列 |
(1)
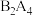 的电子式为
的电子式为(2)C元素的原子核外共有
(3)某同学推断D元素基态原子的轨道表示式为:
 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了a.泡利不相容原理 b.洪特规则
(4)C、D、E三种元素的简单离子半径由大到小的顺序是
(5)其中五种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如下图所示)。阳离子中存在的化学键类型有

该化合物加热时阳离子首先失去的组分是
(6)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是
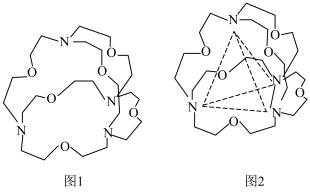
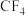 b.
b. c.
c. d.
d.
您最近一年使用:0次
6 . 下列化学用语或图示表达不正确的是
| A.乙炔的结构简式为HC≡CH |
| B.HClO的结构式为H―O―Cl |
C.基态Si原子价电子轨道表示式为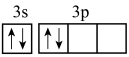 |
D.Na2O2的电子式为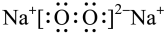 |
您最近一年使用:0次
7 . 五种前四周期的元素X、Y、Z、Q、T。已知X元素基态原子的M层有6种运动状态不同的电子;Y原子的价电子构型为3d84s2,基态Z原子的L层p能级有一个空轨道;Q原子的L电子层的p能级只有一对成对电子;基态T原子的M电子层上p轨道半充满。下列说法错误的是
| A.Y、Q及氢三种元素形成的某化合物,能用于制作可充电电池的电极材料 |
| B.若X、T、Z的最高价的氧化物对应的水化物分别为u、v、w,则酸性为:u>v>w。理由是含氧酸酸性与非羟基氧原子数有关 |
| C.X、Y、T三种元素第一电离能的大小次序是:X>T>Y |
| D.化合物ZQ2、ZX2均是由极性键构成的非极性分子 |
您最近一年使用:0次
名校
解题方法
8 . 锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)元素Zn位于元素周期表的___________ 区,基态Zn原子核外电子占据的最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 形。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。其中,第一电离能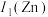
___________  (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是___________ 。
(3) 形成的某种化合物M是很好的补锌剂,其键线式如图所示。
形成的某种化合物M是很好的补锌剂,其键线式如图所示。___________ 。
②常见含氮的配体有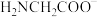 、
、 、
、 等,
等, 分子的空间构型为
分子的空间构型为___________ ,叠氮化钠( )用于汽车的安全气囊,结构如图甲。
)用于汽车的安全气囊,结构如图甲。 中存在的两个大π键可用符号
中存在的两个大π键可用符号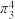 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为___________ 。叠氮酸(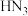 )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为___________ 。 最近的4个
最近的4个 所围成的空间构型为
所围成的空间构型为___________ ,距离 最近且等距离的
最近且等距离的 有
有___________ 个。若晶胞参数为apm,则 与
与 最近距离为
最近距离为___________ pm(用含a的代数式表示)。
(1)元素Zn位于元素周期表的
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。其中,第一电离能
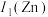
 (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是(3)
 形成的某种化合物M是很好的补锌剂,其键线式如图所示。
形成的某种化合物M是很好的补锌剂,其键线式如图所示。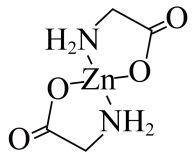
②常见含氮的配体有
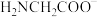 、
、 、
、 等,
等, 分子的空间构型为
分子的空间构型为 )用于汽车的安全气囊,结构如图甲。
)用于汽车的安全气囊,结构如图甲。 中存在的两个大π键可用符号
中存在的两个大π键可用符号 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为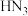 )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为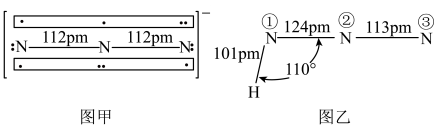
 最近的4个
最近的4个 所围成的空间构型为
所围成的空间构型为 最近且等距离的
最近且等距离的 有
有 与
与 最近距离为
最近距离为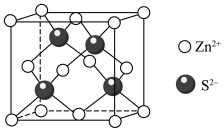
您最近一年使用:0次
9 . 下列状态的磷微粒中,失去最外层一个电子所需能量最大的是
| A.[Ne]3s23p3 | B.[Ne]3s23p2 | C.[Ne]3s23p24s1 | D.[Ne]3s23p14s1 |
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)Fe成为阳离子时首先失去___________ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为___________ 。
(2)基态S原子电子占据最高能级的电子云轮廓图为___________ 形。
(3)某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该原子价层电子的轨道表示式___________ ,该元素名称为___________ 。
(4)已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为___________ 。
(5)某有机物的结构简式为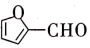 ,该分子内含有___________ (填序号)。
,该分子内含有___________ (填序号)。
(6)已知元素X的气态原子逐个失去第1个至第4个电子所需能量如下表所示:
元素X的常见化合价是___________(填序号)。
(1)Fe成为阳离子时首先失去
(2)基态S原子电子占据最高能级的电子云轮廓图为
(3)某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该原子价层电子的轨道表示式
(4)已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(5)某有机物的结构简式为
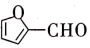 ,该分子内含有___________ (填序号)。
,该分子内含有___________ (填序号)。| A.11个σ键、2个π键 | B.10个σ键、2个π键 |
| C.10个σ键、3个π键 | D.11个σ键、3个π键 |
| I1 | I2 | I3 | I4 | |
| 电离能/(kJ·mol-1) | 578 | 1817 | 2745 | 11578 |
| A.+1 | B.+2 | C.+3 | D.+4 |
您最近一年使用:0次



