名校
1 . 五氧化二钒(V2O5)广泛用于冶金、化工等行业,一种以富钒炉渣(其中钒以FeO•V2O3、V2O5的形式存在,还有少量的SiO2、Al2O3等)为原料制备V2O5的流程如图所示:
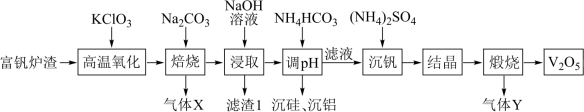
已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为 。
。
回答下列问题:
(1)基态V原子的价电子轨道表示式为_______ 。
(2)“滤渣1”的主要成分是一种红色固体,它的用途是_______ (写出一种即可)。
(3)“高温氧化”发生反应的化学方程式为_______ 。
(4)“调pH”步骤得到含铝沉淀的离子方程式为_______ 。
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为_______ 。
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和_______ 。
(7)钒的一种配合物的结构简式为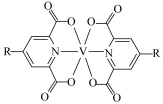 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为_______ (NA为阿伏加德罗常数的值)。

已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为
 。
。回答下列问题:
(1)基态V原子的价电子轨道表示式为
(2)“滤渣1”的主要成分是一种红色固体,它的用途是
(3)“高温氧化”发生反应的化学方程式为
(4)“调pH”步骤得到含铝沉淀的离子方程式为
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和
(7)钒的一种配合物的结构简式为
 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为
您最近一年使用:0次
解题方法
2 . 短周期主族元素X、Y、Z、W、M、O的原子序数逐渐增大,其中部分元素的性质或原子结构如下表:
试回答下列问题:
(1)Y原子最外层电子的轨道表示式为_______ 。
(2)元素Y、Z的简单离子半径大小关系为_______ (填离子符号,用”>"连接)。
(3)X原子的第一电离能_______ Y原子(填“>”、“<”或“=”),理由是_______ 。
(4)下列状态的W的微粒中,电离最外层的一个电子所需能量最小的是_______(填序号)。
(5)元素M与元素O相比,非金属性较强的是_______ (填元素符号),下列表述中能证明这一事实的是_______ (填序号)。
a.常温下,M的单质与O的单质状态不同
b.简单氢化物的稳定性:M<O
c.一定条件下M和O的单质都能与氢氧化钠溶液反应
d.M的电负性为2.5,O的电负性为3.0
| 元素 | 元素性质或原子结构 |
| X | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 单质为银白色固体,质软,在空气中燃烧发出黄色的火焰 |
| W | 其最高价氧化物的水化物呈两性 |
| M | 原子序数是Y原子序数的2倍 |
试回答下列问题:
(1)Y原子最外层电子的轨道表示式为
(2)元素Y、Z的简单离子半径大小关系为
(3)X原子的第一电离能
(4)下列状态的W的微粒中,电离最外层的一个电子所需能量最小的是_______(填序号)。
| A.[Ne] | B.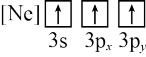 | C.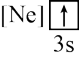 | D.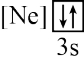 |
a.常温下,M的单质与O的单质状态不同
b.简单氢化物的稳定性:M<O
c.一定条件下M和O的单质都能与氢氧化钠溶液反应
d.M的电负性为2.5,O的电负性为3.0
您最近一年使用:0次
解题方法
3 . 短周期元素A、B、C、D、E的原子序数依次增大,其最外层电子数与原子半径的大小关系如图所示,请按要求回答下列问题:
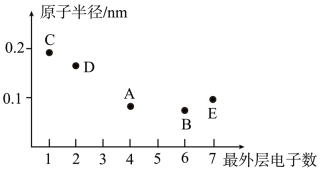
(1)基态E原子中有______ 种不同能量的电子,其中能量最高的电子所占据能级的电子云轮廓图呈______ 形。
(2)五种元素中,非金属元素第一电离能最小的是______ (填元素符号),非金属元素形成的最高价含氧酸的酸性最强的是______ (填化学式)。
(3)五种元素中,金属元素的金属性最强的是______ (填元素符号),设计一个简单的实验,证明金属元素金属性的强弱,简述实验步骤和现象:______ 。
(4)欲鉴定月球上是否有A元素的存在,可以通过______ 的方法。

(1)基态E原子中有
(2)五种元素中,非金属元素第一电离能最小的是
(3)五种元素中,金属元素的金属性最强的是
(4)欲鉴定月球上是否有A元素的存在,可以通过
您最近一年使用:0次
名校
4 . 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
则A的化合价___________ B的化合价(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
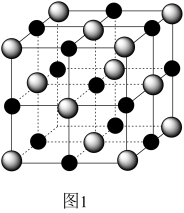
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:___________ 。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________ 。
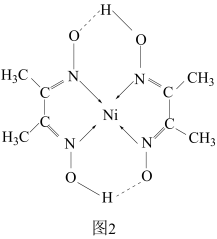
(4)某配合物的分子结构如图2所示,则N原子的杂化方式为___________ ;基态Ni原子的电子排布式___________ 。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/ kJ/mol | 786 | 715 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(4)某配合物的分子结构如图2所示,则N原子的杂化方式为

您最近一年使用:0次
解题方法
5 . 胆矾化学式为CuSO4·5H2O。实验证明CuSO4·5H2O中有4个水分子为配位水分子,其结构示意图如下:回答下列问题:
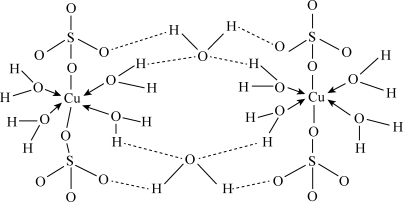
(1)基态铜原子的价层电子排布式为_______ ,位于周期表中第_______ 周期_______ 族。
(2)胆矾中S原子的杂化方式是_______ ,H、O、S中,第一电离能最大的元素是_______ (填元素符号)
(3)胆矾中存在的化学键有配位键、_______ 。
(4)含硫化合物SOCl2的VSEPR模型是_______ ,试分析该分子中键角∠Cl-S-O大于∠Cl-S-Cl的原因是_______ 。
(5)立方铜晶胞中铜原子的配位数为12,则每个晶胞中有_______ 个铜原子,铜原子的半径为rcm,则铜晶体的密度为_______ g·cm-3(阿伏加德罗常数值用NA表示)。

(1)基态铜原子的价层电子排布式为
(2)胆矾中S原子的杂化方式是
(3)胆矾中存在的化学键有配位键、
(4)含硫化合物SOCl2的VSEPR模型是
(5)立方铜晶胞中铜原子的配位数为12,则每个晶胞中有
您最近一年使用:0次
6 . 按照下列元素基态原子的电子排布特征回答问题。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为3s23p6;F为金属元素且原子核外p电子数和s电子数相等。
(1)B元素在元素周期表中的位置:___________ 。
(2)上述元素中位于s区的有___________ (填元素符号)。
(3)写出C元素基态原子价电子排布图:___________ 。
(4)检验某溶液中是否含有D+,可通过___________ 反应来实现;检验某溶液中是否含有B-,通常所用的试剂是___________ 和___________ 。
(5)写出E的元素符号:___________ ,要证明太阳上是否含有E元素,可采用的方法是___________ 。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为3s23p6;F为金属元素且原子核外p电子数和s电子数相等。
(1)B元素在元素周期表中的位置:
(2)上述元素中位于s区的有
(3)写出C元素基态原子价电子排布图:
(4)检验某溶液中是否含有D+,可通过
(5)写出E的元素符号:
您最近一年使用:0次
2021-06-02更新
|
733次组卷
|
5卷引用:云南省新平县一中2020-2021学年高二下学期期中考试化学试题
云南省新平县一中2020-2021学年高二下学期期中考试化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)广东省江门市第二中学2021-2022学年高二上学期期中考试化学试题(已下线)BBWYhjhx1112.pdf
解题方法
7 . 氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为___ ,B、C、N、O第一电离能由大到小的顺序为___ ,CH4、H2O、CO2的键角按照由大到小的顺序排列为___ 。
(2)与(HB=NH)3互为等电子体的有机分子为___ (填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
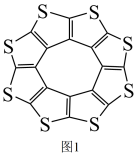
①C16S8分子中C原子和S原子的杂化轨道类型分别为___ 。
②相关键长数据如表所示:
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是___ 。
③C16S8与H2微粒间的作用力是___ 。
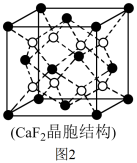
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为___ 。
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为___ cm3(用含a、NA的代数式表示,NA表示阿伏加 德罗常数的值)。

Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为
(2)与(HB=NH)3互为等电子体的有机分子为
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。

①C16S8分子中C原子和S原子的杂化轨道类型分别为
②相关键长数据如表所示:
| 化学键 | C—S | C=S | C16S8中碳硫键 |
| 键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是
③C16S8与H2微粒间的作用力是
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为

(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为

您最近一年使用:0次
解题方法
8 . 四种短周期元素的性质或结构信息如下表所示。请根据信息回答下列问题。
(1)写出元素T的离子结构示意图:______ ;写出元素X的气态氢化物的分子式:______ ;写出Z元素原子的核外电子排布式:________ ;元素Y的原子核外共有_______ 种形状不同的电子云。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式:______ 。
(3)元素T与氟元素相比,非金属性较强的是________ (用元素符号表示),下列表述中能证明这一事实的是___ (填字母)。
a.常温下氟气的颜色比T单质的深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素显正价
d.比较两元素的单质与氢气化合时得电子的数目
| 元素 | T | X | Y | Z |
| 性质或结构信息 | 原子核外s能级上的电子总数等于p能级上的电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 其单质为双原子分子,分子中含有3对共用电子对,常温下其气体单质性质稳定,但其原子较活泼 | 其单质质软,是银白色固体,导电性强。单质在空气中燃烧发出黄色火焰 | 第三周期元素的简单离子中半径最小 |
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式:
(3)元素T与氟元素相比,非金属性较强的是
a.常温下氟气的颜色比T单质的深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素显正价
d.比较两元素的单质与氢气化合时得电子的数目
您最近一年使用:0次
解题方法
9 . 回答下列问题。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
①判断下列化合物中属于离子化合物的是________ (填字母);
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为__________________________ ;NCl3水解产物为____________________ 。
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:
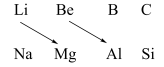
①铍的最高价氧化物的水化物是________ (填“酸性”、“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________________________________ ;
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为__________ (用化学式表示)。
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
①外层电子离核越远,能量越高,电离能越__________ (填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越________ (填“大”或“小”);
②上述11个电子分属________ 个电子层;
③失去了11个电子后,该元素还有________ 个电子;
④该元素最高价氧化物对应水化物的化学式是______________________________________ 。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
①判断下列化合物中属于离子化合物的是
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:

①铍的最高价氧化物的水化物是
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 |
| 电离能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
| 序号 | I7 | I8 | I9 | I10 | I11 | …… |
| 电离能 | 224.9 | 266.0 | 327.9 | 367.4 | 1761 | …… |
①外层电子离核越远,能量越高,电离能越
②上述11个电子分属
③失去了11个电子后,该元素还有
④该元素最高价氧化物对应水化物的化学式是
您最近一年使用:0次
2020-02-05更新
|
138次组卷
|
2卷引用:云南省普洱市景东县第二中学2019-2020学年高二上学期期末考试化学试题
10 . 科学研究证明核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子数及核电荷数有关。氩原子与硫离子的核外电子排布相同,核外电子排布式都是1s22s22p63s23p6。下列说法正确的是( )
| A.两粒子1s能级上电子的能量相同 |
| B.两粒子3p能级上的电子离核的距离相同 |
| C.两粒子的电子发生跃迁时,释放出的能量不同 |
| D.两粒子都达到8电子稳定结构,化学性质相同 |
您最近一年使用:0次
2018-12-18更新
|
272次组卷
|
5卷引用:云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题



