1 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: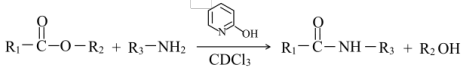 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
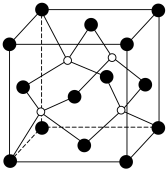
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近一年使用:0次
名校
2 . 原子序数依次增大的五种元素A、B、E、F、G,A是周期表中原子半径最小的元素;B的基态原子价层电子排布为 ;E的基态原子
;E的基态原子 能级有3个单电子;
能级有3个单电子;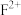 的
的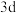 轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。回答下列问题:
轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。回答下列问题:
(1)F的基态原子的电子排布式为_______ 。
(2)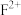 与
与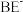 形成配离子时,配位数为4;
形成配离子时,配位数为4;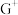 与
与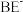 形成配离子时,配位数为2。工业上常用
形成配离子时,配位数为2。工业上常用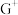 与
与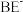 形成的配离子与F单质反应,生成
形成的配离子与F单质反应,生成 与
与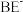 形成的配离子和G单质来提取G,写出上述反应的离子方程式
形成的配离子和G单质来提取G,写出上述反应的离子方程式_______ 。
(3)一种合成W(聚甲基丙烯酸甲酯)的流程中涉及化合物“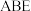 ”的应用,以下是其合成路线:
”的应用,以下是其合成路线:
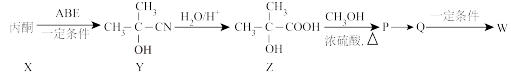
①X生成Y的反应类型是_______ 。
② 的化学方程式为
的化学方程式为_______ 。
③Q经加聚反应生成聚甲基丙烯酸甲酯,化学方程式为_______ 。
 ;E的基态原子
;E的基态原子 能级有3个单电子;
能级有3个单电子;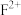 的
的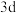 轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。回答下列问题:
轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。回答下列问题:(1)F的基态原子的电子排布式为
(2)
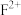 与
与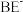 形成配离子时,配位数为4;
形成配离子时,配位数为4;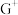 与
与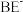 形成配离子时,配位数为2。工业上常用
形成配离子时,配位数为2。工业上常用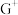 与
与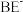 形成的配离子与F单质反应,生成
形成的配离子与F单质反应,生成 与
与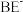 形成的配离子和G单质来提取G,写出上述反应的离子方程式
形成的配离子和G单质来提取G,写出上述反应的离子方程式(3)一种合成W(聚甲基丙烯酸甲酯)的流程中涉及化合物“
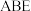 ”的应用,以下是其合成路线:
”的应用,以下是其合成路线:
①X生成Y的反应类型是
②
 的化学方程式为
的化学方程式为③Q经加聚反应生成聚甲基丙烯酸甲酯,化学方程式为
您最近一年使用:0次
解题方法
3 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
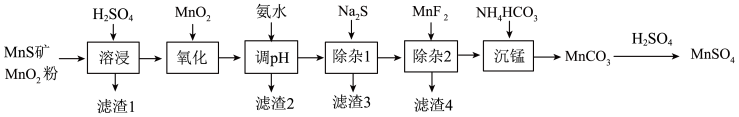
相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
(1)Fe2+的价电子排布式为_______ ,在元素周期表中Zn处于_______ 区。
(2)“滤渣1”含有S和_______ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(3)“氧化”中添加适量的MnO2的作用是_______ 。
(4)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(5)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______ 。
(6)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______ 。
(7)写出“沉锰”的离子方程式_______ 。
(8)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=_______ 。

相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)Fe2+的价电子排布式为
(2)“滤渣1”含有S和
(3)“氧化”中添加适量的MnO2的作用是
(4)“调pH”除铁和铝,溶液的pH范围应调节为
(5)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(6)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(7)写出“沉锰”的离子方程式
(8)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2023-12-15更新
|
280次组卷
|
4卷引用:云南省腾冲市2022-2023学年高三上学期期中教育教学质量监测理科综合试卷
云南省腾冲市2022-2023学年高三上学期期中教育教学质量监测理科综合试卷江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题(已下线)T15-工业流程题(已下线)T15-工业流程题
名校
解题方法
4 . (Ⅰ)瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。其结构如图所示:
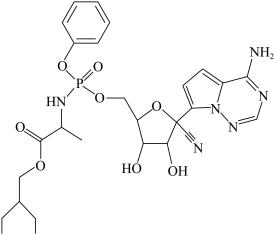
回答下列问题:
(1)该结构中基态P原子价电子的轨道表示式为___________ ,核外电子占据最高能级的电子云轮廓图形状为___________ 。
(2)瑞德西韦组成元素中位于第二周期元素的第一电离能从大到小的顺序为___________ ,分子中氮原子的杂化类型有___________ 。
(3)苯酚(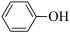 )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________ 。苯酚与甲苯(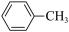 ,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是
,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是___________ 。
(Ⅱ)大力推广磷酸亚铁锂电池新能源汽车对实现“碳达峰”和“碳中和”具有重要意义。电极材料以硫铁矿(主要成分 ,含少量
,含少量 、
、 和
和 )为原料制备,工业流程如图所示。回答下列问题:
)为原料制备,工业流程如图所示。回答下列问题:
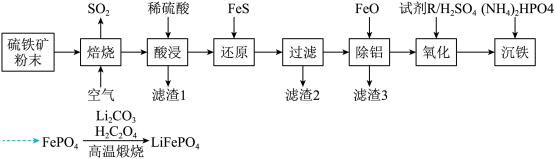
(4) 分子的空间结构名称为
分子的空间结构名称为___________ ,试剂R是一种绿色氧化剂,其中心原子杂化方式是___________ 。
(5)从平衡的角度解释加FeO除铝的原因(结合离子方程式说明)___________ 。
(6)若“沉铁”时溶液中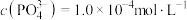 ,则“沉铁”时pH不能高于
,则“沉铁”时pH不能高于___________ ,[已知:常温下,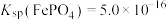 、
、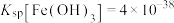 、
、 ,溶液体积变化忽略不计]。
,溶液体积变化忽略不计]。
(7)磷酸亚铁锂( )的晶胞结构如图所示:
)的晶胞结构如图所示:
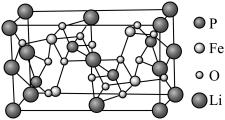
长方体晶胞的长和宽均为 ,高为
,高为 ,
, 为阿伏加德罗常数的值,晶体的密度为
为阿伏加德罗常数的值,晶体的密度为___________  。
。

回答下列问题:
(1)该结构中基态P原子价电子的轨道表示式为
(2)瑞德西韦组成元素中位于第二周期元素的第一电离能从大到小的顺序为
(3)苯酚(
 )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是 ,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是
,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是(Ⅱ)大力推广磷酸亚铁锂电池新能源汽车对实现“碳达峰”和“碳中和”具有重要意义。电极材料以硫铁矿(主要成分
 ,含少量
,含少量 、
、 和
和 )为原料制备,工业流程如图所示。回答下列问题:
)为原料制备,工业流程如图所示。回答下列问题:
(4)
 分子的空间结构名称为
分子的空间结构名称为(5)从平衡的角度解释加FeO除铝的原因(结合离子方程式说明)
(6)若“沉铁”时溶液中
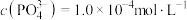 ,则“沉铁”时pH不能高于
,则“沉铁”时pH不能高于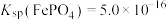 、
、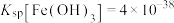 、
、 ,溶液体积变化忽略不计]。
,溶液体积变化忽略不计]。(7)磷酸亚铁锂(
 )的晶胞结构如图所示:
)的晶胞结构如图所示:
长方体晶胞的长和宽均为
 ,高为
,高为 ,
, 为阿伏加德罗常数的值,晶体的密度为
为阿伏加德罗常数的值,晶体的密度为 。
。
您最近一年使用:0次
解题方法
5 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰( 主要含ZnO,还含少量FeO、Al2O3、 CuO 及SiO2)为原料制取磷酸锌的工艺流程如图所示:
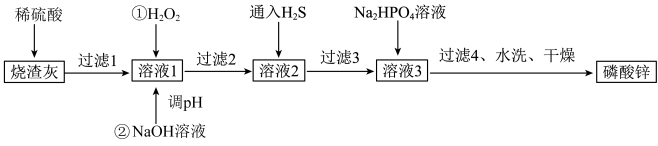
已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
回答下列问题:
(1)基态锌原子的价电子排布式为_____________ 。
(2)加入H2O2的作用是___________________________ 。
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是___________ 。
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:_________________ 。
(5)洗涤磷酸锌沉淀时应选用________ (填“冷水”或“热水”),洗涤沉淀的操作是________________ 。
(6)图是碳化硅的晶胞结构,其晶体类型属于___________ 晶体。若碳化硅晶胞边长为a pm,阿伏加德罗常数的值为NA,则碳化硅晶体的密度为______________ g·cm-3 (列出计算式即可)。

已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4. | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)基态锌原子的价电子排布式为
(2)加入H2O2的作用是
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:
(5)洗涤磷酸锌沉淀时应选用
(6)图是碳化硅的晶胞结构,其晶体类型属于

您最近一年使用:0次
名校
6 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
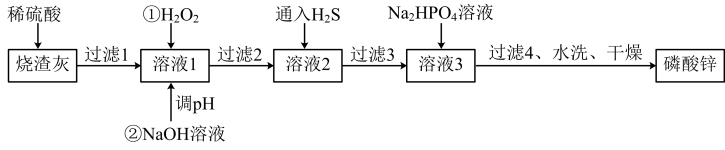
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)基态Zn原子的价电子排布式为______
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是______ (填一条)。
(3)加入H2O2的作用_______
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是______ 。
(5)加入Na2HPO4溶液发生反应的离子方程式为_____ 。
(6)洗涤磷酸锌沉淀时应选用____ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是_____ 。
(7)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=______ (已知:25°C时,H2S的电离平衡常数Ka1=1×10-7,Ka2=1×10-15)。

已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是
(3)加入H2O2的作用
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(5)加入Na2HPO4溶液发生反应的离子方程式为
(6)洗涤磷酸锌沉淀时应选用
(7)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=
您最近一年使用:0次
2022-08-25更新
|
488次组卷
|
3卷引用:云南师范大学附属中学2022-2023学年高三上学期高考适应性月考卷(二)理科综合化学试题
22-23高三下·湖南·阶段练习
名校
解题方法
7 . 重铬酸钾( )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
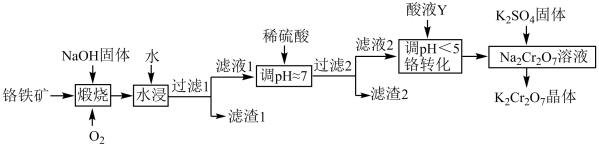
回答下列问题:
(1)基态Cr原子的未成对电子数为_______ 。二氧化硅比二氧化碳熔点高得多的最主要原因是_______ 。
(2)煅烧铬铁矿后生成 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为_______ ;滤液1中的阴离子主要有 、
、_______ 。
(3)流程中若省去 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是_______ 。
(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:_______ 。
(5)由于 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于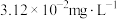 。已知室温下,
。已知室温下,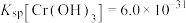 。
。
① 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
②溶液的pH至少要大于_______ 。
 )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
回答下列问题:
(1)基态Cr原子的未成对电子数为
(2)煅烧铬铁矿后生成
 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为 、
、(3)流程中若省去
 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:
(5)由于
 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于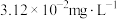 。已知室温下,
。已知室温下,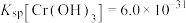 。
。①
 参加反应的离子方程式为
参加反应的离子方程式为②溶液的pH至少要大于
您最近一年使用:0次
2023-02-17更新
|
353次组卷
|
4卷引用:云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题
(已下线)云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题湖南省名校联盟2022-2023学年高三下学期2月联考化学试题湖南省岳阳市第一中学2023届高三下学期第七次月考化学试题
解题方法
8 . 碳元素是形成单质及其化合物种类最多的元素,其单质与化合物广泛分布于自然界。碳是地球上组成生命的最基本元素之一,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列有关问题:
(1)碳元素可形成多种不同形式的单质,如图1是几种碳的单质的结构图:
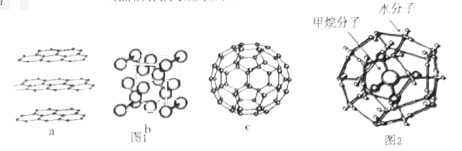
观察上述结构,a对应石墨晶体模型,b对应的物质是金刚石,c是 的分子结构模型。判断b中碳原子的杂化方式为
的分子结构模型。判断b中碳原子的杂化方式为___________ ,在 单质中,微粒之间的作用力为
单质中,微粒之间的作用力为___________ 。
(2)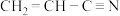 是制备晴纶的原料,其分子中
是制备晴纶的原料,其分子中 键和
键和 键的个数之比为
键的个数之比为___________ (填最简整数比)。
(3)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构, 分子存在于
分子存在于 分子形成的笼子中(如图2所示)。两种分子中,共价键的键能
分子形成的笼子中(如图2所示)。两种分子中,共价键的键能 键
键___________  键(填“大于”或“小于”);
键(填“大于”或“小于”); 分子与
分子与 分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是
分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是___________ 。
(4) 是碳元素的常见氧化物,分子中C原子上有一对孤对电子,
是碳元素的常见氧化物,分子中C原子上有一对孤对电子, 的结构式为
的结构式为 。
。 可以和很多过渡金属形成配合物。金属镍粉在
可以和很多过渡金属形成配合物。金属镍粉在 气流中轻微地加热,可生成液态的
气流中轻微地加热,可生成液态的 ,用配位键表示
,用配位键表示 的结构为图3;
的结构为图3; 是无色液体,沸点42.1℃,熔点
是无色液体,沸点42.1℃,熔点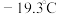 ,难溶于水,易溶于有机溶剂,推测
,难溶于水,易溶于有机溶剂,推测 是
是___________ 分子(填“极性”或“非极性”)。 元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态
元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态 原子的电子排布式为:
原子的电子排布式为:___________ ,其位于元素周期表的___________ 区。镍 可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在
可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在___________ (填序号)。
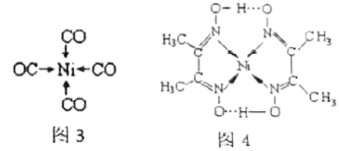
A.氢键 B.离子键 C.共价键 D.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是___________ 。
(1)碳元素可形成多种不同形式的单质,如图1是几种碳的单质的结构图:

观察上述结构,a对应石墨晶体模型,b对应的物质是金刚石,c是
 的分子结构模型。判断b中碳原子的杂化方式为
的分子结构模型。判断b中碳原子的杂化方式为 单质中,微粒之间的作用力为
单质中,微粒之间的作用力为(2)
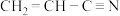 是制备晴纶的原料,其分子中
是制备晴纶的原料,其分子中 键和
键和 键的个数之比为
键的个数之比为(3)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,
 分子存在于
分子存在于 分子形成的笼子中(如图2所示)。两种分子中,共价键的键能
分子形成的笼子中(如图2所示)。两种分子中,共价键的键能 键
键 键(填“大于”或“小于”);
键(填“大于”或“小于”); 分子与
分子与 分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是
分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是(4)
 是碳元素的常见氧化物,分子中C原子上有一对孤对电子,
是碳元素的常见氧化物,分子中C原子上有一对孤对电子, 的结构式为
的结构式为 。
。 可以和很多过渡金属形成配合物。金属镍粉在
可以和很多过渡金属形成配合物。金属镍粉在 气流中轻微地加热,可生成液态的
气流中轻微地加热,可生成液态的 ,用配位键表示
,用配位键表示 的结构为图3;
的结构为图3; 是无色液体,沸点42.1℃,熔点
是无色液体,沸点42.1℃,熔点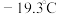 ,难溶于水,易溶于有机溶剂,推测
,难溶于水,易溶于有机溶剂,推测 是
是 元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态
元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态 原子的电子排布式为:
原子的电子排布式为: 可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在
可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在
A.氢键 B.离子键 C.共价键 D.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是
您最近一年使用:0次
2021-02-01更新
|
166次组卷
|
2卷引用:云南省丽江市重点中学2021-2022学年高二上学期11月月考化学试题
9 . 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图_____________________ 。
②氮所在的周期中,第一电离能最大的元素为_____________ (填元素符号)。
③与N3互为等电子体的粒子为____________ (写出一种)。
④氨气的电子式____________ 。
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因是____________
(3)依据价层电子对互斥理论,NO3-间构型呈__________ 形。
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是_________ 。
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α﹣Fe、γ﹣Fe的堆积方式分别与钾和铜相同
C.空间利用率α﹣Fe大于γ﹣Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α﹣Fe:γ﹣Fe)的密度比值为___________ 。(写成小数,保留2位有效数字)

2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图
②氮所在的周期中,第一电离能最大的元素为
③与N3互为等电子体的粒子为
④氨气的电子式
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因是
(3)依据价层电子对互斥理论,NO3-间构型呈
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α﹣Fe、γ﹣Fe的堆积方式分别与钾和铜相同
C.空间利用率α﹣Fe大于γ﹣Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α﹣Fe:γ﹣Fe)的密度比值为

您最近一年使用:0次



